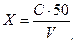Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Определение массовой концентрации общего железа
Цель работы: научиться определять массовую концентрацию общего железа с ортофенантролином фотометрическим методом.
Основные теоретические положения Железо – один из самых распространенных элементов в природе. Известно свыше 300 минералов, содержащих соединения железа. Железо является жизненно важным микроэлементом для живых организмов и растений. В малых концентрациях железо встречается практически во всех природных (до 1 мг/л) и особенно сточных водах. В последние, железо может попадать из отходов (сточных вод) травильных и гальванических цехов, участков подготовки металлических поверхностей, стоков при крашении тканей и др. При концентрации железа свыше 1 мг/л вода приобретает вяжущий привкус. Высокое содержание железа ухудшает органолептические свойства воды, делает воду непригодной в маслосыродельном и текстильном производствах, усиливает размножение железоусваивающих микроорганизмов в водопроводных трубах, что ведет к зарастанию труб. ПДК общего железа в питьевой и природных водах не должно превышать 0,3 мг/л. Поскольку соединения железа в воде могут существовать в различных формах, как в растворе, так и в виде различных взвешенных в воде твердых минеральных частиц, точные результаты могут быть получены только при определении суммарного железа во всех формах, так называемого общего железа. Сущность метода Фотометрический метод определения общего железа основан на способности катиона железа (II) в интервале pH 3÷9 образовывать с ортофенантролином комплексное соединение, окрашенное оранжево-красный цвет. Интенсивность окрашивания пропорциональна концентрации железа (II). Наблюдается линейная зависимость между концентрацией и поглощающей способностью. При наличии в воде железа (III), оно восстанавливается до железа (II) солянокислым гидроксиламином в нейтральной или слабокислой среде по реакции Fe3+ + 2 NH2OH Таким образом, определяется суммарное содержание железа(II) и железа (III). Анализ проводится в ацетатном буферном растворе при pH 4÷5. Диапазон измерения массовой концентрации общего железа без разбавления пробы составляет 0,05÷2,0 мг/л.
Аппаратура, посуда и реактивы Фотометр фотоэлектрический марки ФЭК-3, длина волны 540 нм
Кюветы с толщиной рабочего слоя 2÷5 см Плитка электрическая Колбы мерные на 50 и 1000 мл, колбы конические плоскодонные термостойкие на 100÷200 мл, пипетки на 1, 2, 5, 10 и 25 мл Основной стандартный раствор железоаммонийных квасцов (в 1 мл 0,1 мг Fe), рабочий стандартный раствор железоаммонийных квасцов (в 1 мл 0,005 мг Fe), кислота соляная концентрированная, раствор гидроксиламина солянокислого (10 %), раствор буферный ацетатный (pH 4,5), раствор ортофенантролина (0,1 %), раствор аммиака (25 %), вода дистиллированная
Подготовка к выполнению работы Изучить инструкцию по работе на фотометре фотоэлектрическом марки ФЭК-3.
Порядок выполнения работы Определению содержания железа мешают цианиды, нитриты, полифосфаты; хром и цинк; кобальт и медь. Предварительное кипячение воды с кислотой превращает полифосфаты в ортофосфаты, добавлением гидроксиламина устраняется мешающее влияние окислителей. Мешающее влияние меди уменьшается при рН 2,5÷4. При отсутствии полифосфатов исследуемую воду тщательно перемешивают и отбирают 25 мл (или меньший объем, содержащий не более 0,1 мг железа, разбавленный до 25 мл дистиллированной водой) в мерную колбу вместимостью 50 мл. Если при отборе вода была подкислена, то ее нейтрализуют 25 %-ным раствором аммиака до рН 4÷5, контролируя потенциометрически или по индикаторной бумаге. Затем добавляют 1 мл солянокислого раствора гидроксиламина, 2,0 мл ацетатного буферного раствора и 1 мл раствора ортофенантролина. После прибавления каждого реактива раствор перемешивают, затем доводят объем до 50 мл дистиллированной водой, тщательно перемешивают и оставляют на 15÷20 мин для полного развития окраски. Окрашенный раствор фотометрируют ( Концентрацию железа находят по градуировочному графику. В присутствии полифосфатов 25 мл исследуемой пробы помещают в плоскодонную колбу, вместимостью 100÷150 мл, прибавляют 1 мл концентрированной соляной кислоты, нагревают до кипения и упаривают до объема 15÷20 мл. После охлаждения раствора его переносят в мерную колбу вместимостью 50 мл, добавляют дистиллированную воду до объема примерно 25 мл и доводят 25 %-ным раствором аммиака до рН 4÷5, контролируя потенциометрически или по индикаторной бумаге. Далее прибавляют реактивы и проводят анализ, как указано выше (при отсутствии полифосфатов).
Для построения калибровочного графика в мерные колбы вместимостью 50 мл вносят 0,0; 0,5; 1,0; 2,0; 3,0; 4,0; 5,0; 10,0; 20,0 мл рабочего стандартного раствора железоаммонийных квасцов, содержащего в 1 мл 0,005 мг железа, доводят объем дистиллированной водой приблизительно до 25 мл и анализируют так же, как и исследуемую воду. Получают шкалу стандартных растворов с массовой концентрацией железа 0,0; 0,05; 0,1; 0,2; 0,3; 0,4; 0,5; 1,0; 2,0 мг/л. Фотометрируют в тех же условиях, что и пробу. Строят калибровочный график, откладывая по оси абсцисс массовую концентрацию общего железа в мг/л, а на оси ординат – соответствующие значения оптической плотности.
Обработка результатов Массовую концентрацию железа в анализируемой пробе (мг/л) с учетом разбавления вычисляют по формуле
где С – концентрация железа, найденная по градуировочному графику, мг/л; V – объем пробы, взятый для анализа, мл; 50 – объем, до которого разбавлена проба.
Вопросы для самопроверки 1. Что такое общее железо? 2. Источники образования железа в сточных и питьевой водах? 3. Какие свойства воды ухудшает высокое содержание железа, к чему это приводит? 4. ПДК общего железа в питьевой и природных водах? 5. Сущность фотометрического метода определения общего железа? 6. Какая зависимость наблюдается между концентрацией железа и поглощающей способностью? Лабораторная работа №3.
|
||||||
|
Последнее изменение этой страницы: 2016-12-12; просмотров: 2286; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.133.108.241 (0.01 с.) |
 HCl = Fe2+ + N2 + 2H2O + 2HCl + 2H+
HCl = Fe2+ + N2 + 2H2O + 2HCl + 2H+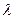 =490÷500 нм) в кюветах с толщиной оптического слоя 2, 3 или 5 см по отношению к дистиллированной воде, в которую добавлены те же реактивы.
=490÷500 нм) в кюветах с толщиной оптического слоя 2, 3 или 5 см по отношению к дистиллированной воде, в которую добавлены те же реактивы.