Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Опыт Резерфорда по изучению радиоактивности
Вслед за супругами Кюри изучением радиоактивности стал заниматься английский ученый Эрнест Резерфорд. И в 1899 году он провел эксперимент по изучению состава радиоактивного излучения. В чем заключался опыт Э.Резерфорда? В свинцовый цилиндр была помещена соль урана. Через очень узкое отверстие в этом цилиндре луч попадал на фотопластинку, расположенную над этим цилиндром.
Рис. 2. Схема опыта Резерфорда
В самом начале эксперимента магнитного поля не было. Поэтому фотопластинка так же, как и в опытах супругов Кюри, так же, как в опытах А. Беккереля, засвечивалась в одной точке. Затем было включено магнитное поле, причем так, что величина этого магнитного поля могла изменяться. В результате при малом значении магнитного поля луч разделился на две составляющие. А когда магнитное поле стало еще больше, появилось третье темное пятно. Вот эти пятна, которые образовались на фотопластинке, назвали a-, b-, и g-лучами. Свойства радиоактивных лучей Вместе с Резерфордом над проблемой изучения радиоактивности работал английский химик по фамилии Содди. Содди вместе с Резерфордом поставили эксперимент по изучению химических свойств этих излучений. Стало ясно, что: a -лучи – поток достаточно быстрых ядер атомов гелия, b -лучи – на самом деле поток быстрых электронов, g -лучи – электромагнитное излучение высокой частоты. Сложное строение атома Выяснилось, что внутри ядра, внутри атома происходят некие сложные процессы, которые приводят к такому излучению. Вспомним, что само слово «атом» в переводе с греческого означает «неделимый». И со времен Древней Греции все считали, что атом – это мельчайшая частица химического элемента со всеми его свойствами, и уже меньше этой частицы в природе не существует. В результате открытия радиоактивности, самопроизвольного излучения различных электромагнитных волн и новых частиц ядер атомов можно говорить о том, что и атом тоже является делимым. Атом тоже состоит из чего-то и имеет сложную структуру. Заключение Список дополнительной литературы 1. Бронштейн М.П. Атомы и электроны. «Библиотечка “Квант”». Вып. 1. М.: Наука, 1980 2. Кикоин И.К., Кикоин А.К. Физика: Учебник для 9 класса средней школы. М.: «Просвещение»
3. Китайгородский А.И. Физика для всех. Фотоны и ядра. Книга 4. М.: Наука 4. Кюри П. Избранные научные труды. М.: Наука 5. Мякишев Г.Я., Синякова А.З. Физика. Оптика Квантовая физика. 11 класс: учебник для углубленного изучения физики. М.: Дрофа 6. Ньютон И. Математические начала натуральной философии. М.: Наука, 1989 7. Резерфорд Э. Избранные научные труды. Радиоактивность. М.: Наука 8. Резерфорд Э. Избранные научные труды. Строение атома и искусственное превращение элементов. М.: Наука 9. Слободянюк А.И. Физика 10. Часть 1. Механика. Электричество 10. Филатов Е.Н. Физика 9. Часть 1. Кинематика. ВШМФ «Авангард» 11. Эйнштейн А., Инфельд Л. Эволюция физики. Развитие идей от первоначальных понятий до теории относительности и квантов. М.: Наука, 1965
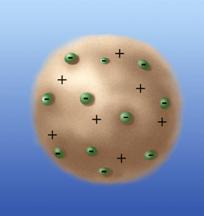
Тема: Строение атома и атомного ядра Урок 52. Модели атомов. Опыт Резерфорда Ерюткин Евгений Сергеевич На предыдущем уроке мы обсудили, что в результате радиоактивности образуются различные виды излучений: a-, b-, и g-лучи. Появился инструмент, при помощи которого можно было изучать строение атома. Модель Томсона После того как стало ясно, что атом тоже имеет сложную структуру, как-то по-особенному устроен, необходимо было исследовать само строение атома, объяснить, как он устроен, из чего состоит. И вот ученые приступили к этому изучению. Первые идеи о сложном строении были высказаны Томсоном, который в 1897 году открыл электрон. В 1903 году Томсон впервые предложил модель атома. По теории Томсона атом представлял собой шар, по всему объему которого «размазан» положительный заряд. А внутри, как плавающие элементы, находились электроны. В целом, по Томсону, атом был электронейтрален, т.е. заряд такого атома был равен 0. Отрицательные заряды электронов компенсировали положительный заряд самого атома. Размер атома составлял приблизительно 10-10м. Модель Томсона получила название «пудинг с изюмом»: сам «пудинг» – это положительно заряженное «тело» атома, а «изюм» – это электроны.
Рис. 1. Модель атома Томсона («пудинг с изюмом»)
Модель Резерфорда Первый достоверный опыт по определению строения атома удалось провести Э. Резерфорду. На сегодняшний день мы твердо знаем, что атом представляет собой структуру, напоминающую планетную солнечную систему. В центре находится массивное тело, вокруг которого вращаются планеты. Такая модель атома получила название планетарной модели.
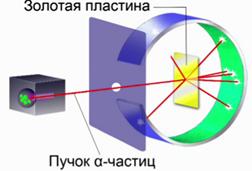
Опыт Резерфорда Давайте обратимся к схеме опыта Резерфорда и обсудим результаты, которые привели к созданию планетарной модели.
Рис. 2. Схема опыта Резерфорда
Внутрь свинцового цилиндра с узким отверстием был заложен радий. При помощи диафрагмы создавался узкий пучок a-частиц, которые, пролетая через отверстие диафрагмы, попадали на экран, покрытый специальным составом, при попадании возникала микро-вспышка. Такое свечение при попадании частиц на экран называется «сцинтиляционная вспышка». Такие вспышки наблюдались на поверхности экрана при помощи микроскопа. В дальнейшем до тех пор, пока в схеме не было золотой пластины, все частицы, которые вылетали из цилиндра, попадали в одну точку. Когда же внутрь экрана на пути летящих a-частиц была поставлена очень тонкая пластинка из золота, стали наблюдаться совершенно непонятные вещи. Как только была поставлена золотая пластина, начались отклонения a-частиц. Были замечены частицы, которые отклонялись от своего первоначального прямолинейного движения и уже попадали в совершенно другие точки этого экрана. Более того, когда экран сделали почти замкнутым, выяснилось, что есть частицы, которые каким-то образом летят в обратную сторону. Они отклоняются под углом 90° и больше. Эти наблюдения были проанализированы Резерфордом, и выяснилась следующая довольно любопытная вещь.
|
||||||
|
Последнее изменение этой страницы: 2016-12-12; просмотров: 5704; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.130.31 (0.009 с.) |