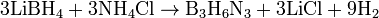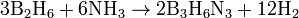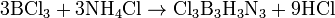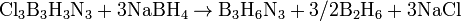Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Общая характеристика элементов III А группы(13-й группы).
Элементы 13-й группы: бор 5В, алюминий 13Аl, галлий 31Ga, индий 49In и таллий 81Тl — имеют мало стабильных изотопов, что характерно для атомов с нечетными порядковыми номерами. Электронная конфигурация основного состояния ns2np1 характеризуется наличием единственного неспаренного электрона. В возбужденном состоянии они содержат три неспаренных электрона, которые, находясь в sp2-гибридизации, участвуют в образовании трех ковалентных связей. При этом у атомов элементов 13-й группы остается одна незанятая орбиталь, и число валентных электронов оказывается меньше числа доступных по энергии орбиталей. Поэтому многие ковалентные соединения элементов 13-й группы являются кислотами Льюиса — акцепторами электронной пары, приобретая которую, они не только повышают координационное число до четырех, но и изменяют геометрию своего окружения — она из плоской становится тетраэдрической (состояние sp3-гибридизации). Бор сильно отличается по свойствам от других элементов 13-й группы. Он — единственный неметалл, химически инертен и образует ковалентные связи В—F, В—N, В—С и т.д., кратность которых часто повышена за счет рπ-рπ - связывания. Химия бора более близка химии кремния, в этом проявляется диагональное сходство. У атомов алюминия и его тяжелых аналогов появляются вакантные d-орбитали, возрастает радиус атома, поэтому координационное число увеличивается до шести (и более). Галлий, индий и таллий расположены в Периодической системе сразу за металлами d-блока, поэтому их часто называют постпереходными элементами. Заполнение d-оболочки сопровождается последовательным сжатием атомов, в 3d-ряду оно оказывается настолько сильным, что нивелирует возрастание радиуса при появлении четвертого энергетического уровня. В результате d-сжатия ионные радиусы алюминия и галлия близки, а атомный радиус галлия даже меньше, чем алюминия. Энергия ионизации атомов элементов 3-й (13-й) группы главной подгруппы более высокая, чем элементов 3-й(13-й) группы побочной подгруппы, что связано с усилением взаимодействия ns- и nр-электронов с ядром за счет заполнения d- и f-оболочек электронами, слабо экранирующими заряд ядра. Для соединений элементов 13-й группы наиболее характерна степень окисления +3. В ряду В—AI—Ga—In—Тl устойчивость таких соединений уменьшается, а устойчивость соединений со степенью окисления +1, напротив, увеличивается. Энергия связи М—Г в галогенидах при переходе от легких к более тяжелым элементам уменьшается, амфотерные свойства оксидов и гидроксидов смещаются в сторону большей основности.
Химия индия и особенно галлия вообще очень близка химии алюминия. Соединения этих металлов в низших степенях окисления (Ga20, Ga2S, InCl, In[lnCl4] и др.) в водных растворах диспропорционируют: 3lnСl = InС13 + 2 In. Для таллия состояние +1, напротив, является наиболее устойчивым вследствие инертности электронной пары 6s2.
Бор сравнительно мало распространен в земной коре (9 • 10-4 мас. %), где он встречается в виде кислородных соединений: боратов и боросиликатов. От названия одного из них — буры Na2B407.Н2О (лат. borax) — и происходит название элемента. Алюминий по содержанию в земной коре (8,3 мас.%) занимает третье место, уступая только кислороду (45,5 мас.%) и кремнию (25,7 мас.%). Алюминий — наиболее распространенный металл, его важнейшими рудами и минералами являются бокситы А12О3.2Н2О корунд А12О3 и нефелин Na3K[AlSiО4]4, также он входит в состав полевых шпатов, слюд, глин и др. Галлий (4,6 • 10-4 мас.%), индий (2 • 10-6 мас.%) и таллий (8 • 10-7 мас.%) относятся к редким элементам. Вследствие близости ионных радиусов галлий сопутствует алюминию в бокситах, а таллий — калию в алюмосиликатах.
Бор — тугоплавкий диамагнитный порошок черного (кристаллический) или бурого (аморфный) цвета, плохой проводник тепла и электричества. Алюминий, галлий, индий и таллий — серебристые металлы с характерным блеском и высокой электро- и теплопроводностью. При хранении на воздухе таллий быстро темнеет, так как покрывается пленкой оксида.
Кристаллический бор химически инертен. С кислородом он реагирует лишь около 750 °С с образованием оксида В203. Кипящие концентрированные растворы HF, НС1 и NaOH на него не действуют. Аморфный бор химически более активен и медленно окисляется горячими концентрированными HN03, H2S04, хромовой смесью, концентрированными растворами Н202 и (NH4)2S2О8: В + 3HN03 = Н3ВО3 + 3N02
Реагирует с расплавленными Na202 и KNО 3 /Na 2 CО3, а в присутствии окислителя — и с щелочами: 4В + 4NaOH + 302 = 4NaB02 + 2Н20 Смеси аморфного бора с КМn04 и РЬ02 при растирании загораются, а смеси с НIO3 взрываются. При высоких температурах бор реагирует с большинством простых веществ, за исключением Н2, Ge, Те, инертных газов и ртути. Алюминий, галлий и индий взаимодействуют с неметаллами (02, N2, S, галогенами Х2 и др.), образуя соответствующие оксиды М203, нитриды MN, сульфиды M2S3, галогениды МХ3. В избытке металла могут быть получены низшие сульфиды (GaS, InS) и галогениды (InBr, In[InBr4]). Таллий в этих условиях образует соединения со степенью окисления +1. Реакция окисления алюминия кислородом сопровождается выделением большого количества теплоты и используется для восстановления многих металлов из их оксидов, например: 2Аl + Fe203 = Аl203 + 2Fe Со многими металлами алюминий и его аналоги образуют химические соединения — интерметаллиды, например CuA12, Al2CuMg и др. Металлы Аl, Ga, In, Тl располагаются левее водорода в ряду напряжений, и их окисление водой и кислотами-неокислителями термодинамически возможно: 2А1 + 6Н+ + 12Н20 = 2[Аl(Н20)6]3+ + ЗН2 Индий и таллий также растворяются в кислотах, но таллий (из-за понижения устойчивости соединений Тl(III) при взаимодействии с кислотами-неокис- лителями образует соли Т1(1). Реакция таллия с галогеноводородными кислотами НХ (X = Cl, Br, I) тормозится вследствие низкой растворимости галогенидов. Производные Tl(III) образуются при действии на Tl «царской водки» (три объема НСl(конц.) + один объем HNO3(конц.)) и других сильных окислителей. Основные свойства соединений возрастают в ряду Аl — Ga— In—Тl, а кислотные свойства убывают. Алюминий и галлий подобно некоторым типичным неметаллам реагируют со щелочами, которые растворяют защитный оксидный слой: 2А1 + 2NaOH + 10Н20 = 2Na[Al(H20)2(0H)4] + ЗН2
Бор. Причина преобладания у бора неметаллических свойств. Получение бора, его физические и химические свойства. Соединения бора с металлами и неметаллами. Карбид бора; нитрид бора гексагональный и кубический (боразон). Галогениды бора. Неорганические полимеры на основе соединений бора. Тетрафтороборная кислота, ее соли. Боразол – аналог бензола. Бор — элемент главной подгруппы третьей группы, второго периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 5. Бор — тугоплавкий диамагнитный порошок черного (кристаллический) или бурого (аморфный) цвета, плохой проводник тепла и электричества. Известно более 10 аллотропных модификаций бора. Впервые получен в 1808 году французскими физиками Ж. Гей-Люссаком и Л. Тенаром нагреванием борного ангидрида B2O3 с металлическим калием. Через несколько месяцев бор получил Х. Дэви электролизом расплавленного B2O3. Чрезвычайно твёрдое вещество (уступает только алмазу, нитриду углерода, нитриду бора (боразону), карбиду бора, сплаву бор-углерод-кремний, карбиду скандия-титана). В природе бор находится в виде двух изотопов 10В (20 %) и 11В (80 %). 10В имеет очень высокое сечение поглощения тепловых нейтронов, поэтому 10В в составе борной кислоты применяется в атомных реакторах для регулирования реактивности. Химические свойства. По многим физическим и химическим свойствам неметалл бор напоминает кремний. Химически бор довольно инертен и при комнатной температуре взаимодействует только со фтором:
При нагревании бор реагирует с другими галогенами с образованием тригалогенидов, с азотом образует нитрид бора BN, с фосфором — фосфид BP, с углеродом — карбиды различного состава (B4C, B12C3, B13C2). При нагревании в атмосфере кислорода или на воздухе бор сгорает с большим выделением теплоты, образуется оксид B2O3:
С водородом бор напрямую не взаимодействует, хотя известно довольно большое число бороводородов (боранов) различного состава, получаемых при обработке боридов щелочных или щелочноземельных металлов кислотой:
При сильном нагревании бор проявляет восстановительные свойства. Он способен, например, восстановить кремний или фосфор из их оксидов:
Данное свойство бора можно объяснить очень высокой прочностью химических связей в оксиде бора B2O3. При отсутствии окислителей бор устойчив к действию растворов щелочей. В горячей азотной, серной кислотах и в царской водке бор растворяется с образованием борной кислоты. Оксид бора — типичный кислотный оксид. Он реагирует с водой с образованием борной кислоты:
При взаимодействии борной кислоты со щелочами возникают соли не самой борной кислоты — бораты (содержащие анион BO33−), а тетрабораты, например:
Получение. Аморфный бор, сильно загрязненный боридами металлов, получают металлотермическим восстановлением оксида или обезвоженной буры: В203 + 3Mg = 2В + 3MgO Более чистый продукт образуется при восстановлении летучих соединений бора водородом на нагретой до 1150 °С танталовой проволоке: 2BBr3 + ЗН2 = 2В + 6НВr или при их термическом разложении: 2BI3+2H2 = 2В + 3I2 Соединения бора. Сульфид бора (B2S3) образуется в виде бесцветной стекловидной массы при накаливании бора в парах серы. Водой он полностью разлагается на борную кислоту и H2 S. С азотом бор соединяется только выше 1200 °С. Нитрид бора (BN) представляет собой белый порошок, плавящийся лишь около 3000 °С (под давлением). По кристаллической структуре BN сходен с графитом. Карбид бора (В4С) образуется в виде черных блестящих кристаллов принакаливании смеси бора (или В2 О3) с углем в электрической печи. Он отличается тугоплавкостью (т. пл. 2550 °С) и чрезвычайной твердостью (близкой к твердости алмаза). И нитрид и карбид бора характеризуются большой устойчивостью по отношению к различным химическим воздействиям. БОРА НИТРИД, BN, кристаллический, имеет три модификации: гексагональную a-BN, кубическую b-BN (боразон) и ромбоэдрическую g-BN.
Гексагональный нитрид бора альфа-BN. Кристаллическая структура a-BN состоит из графитоподобных сеток, расположенных, в отличие от структуры графита точно одна под другой с чередованием атомов бора и азота. Белый, похожий на тальк порошок a-BN, получают из элементов при температурах выше 2000 °С. Нитрид бора может быть получен также прокаливанием бора (или B2O3) в атмосфере аммиака или при нагревании смеси B2O3 с восстановителями (углем, магнием) в атмосфере аммиака. По смазочным свойствам a-BN превосходит графит. В спрессованном состоянии нитрид бора обладает полупроводниковыми свойствами, а при наличии небольшого количества примесей обладает люминесцентными свойствами. Нитрид бора при комнатной температуре химически инертен, не реагирует с кислородом или хлором, кислотами или щелочами. Кислород и хлор начинают действовать на него при температурах выше 700 °С. Реагирует с фтором (образуя BF3 и N2) и с HF (образуя NH4BF4); горячие растворы щелочей разлагают его с выделением NH3. При температуре выше 1000°С начинает разлагаться на элементы. Алмазоподобная форма бета-BN (боразон). При давлении выше 62 тыс атм и температурах выше 1350 °С происходит полиморфное превращение графитоподобной гексагональной b-BN модификации в кубическую алмазоподобную b-BN структуру. Хорошими катализаторами такого превращения являются щелочные и щелочноземельные металлы. Как и в случае перехода графит—алмаз, полиморфное превращение сопровождается резким изменением свойств нитрида бора. Кристаллы боразона, полученные при аллотропическом переходе BN (гекс.) — BN (куб.) при высоких давлениях, имеют вид полиэдров, обычно тетраэдров или октаэдров. Они прозрачны, а их цвет зависит от наличия и типа примесей. Размер образующихся кристаллов боразона зависит от давления и температуры процесса. Избыток бора в реакционной смеси придавал полученным кристаллам боразона коричневый или черный цвет, бериллий — синий, сера — желтый. Твердость его при оценке по шкале Мооса соизмерима с твердостью алмаза (около 10 баллов), однако боразон сильно превосходит алмаз по термостойкости (до 2000 °С) и ударной прочности. Химическая стойкость боразона значительно выше, чем обычной формы нитрида бора. Ромбоэдрический гамма-BN.
Ромбоэдрическая модификация g-BN обнаружена наряду с гексагональной при получении нитрида бора взаимодействием бората натрия с цианистым калием. Нитрид бора и материалы на его основе занимают заметное место в ряду важнейших инструментальных материалов и являются основой многих современных технологий. Он нашел широкое применение в реакциях промышленного органического синтеза и при крекинге нефти, в изделиях высокотемпературной техники, в производстве полупроводников, получении высокочистых металлов, газовых диэлектриков, как средство для тушения возгораний. Из нитрида бора изготовляют высокоогнеупорные материалы, проявляющие как полупроводниковые, так и диэлектрические свойства.
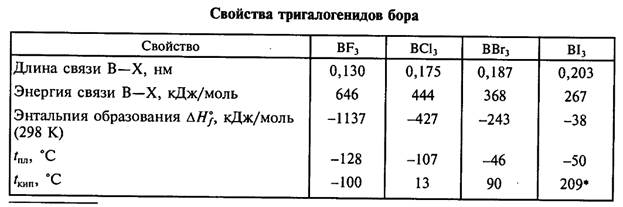
Основанием для широкого применения боразона в инструментах, послужила наибольшая твёрдость, приближающаяся к твёрдости алмаза. Из боразона изготавливают изделия, применяемые в высокотемпературной технике (тигли, изоляторы, тигли для получения полупроводниковых кристаллов, детали электровакуумных приборов); он применяется для производства полупроводниковых приборов и интегральных схем (твердотельные планарные источники примеси бора, диэлектрические прокладки конденсаторов), деталей электровакуумных приборов (окон выводов энергии, стержней теплоотводов). Галогениды бора по строению и свойствам существенно отличаются от галогенидов других элементов 13-й группы. Известны четыре высших галогенида бора. Все они состоят из молекул ВХ3, имеющих форму правильного треугольника, в центре которого расположен атом бора в состоянии sp2-гибридизации. Связи В—X оказываются короче рассчитанных для одинарной сигма-связи. С увеличением размера атомов галогенов прочность связей В—X и устойчивость молекул ВХ3 падают.
В ряду галогенидов бора от фторида к иодиду межмолекулярные взаимодействия усиливаются, благодаря чему растут температуры плавления и кипения (см. табл. 4.4). При обычных условиях BF3 и ВС13— газы, ВВг3 — жидкость, а ВI3 — летучее твердое вещество. Трифторид BF3 получают фторированием боратов: 6CaF2 + Na2B407 + 8H2S04(конц.)= 4BF3t + 2NaHS04 + 6CaS04 + 7H20 борной кислоты или ее ангидрида: В203 + 6NaBF4 + 3H2S04(конц.)= 8BF3 + 3Na2S04 + 3H20 a BCl3 и BBr3 — прямым синтезом, галогенированием смеси оксида бора с углеродной сажей: 700 °С В203 + ЗС + ЗС12 (Br2 )= ЗСО + 2ВС13 (ВВг3) или пропусканием трифторида бора над галогенидом алюминия: А1Вг3 + BF3 = BBr3 + A1F3 Трииодид ВI3 образуется при взаимодействии борогидрида лития LiBH4 с иодом при -78 °С: LiBH4 + 4I2 = BI3 + 4HI + LiI Тригалогениды бора — сильные кислоты Льюиса (акцепторы электронов) и легко взаимодействуют с молекулами — донорами электронов, т. е. основаниями Льюиса: BF3 + NH3 = F3B:NH3 BF3 + 0(C2H5)2=F3B:0(C2H5)2 при этом sp2-гибридизация орбиталей переходит в sp3-гибридизацию, плоская молекула приобретает пирамидальную конфигурацию, и координационное число атома бора повышается до четырех. Кислотность соединений ВХ3 проявляется и в их склонности к гидролизу. Хлорид, бромид и иодид дымят на влажном воздухе, а водой мгновенно разлагаются: ВХ3 + 3H2O = Н3В03 + ЗНХ (X = Сl, Вг, I) Фторид медленно взаимодействует с водой: 4BF3 + ЗН20 = Н3В03 + 3HBF4 При пропускании BF3 через ледяную воду может быть выделен гидрат BF3.2H20, имеющий ионное строение: H30+[BF30H]-. Тетрафтороборная кислота HBF4, образующаяся при гидролизе BF3, гораздо сильнее плавиковой (рKa равна-0,2) и подобно ей ядовита. Она существует только в растворах, которые готовят, растворяя борную кислоту в 40 %-м растворе HF: Н3В03 + 4HF = HBF4 + ЗН20 Нейтрализацией растворов тетрафтороборной кислоты получают ее соли — тетрафторобораты. Они более устойчивы, чем кислота, и плавятся без разложения. Na[BF4] удобно получать фторированием буры: 14HF + Na2B407 + 2NaF = 4NaBF4 + 7Н2О Свежеприготовленные растворы тетрафтороборатов щелочных металлов имеют нейтральную среду, однако при хранении они постепенно подщелачиваются за счет слабого гидролиза. Кислоту HBF4 и ее соли используют в качестве компонентов антикоррозионных покрытий, для нанесения защитных металлических пленок, в производстве ионообменных и ионоселективных мембран, в металлургии для получения сплавов Аl — В и нержавеющей стали. Некоторые тетрафторобораты активны в качестве катализаторов органических реакций. Боразол.
Являясь неорганическим аналогом бензола, боразол напоминает бензол по своим физическим свойствам (агрегатное состояние, интервал кипения, плотность и т. п.); в то же время, химические свойства боразола и бензола резко различаются. Реакционная способность боразола выше, чем у бензола, вследствие полярности связей (три атома азота поставляют свои неподеленные электронные пары на свободные орбитали атомов бора). Так, он окисляется на воздухе, растворим в воде, с которой постепенно реагирует с образованием В(ОН)3, NH3 и Н2, и менее термически устойчив, чем бензол. Атомы Н, связанные с атомами B, способны замещаться без разрушения цикла. Так, при действии BCl3 или BBr3 на боразол при нагревании, образуются твердые устойчивые соединения — тригалогенборазолы B3N3H3Hal3. Атомы H при N неспособны вступать в реакции замещения. Получение. Боразол можно получить нагреванием тетрагидробората лития и хлорида аммония:
По реакции диборана с аммиаком, которая также проводится при нагревании:
Реакцией трихлорида бора с хлоридом аммония. Реакция идет в две стадии:
Боразол используют для получения BN, его орг. производные - для синтеза термостойких полимеров. Напр., при пиролизе N-трифенилборазола образуется полимер состава [—(C6H5)3N3B3H—]23, в котором боразольные циклы связаны через атомы бора. 28. Получение, строение, свойства диборана (трехцентровая двухэлектронная связь). Гомологические ряды гидридов бора: ВnHn+4 и ВnHn+6. Бориды металлов. Гидриды бора (или бораны) — один из самых необычных классов неорганических соединений с особыми структурными принципами организации химических связей, сложной стехиометрией, большим разнообразием химических реакций. Бораны — ядовитые, неустойчивые молекулярные соединения с крайне неприятным запахом, хорошо растворимые в органических растворителях. С увеличением молекулярной массы растут их температуры плавления и кипения: при комнатной температуре диборан B2H6 — газ, пентаборан В5Н9 — жидкость, а декаборан В10Н14 — твердое вещество. Бораны химически активны, легко окисляются на воздухе и разлагаются водой. Моноборан ВН3 неустойчив. Из-за наличия трех связей В—Н и четырех орбиталей атом бора в ВН3 координационно ненасыщен, и молекула ВН3 легко присоединяет молекулы или ионы с неподеленными электронными парами, например молекулу аммиака, образуя прочные молекулярные соединения: Н3В + NH3 = H3B:NH3 Моноборан ВН3 выделен конденсацией паров таких соединений при температуре жидкого азота.
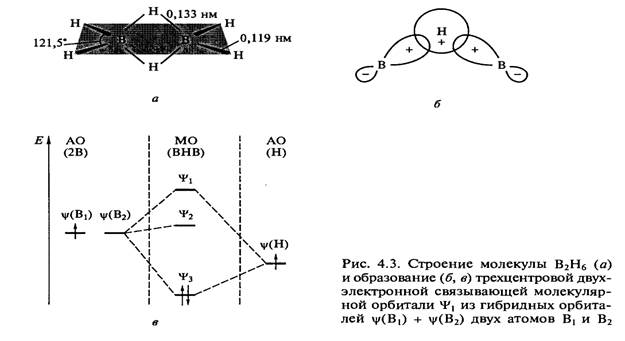
Особое место среди гидридов бора занимает диборан В2Н6, являющийся исходным веществом для получения всех остальных боранов. Его синтезируют восстановлением соединений бора гидридом натрия при нагревании (175 °С): 2BF3(г.) + 6NaH (тв.) = В2Н6(г.) + 6NaF (тв.) или алюмогидридом лития в эфирном растворе: 4ВС13 + 3LiAlH4 = 2B2H6 + 3LiCl + ЗА1С13 Молекула диборана построена из двух фрагментов ВН3 (рис. 4.3, а) таким образом, что два атома В и два соединяющих их мостиковых атома Н расположены в одной плоскости (плоскость рисунка), а четыре концевых атома Н, (по два для каждого атома В) — в перпендикулярной плоскости. Химическая связь между атомами бора отсутствует. Каждый атом В имеет по три валентных электрона, два из которых участвуют в образовании обычных двухцентровых двухэлектронных связей с концевыми атомами Н. Таким образом, каждая группа ВН2 на связывание в фрагменте ВН3 может предоставить только по одному электрону. Очевидно, что для образования аналогичных связей с двумя мостиковыми атомами Н валентных электронов не хватает — бораны являются электронодефицитными соединениями. Для описания таких связей предложена схема трехцентровой двухэлектронной связи В— Н— В (рис. 4.3, б). В методе молекулярных орбиталей смешивание двух атомных орбиталей бора ѱ(B1) и ѱ(B2) с орбиталью водорода ѱ(Н) приводит к образованию трех МО: связывающей ѱ1, несвязывающей ѱ2 и разрыхляющей ѱ3. Пара электронов (один от атома В и второй от атома Н) занимает связывающую МО, создавая устойчивую мостиковую трехцентровую двухэлектронную связь В—Н—В в боранах (рис. 4.3, в).
Высшие бораны. Высшие бораны — бесцветные, неустойчивые молекулярные соединения, температуры кипения их близки к температурам кипения углеводородов с аналогичной молекулярной массой. По строению и составу их разделяют на несколько типов. Клозо-бораны [ВnНn]2-, и = 6 - 12 (от греч.— клетка), представляют собой анионные кластеры); нейтральные молекулы ВnНя+2пока не получены. Нидо-бораны (от лат. nidus — гнездо) содержат незакрытые с одной стороны, нейтральные, например В5Н9, В10Н14, или анионные полиэдры общего состава ВnНn+4, к их числу относится и диборан В2Н6. Арахно-бораны (от греч. — паутина) представляют собой полиэдры с двумя свободными вершинами. Они состоят из открытых кластеров, соответствующих формуле ВnНn+6, например В4Н10, В5Н11, В8Н14. Гифо-бораны (от греч. — сеть) содержат наиболее открытые кластеры, в которых число свободных вершин равно трем: ВnНn+8, например B8H16, В10Н18. Наиболее сложным строением обладают конжункто-бораны (от лат. conjuncto — соединять вместе), состоящие из соединенных друг с другом фрагментов перечисленных выше типов. Бораны — соединения с высокой реакционной способностью, их активность ослабевает с ростом молекулярной массы и зависит от строения молекул. Высокая химическая устойчивость клозо-боранов объясняется сильной делокализацией электронов.
Тетрагидробораты — типичные восстановители. Среди них наиболее устойчивы соли щелочных металлов МВН4. Их получают взаимодействием твердого гидрида натрия с галогенидами бора или эфирами борной кислоты: 4NaH + BCl3 = NaBH4 + 3NaCl B(OCH3)3 + 4NaH = NaBH4 + 3NaOCH3 Тетрагидробораты* — бесцветные кристаллические вещества, растворимые в воде, жидком аммиаке, аминах, а борогидрид лития — в эфире. LiBH4 термически распадается выше 380 °С, остальные выдерживают нагревание до 580 °С. NaBH4 является мягким восстановителем. Это ионное соединение, плавящееся без разложения при 505 °С. Его применяют в целлюлозно-бумажном производстве для отбеливания бумажной массы благодаря тому, что при взаимодействии с сернистым газом в щелочной среде образует сильный отбеливающий агент — дитионит натрия Na2S204: Na[BH4] + 8NaOH + 8S02 = 4Na2S204 + NaB02 + 6H20 Щелочные тетрагидробораты используются для нанесения металлических покрытий и создания контактов в электронных приборах. Концентрированная серная кислота разлагает борогидриды: 2Na[BH4] + 2H2S04 = 2NaHS04 + B2H6 + 2H2 Реакция протекает настолько энергично, что реакционная смесь часто воспламеняется. Хлорирование боранов приводит к разрыву связи В—В: В2Н6 + 6С12 = 2ВС13 + 6НС1 а взаимодействие с аммиаком — к образованию циклических тримеров: бора- зина (HNBH)3 или боразола (BNH)3. На воздухе диборан легко воспламеняется: В2Н6 + зо2 = в2о3 + зн2о а при нагревании без доступа воздуха разлагается на смесь высших боранов. Разложение протекает через неустойчивые интермедиаты ВН3, В3Н7 и др. (приведены в фигурных скобках): В2Н6 = 2{ВН3} {ВН3} + В2Н6 = {В3Н7} + Н2 {ВН3} + В3Н7 = В4Н10 В4Н10 + {ВН3} = В5Н11 + н2 На последующих стадиях образуются бораны В5Н9, В6Н|0, В6Н12 и наиболее устойчивый продукт В10Н14 наряду с полимерным (ВН)Х. Строение и свойства боридов металлов. При взаимодействии бора с металлами образуются разнообразные бориды, в которых бор проявляет формально отрицательные степени окисления. В боридах с повышенным содержанием металла [Mn 4 B, М3В (М = Со, Ni, Pd), М 7 В 3 (М = Тс, Re, Ru), М2В (М = Na, Mo, W)] атомы бора изолированы и расположены преимущественно в центрах тригональных призм из атомов металлов. В боридах Сг 5 В 3 и М 3 В 2 (М = V, Nb, Та) присутствуют изолированные пары В—В. Бориды MB (М = Ti, Hf, V, Cr, Mo, Mn, Fe, Ni) образованы изолированными цепями из атомов бора. В структурах боридов М 3 В 4 ((М = V, Nb, Cr, Мn) найдены двойные цепи из атомов бора. Бориды МВ 2 (М = Mg, А1) и М 2 В 5 (М = Ni, Mo, W) образованы двумерными слоями, а бориды типа LaB 6 — трехмерными каркасами из атомов бора. В структурах боридов с высоким содержанием бора (МВ4, МВ12) сохраняются трехмерные фрагменты икосаэдров, в пустотах которых размещаются атомы металлов. Несмотря на большие различия в размерах атомов, входящих в состав различных боридов, межатомные расстояния В—В почти постоянны и определяются прочными связями В—В. Бориды — исключительно твердые, химически инертные, огнеупорные материалы с температурой плавления и электропроводностью, часто превышающими аналогичные свойства исходных металлов. Например, диборид циркония ZrB2 плавился выше 3000 °С, тогда как температура плавления циркония равна 1670 °С. По электропроводности борид TiB2 в пять раз превосходит титан. Твердость карбида бора В4С выше твердости карбида кремния и приближается к твердости алмаза. Бориды металлов используют для создания высокотемпературных реакторов, защитных покрытий реактивных двигателей и лопаток газовых турбин. Эффективность захвата тепловых нейтронов изотопом 10В более высокая, чем у любых других ядер. Благодаря этому бориды и карбиды бора служат материалом для регулирующих стержней в ядерных реакторах. В 2000 г. японскими исследователями открыты новые сверхпроводники на основе диборида магния MgB2 с критической температурой tc = -233 °С. Карбид бора в виде волокон используется для упрочнения различных материалов. Такие волокна получают взаимодействием смеси ВС13 + Н2 с углеродными волокнами при 1630°С: 4ВС13 + 6Н2 + С = В4С + 12НС1 Бориды металлов синтезируют восстановлением смеси В2O3 с оксидами металлов углеродом при 2000 °С: V2Os + В2O3 + 8С = 2VB + 8СО взаимодействием простых веществ, а также восстановлением смесей летучих галогенидов металлов и бора водородом: TiCl4 +2ВС13 + 5Н2 = TiB2 + 10НС1 Некоторые бориды активных металлов (MgB2, А1В2) разлагаются водой, образуя смесь различных боранов. Большинство боридов (А1В12, СаВ6, ZrB2 и др.) водой не разлагаются.
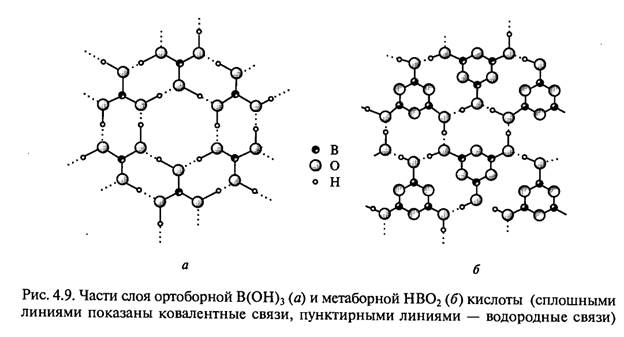
29. Кислородные соединения бора. Оксид бора (III). Борные кислоты, их соли: мета-, тетра-, ортобораты. Получение, строение буры, ее гидролиз. Переработка буры в борную кислоту. Для всех элементов 13-й группы характерно образование оксидов и их производных в высшей степени окисления +3. Для таллия устойчивы соединения со степенью окисления +1 Кислородные соединения бора К важнейшим кислородным соединениям бора относятся оксид бора В203, борные кислоты и их соли — бораты. Оксид бора В203. Получают окислением бора кислородом: 4В + 3О2 = 2В2О3 или тщательным обезвоживанием расплавленной Н3ВО3: 2Н3ВО3 = В2О3+ ЗН2О Кристаллический В2O3 (tПЛ = 577 °С, tкип = 1860 °С) построен из плоских треугольников ВO3, соединенных общими вершинами в трехмерную структуру. Расплав В2О3 склонен к переохлаждению. Образующаяся из него стекловидная масса состоит из частично упорядоченных треугольников ВО3, соединенных в циклы. В расплавленном В2O3 легко растворяются оксиды многих металлов, что используют для получения окрашенных стекол (например, синих с СоО), а также при пайке для очистки поверхности металлов от их оксидов. Боратные стекла часто используют в качестве слоев и покрытий, защищающих поверхность изделий от окисления. При нагревании выше 1450 °С оксид бора испаряется в виде мономерных молекул. Летучесть В203 значительно повышается в присутствии водяных паров из-за образования летучей метаборной кислоты: В2O3(тв.) + Н2O(г.)= 2НВО2(г.) При повышенных температурах В2О3 восстанавливается до бора щелочными металлами, магнием, алюминием, а также углеродом. Аморфный В2Оз растворяется в воде с заметным разогреванием (Н° = = -76,3 кДж/моль), превращаясь в смесь борных кислот. Ортоборная (борная) кислота В(ОН)3 (Н3ВO3). Это конечный продукт гидролиза растворимых соединений бора, например буры Na2[B405(0H)4] • 8Н20: Na2[B405(0H)4] • 8Н20 + H2S04 = 4В(ОН)3 + Na2S04 + 5Н20 Борная кислота представляет собой жирные на ощупь чешуйчатые кристаллы, в структуре которых (рис. 4.9, а) молекулы В(ОН)3 связаны в плоские слои за счет водородных связей —ОН...О. Отдельные слои соединены друг с другом слабыми межмолекулярными связями и находятся на значительном расстоянии друг от друга. Н3ВO3 растворяется в воде (4,3 г в 100 г воды при 20 °С) и является слабой одноосновной кислотой. В отличие от обычных кислот ее кислотные свойства обусловлены не отщеплением иона водорода, а присоединением гидроксильной группы молекулы воды, выступающей в роли основания Льюиса: В(ОН)3 + Н-ОН = [В(ОН)4-+ Н+, р Ка 9,25 (25 °С) Кислотные свойства Н3В03 проявляются в том, что в присутствии концентрированной H2S04 (как водоотнимающего средства) со спиртами она образует эфиры: В(ОН)3 + ЗСН3ОН = (СН3O)3В + ЗН2O Благодаря высокой прочности ковалентной связи В—О внутри молекулы и, наоборот, слабому межмолекулярному взаимодействию эти эфиры летучи. Их пары при поджигании на воздухе сгорают зеленым пламенем. Эта реакция служит для качественного обнаружения соединений бора.
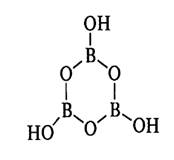
При частичной дегидратации выше 100 °С из В(ОН)3 образуются метаборные кислоты (НВO2)n Например, в триметаборной кислоте (НВO2)3 (или В3O3(OН)3) три группы ВO3 объединены через атомы кислорода в замкнутые циклы:
которые образуют слои за счет водородных связей (рис. 4.9, б).
По сравнению с мономерной В(ОН)3 в триметаборной кислоте в три раза уменьшается количество — ОН-групп, приходящихся на один атом бора. Мостиковые атомы кислорода оттягивают на себя часть электронной плотности от связей В—ОН, делая связи Н—О более полярными и увеличивая тем самым силу метаборной кислоты за счет индукционного эффекта. В свободном виде выделены и другие борные кислоты, например тетраборная кислота H2B4О7 (pKa1 4,1, рКа2 5,1). Они образуются в результате процессов поликонденсации: 2В(ОН)3 + [В(ОН)4- = [В3O3(OН)4- + 3H2O 2В(ОН)3 + 2[В(ОН)4]- = [В4O5(OН)4]2- + 5Н2O Бораты. Это соли борных кислот. Благодаря легкости перестраивания связей В—О—В и различным комбинациям бора с координационными числами 3 и 4 существуют многочисленные варианты связывания треугольных ВO3- и тетраэдрических [В(ОН)4]- групп в многоядерные полиборатные анионы. В этом смысле бораты подобны силикатам и фосфатам. Строение некоторых боратных анионов представлено на рис. 4.10. Общий заряд аниона определяется числом концевых атомов кислорода и тетраэдрических атомов бора, каждый из которых несет один отрицательный заряд. Мономерные треугольные группы В03 (рис. 4.10, а) существуют в ортоборате лития Li3B03, циклические группы B3O63- (рис. 4.10, б) — в метаборате натрия [NaB02]3. Тетраэдры В(ОН)4 существуют в тетрагидроксоанионе (рис. 4.10, в), а также в пероксоборате Na2[B2(02)2(OH)4].6H20, который получают при взаимодействии Н3В03 с пероксидом Н202 в щелочной среде. Пероксоборат (известен под названием перборат) — важная составная часть моющих средств. При гидролизе пербората образуется Н202, действующая как мягкое отбеливающее средство.
|
|||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 5081; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.223.134.29 (0.13 с.) |

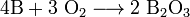
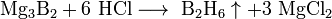
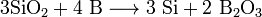

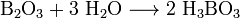

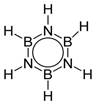 Боразол (боразин, триборинтриимид) — химическое вещество с химической формулой B3H6N3, бесцветная жидкость. Молекула представляет собой шестичленное плоское кольцо, в котором чередуются атомы бора и азота, каждый из них соединён с одним атомом водорода.
Боразол (боразин, триборинтриимид) — химическое вещество с химической формулой B3H6N3, бесцветная жидкость. Молекула представляет собой шестичленное плоское кольцо, в котором чередуются атомы бора и азота, каждый из них соединён с одним атомом водорода.