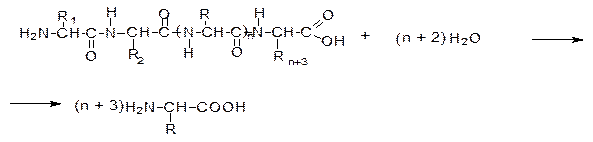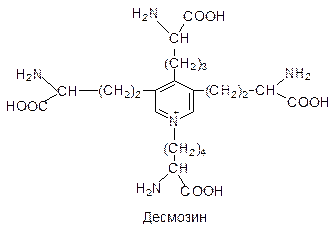Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Аминокислотный состав белков
Для определения аминокислотного состава белки подвергают гидролизу.
В состав белков входят 20 L-a-аминокислот: глицин, аланин, валин, лейцин, серин, глутаминовая кислота, глутамин, лизин, аргинин, пролин, аспарагиновая кислота, аспарагин, изолейцин, треонин, фенилаланин, тирозин, цистеин, метионин, гистидин, триптофан и некоторые производные этих аминокислот, образующиеся в белковой молекуле после матричного синтеза полипептидной цепи. Частота, с какой аминокислоты встречаются в белках, неодинакова. Например, глицин обнаруживается в 10 раз чаще, чем триптофан. По частоте нахождения аминокислот в белках можно составить такой ряд: ала» вал» лей» сер > глу» глн» лиз» арг» про > асп» асн» изо» тре» фен > тир» цис» мет» гис. Большинство белков по аминокислотному составу отличаются не очень резко. Но некоторые белки с особыми свойствами отличаются и аминокислотным составом. Так, белок соединительной ткани коллаген на 1/3 построен из остатков глицина, около 1/5 на ост. пролина и оксипролина. Именно такой состав аминокислот позволяет готовой молекуле белка образовывать прочные олигомерные структуры - фибриллы. Фибриллы коллагена превосходят по прочности стальную проволоку равного поперечного сечения. При кипячении в воде нерастворимый коллаген превращается в желатину - растворимую смесь полипептидов. Необычный аминокислотный состав коллагена определяет его низкую питательную ценность. В состав связок и соединительной ткани стенок сосуда входит белок - эластин. Эластин богат остатками лизина. Четыре боковые группы лизина сближаются друг с другом и ферментативным путем превращаются в десмозин.
Таким путем полипептидные цепи эластина могут объединяться в системы, способные обратимо растягиваться во всех направлениях. В хромосомах содержатся положительно заряженные белки гистоны, примерно на 1/3 построенные из остатков лизина и аргинина. Положительный заряд молекулы белка позволяет образовывать прочные комплексы с отрицательно заряженными молекулами нуклеиновых кислот. Классификация белков По растворимости Альбумины. Растворимы в воде и солевых растворах. Глобулины. Слаборастворимы в воде, но хорошо растворимы в солевых растворах.
Проламины. Растворимы в 70-80% этаноле, нерастворимы в воде и абсолютном спирте. Богаты аргинином. Гистоны. Растворимы в солевых растворах. Склеропротеины. Нерастворимы в воде и солевых растворах. Повышено содержание глицина, аланина, пролина. По форме молекул Если исходить из отношения осей (продольной и поперечной), можно выделить два больших класса белков. У глобулярных белков отношение составляет меньше 10 и в большинстве случаев не превышает 3-4. Они характеризуются компактной упаковкой полипептидных цепей. Примеры глобулярных белков: многие ферменты, инсулин, глобулин, белки плазмы крови, гемоглобин. Фибриллярные белки, у которых отношение осей превышает 10, состоят из пучков полипептидных цепей, спирально навитых друг на друга и связанных между собой поперечными ковалентными или водородными связями (кератин, миозин, коллаген, фибрин). Физические свойства белков На физических свойствах белков, таких как ионизация, гидратация, растворимость основаны различные методы выделения и очистки белков. Так как белки содержат ионогенные, т.е. способные к ионизации аминокислотные остатки (аргинин, лизин, глутаминовая кислота и т.д.), следовательно, они представляют собой полиэлектролиты. При подкислении степень ионизации анионных групп снижается, а катионных - повышается, при подщелачивании наблюдается обратная закономерность. При определенном рН число отрицательно и положительно заряженных частиц становится одинаковым, такое состояние называется изоэлектрическим (суммарный заряд молекулы равен нулю). Значение рН, при котором белок находится в изоэлектрическом состоянии, называют изоэлектрической точкой и обозначают рI. На различной ионизации белков при определенном значении рН основан один из методов их разделения - метод электрофореза. Полярные группы белков (ионогенные и неионогенные) способны взаимодействовать с водой, гидратироваться. Количество воды, связанное с белком достигает 30-50 г на 100 г белка. Гидрофильных групп больше на поверхности белка. Растворимость зависит от количества гидрофильных групп в белке, от размеров и формы молекул, от величины суммарного заряда. Совокупность всех этих физических свойств белка позволяет использовать метод молекулярных сит или гель-фильтрацию для разделения белков. Метод диализа используется для очистки белков от низкомолекулярных примесей и основан на больших размерах молекул белка.
Растворимость белков зависит и от наличия других растворенных веществ, например, нейтральных солей. При высоких концентрациях нейтральных солей белки выпадают в осадок, причем для осаждения (высаливания) разных белков требуется разная концентрация соли. Это связано с тем, что заряженные молекулы белка адсорбируют ионы противоположного заряда. В результате частицы теряют свои заряды и электростатическое отталкивание, в результате происходит осаждение белка. Методом высаливания можно фракционировать белки.
|
||||||
|
Последнее изменение этой страницы: 2016-09-20; просмотров: 406; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.16.70.101 (0.008 с.) |