Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Белковая буферная система. Биологическое значение
Большое значение в поддержании постоянного рН внутри живых клеток имеет белковая буферная система. Белковый буфер представляет систему из протеина (Pt) и его соли, образованным сильным основанием. Компоненты этого буфера могут быть выражены как Pt-COOH – слабодиссоциированная белок-кислота и ее соль Pt-COONa:
Эта буферная система будет действовать аналогично буферным смесям, рассмотренным ранее. При увеличении концентрации ионов водорода соль белка будет реагировать с кислотами, образуя весьма слабо диссоциированную белок-кислоту и нейтральную соль по уравнению
При взаимодействии же со щелочами в реакцию вступает белок-кислота и вместо сильного основания образуется слабоосновная соль:
Однако белки обладают также свойством амфотерности, так как в состав молекул белка входят некоторые кислые и основные соли группировки. Поэтому даже отдельная белковая молекула проявляет буферное действие, связывая кислоты и щелочи с образованием солей:
т.е. при добавлении сильной кислоты образуется слабокислая соль белка (солянокислый протеин). При добавлении щелочи образуется слабоосновная соль белка (протеинат натрия) по уравнению
Благодаря белкам все клетки и ткани организма обладают определенным буферным действием. В связи с этим попадающее, например, на кожу человека небольшое количество кислоты или щелочи довольно быстро оказывается нейтрализованным.
ЛАБОРАТОРНАЯ РАБОТА
Оборудование: Штатив с пробирками, бюретки – 3 шт., пипетки вместимостью 2 и 10 мл, конические колбы вместимостью 50 мл.
Реактивы: Растворы уксусной кислоты(0,1 и 1 моль/л), натрия ацетата (0,1 и 0,01 моль/л), HCl (0,1 и 0,01 моль/л), NaOH (0,1 моль/л), 0,9%-ный NaCl; раствор универсального индикатора или универсальная индикаторная бумага и цветные таблицы для определения рН по окраске универсального индикатора.
Опыт 1. Приготовление буферных смесей с различным значением рН.
В три одинаковые пробирки налейте из бюретки растворы уксусной кислоты (с = 0,1 моль/л) и натрия ацетата той же концентрации в объемах, указанных в таблице.
Прибавьте к каждому раствору по 3 капли раствора универсального индикатора. Сравните окраску растворов с окраской в специальной цветовой таблице, прилагаемой к универсальному индикатору, при различных значениях рН. Запишите в таблицу значения рН для каждого из растворов. Рассчитайте рН и также запишите их в таблицу. Сравните действительные значения рН растворов с расчетными. Растворы сохраните для проведения следующих опытов. При отсутствии раствора универсального индикатора используйте универсальную индикаторную бумагу.
Опыт 2. Влияние разбавления на рН буферной смеси
Возьмите две чистые пробирки и отберите и в них из пробирки № 2 пипеткой 1,0 и 2,0 мл буферного раствора. Разбавьте отобранные растворы водой в 10 и 5 раз соответственно. Прибавьте в разбавленные растворы по 3 капли раствора универсального индикатора. Сравните окраску в этих пробирках с окраской исходного раствора и с окраской в цветной таблице для универсального индикатора. Изменяется ли рН при разведении буферного раствора.
Опыт 3. Действие на буферные растворы кислот и щелочей
Возьмите 3 чистые пробирки. В одну из них отберите пипеткой 5 мл буфера, приготовленного в опыте 1 в пробирке № 3. В другую чистую пробирку налейте 5 мл дистиллированной воды, в 3-ю – 5 мл 0,9%-ного раствора NaCl. В пробирки с водой и NaCl прибавьте по 3 капли универсального индикатора. Для записи результатов наблюдений составьте таблицу по форме:
Запишите в таблицу исходные значения рН растворов, определенные по окраске универсального индикатора. Прибавьте в пробирки по 1,00 мл раствора HCl (c = 0,01 моль/л). Как изменяется окраска растворов в пробирках? Запишите новые значения рН растворов. Затем прибавьте в эти же пробирки по 1,0 мл 0,1 моль/л раствора HCl. Что наблюдаете? Запишите также полученные значения рН растворов.
Проделайте опыт, аналогичный опыту 3 с той лишь разницей, что в качестве исследуемого ацетатного буфера используйте буферный раствор, приготовленный в опыте 1 в пробирке № 1. К 5 мл буфера, воды и раствора NaCl прибавляйте по 1,0 мл растворов NaOH вначале с концентрацией 0,01 моль/л, а затем с концентрацией 0,1 моль/л. Наблюдения опыта запишите в таблицу, по форме напоминающую предыдущую.
Сформулируйте выводы из опыта, основанные на наблюдениях.
Вопросы: 1. Что называют буферными растворами? 2. Чем обусловлено буферное действие с точки зрения протонной теории? 3. Классификация кислотно-основных буферных систем. Какие типы буферных систем известны? 4. Механизм буферного действия: а) ацетатный буфер, аммонийный буфер; б) бикарбонатный буфер (биологическая роль); в) фосфатный буфер (биологическая роль); гемоглобиновый буфер (биологическая роль); белковый буфер (биологическая роль). 5. Расчет рН буферных систем. Уравнение Гендерсона-Гассельбаха. 6. От чего зависит рН буферной системы? 7. Что называется буферной емкостью системы? 8. От чего зависит буферная емкость системы?
Литература:
3. Общая химия. Биофизическая химия. Химия биогенных элементов. Учеб. для мед. спец. вузов / Ю.А. Ершов, В.А. Попков, А.С. Берлянд и др. Под ред. Ю.А. Ершова. – М.: Высш. шк., 1993. 4. Практикум по общей химии. Биофизическая химия. Химия биогенных элементов: учеб. Пособие для студентов мед. спец. вузов / Ю.А. Ершов, А.М. Кононов, С.А. Пузаков и др.; под ред. Ю.А. Ершова, В.А. Попкова. – М.: Высш. шк., 1993. 5. Равич-Щербо М.И., Новиков В.В. Физическая и коллоидная химия. Учебник для мед. ин-ов. «Высшая школа», 1975
Занятие № 5 РЕАКЦИИ КОМПЛЕКСООБРАЗОВАНИЯ Цель деятельности студентов на занятии
Студент должен знать: а) Основные положения координационной теории Вернера б) Понятия о внутренней и внешней сферах комплексных соединений, центральном ионе, лигандах, дентатности лиганда, хелатных и полиядерных комплексных соединениях. в) Роль биокомплексов металлов в живых организмах. г) Примеры важнейших биокомплексов, в которых d-элементы выполняют роль комплексообразователей. д) Катионы железа, меди, цинка, кобальта как важнейшие комплексообразователи Студент должен уметь: а) Определять степень окисления иона-комплексообразователя б) Определять координационное число комплексных соединений в) Писать уравнения реакций первичной и вторичной диссоциации комплексных соединений г) Писать уравнения реакций с участием комплексных соединений
Содержание обучения:
Строение комплексных соединений, или просто комплексов, раскрыл швейцарский ученый А. Вернер в 1893 г. Согласно теории Вернера комплексными соединениями называют вещества, молекулы которых состоят из центрального иона М, непосредственно связанного с определенным числом n других молекул или ионов L, называемых лигандами. Центральный атом с окружающими его лигандами образуют внутреннюю сферу комплекса MLn. Характерной особенностью комплексных соединений является наличие в них химической связи, возникшей по донорно-акцепторному механизму. Поэтому сущность реакции комплексообразования заключается во взаимодействии двух противоположностей: акцептора электронной пары и донора электронной пары. Центральный атом (комплексообразователь) – это атом или ион, который является акцептором электронных пар, предоставляя свободные атомные орбитали, и занимает центральное положение в комплексном соединении. Роль комплексообразователя в основном выполняют атомы d-металлов, так как они имеют много свободных атомных орбиталей на валентном уровне и достаточно большой положительный заряд ядра, за счет которого способны притягивать электронные пары доноров. Число свободных атомных орбиталей, предоставляемых комплексообразователем (т.е. число лигандов, присоединенных к центральному атому) определяет его координационное число. Значение координационного числа зависит от многих факторов, но обычно оно равно удвоенному заряду иона комплексообразователя. Наиболее характерными координационными числами являются 2, 4, 6.
Лиганды – молекулы или ионы, которые являются донорами электронных пар и непосредственно связаны с комплексообразователем. Обычно лигандами являются ионы или молекулы, содержащие неподеленные (свободные) электронные пары или достаточно подвижные π-электронные пары. Если внутренняя сфера имеет заряд, то в состав комплексных соединений входят противоположно заряженные ионы внешней сферы, связанные с внутренней сферой ионной связью. По типу заряда внутренней сферы комплексные соединения делят на катионные ([Ag(NH3)2]NO3), анионные (K3[Fe(CN)6]) и нейтральные (Pt(NH3)2Cl2]). Заряд внутренней сферы комплексного соединения равен алгебраической сумме зарядов комплексообразователя и всех лигандов. Количество донорных атомов в лиганде может быть различно и оно определяет дентатность лиганда – количество σ-связей, которые образует лиганд с комплексообразователем. Такие лиганды, как галогенид-ион, OH-, CN-, NH3, H2O, CO являются монодентатными. Если все лиганды в комплексе монодентатны, то их общее число совпадает с координационным числом. Лиганды, содержащие облее одного донорного атома, называют полидентатными или хелатирующими (от греч. Chelate – клешня), а комплексы с такими лигандами – хелатными. К бидентатным относятся многие органические молекулы – этилендиамин, анион аминоуксусной кислоты, дианион щавелевой кислоты и т.д.
H2N-CH2-CH2-NH2 H2NCH2COO- -OOC-COO- Названия комплексных соединений строятся в соответствии с опредленными правилами. Сначала называют лиганды, а затем комплексообразователь. Если комплекс смешанно-лигандный, то первыми называют отрицательно заряженные лиганды, а затем нейтральные. После этого называют атом металла-комплексообразователя, указывая после названия металла его степень окисления римскими цифрами в круглых скобках. Наличие 2-х или более одинаковых монодентатных лигандов отражают при помощи приставок – греческих числительных: ди- (2); три- (3); тетра- (4) и т.д. Если лиганд полидентатный, то используются приставки бис- (2); трис-(3) и т.д. Большинство соединений, используемых как лиганды, сохраняют свои обычные названия. Однако некоторые получают другие названия: NH3 – амин; Н2О – акво; СО – карбонил; NO – нитрозил. К названиям анионных лигандов добавляют суффикс о – ОН- - гидроксо; СN – циано и т.д. В анионных комплексах металл называют в латинской транскрипции с заменой суффикса ум на ат. В случае катионных и нейтральных комплексов металл называют в русской транскрипции в родительном и именительном падежах соответственно: Катионные: [Ag(NH3)2]NO3 диамминсеребра (I) нитрат [Zn(NH3)4](OH)2 тетраамминцинка (II) гидроксид Анионые: K3[Fe(CN)6] гексацианоферрат (III) калия K2[PtCl6] гексахлороплатинат (IV) калия Нейтральные: [Pt(NH3)2Cl2] дихлородиамминплатина (II) [Fe(CO)5] пентакарбонилжелезо (0)
Лабораторная работа
Оборудование: Микропробирки, часовые и (или) предметные стекла, стеклянная палочка, тигель, газовая горелка, микроскоп, железные канцелярские скрепки, 10 шт. микропробирок в штативе.
Реактивы: Растворы солей катионов Cr3+; Mn2+; Fe2+; Fe3+; Co2+; Ni2+, Cu2+, Zn2+, Hg2+, разбавленный и концентрированный раствор аммиака, растворы калия гексацианоферратов (I) и (II).
Опыт 1. Образование аммиачных комплексов d-элементов Ход работы:
Приготовьте таблицу для записи наблюдений по форме:
Отберите в пробирки по 2-3 капли солей указанных катионов. Затем прибавьте в каждую пробирку по 1-2 капли разбавленного водного раствора аммиака. В соответствующей графе наблюдений отметьте цвет образовавшегося осадка гидроксида. Затем в те же пробирки прибавьте по 5-8 капель концентрированного водного раствора аммиака. Отметьте, в каких случаях произошло растворение осадка (с образованием комплексного аммиаката), и цвет полученного раствора. В последней графе отметьте, для каких элементов характерно образование комплексов, где роль лиганда выполняет NH3. По окончании опыта вымойте пробирки.
Опыт 2. Образование нерастворимых в воде гексацианоферратов. Ход работы:
Приготовьте таблицу для записи наблюдений по форме:
Данный опыт можно провести капельным методом или на стекле. На часовое или предметное стекло поместите 1 каплю реактива и 1 каплю раствора соответствующего катиона. Соедините капли с помощью стеклянной палочки. Запишите наблюдения (цвет осадков). Ниже приведены формулы выпадающих осадков:
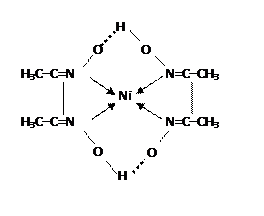
Опыт 3. Образование комплексного диметилглиоксима с ионами Fe2+ и Ni2+ Ход работы: a) Поместите в пробирку 1-2 капли раствора соли железа (II), затем прибавьте 2-3 капли раствора NН3 и 2-3 капли спиртового раствора диметилглиоксима. При этом образуется растворимый комплекс бис(диметилглиоксимато) железо (II) розово-красного цвета. б) Поместите в пробирку 2-3 капли раствора соли никеля, прибавьте 3-5 капель раствора NН3 и 2-3 капли спиртового раствора диметилглиоксима. Что образуется? Запишите наблюдения. Эту же реакцию можно провести как капельную. Для этого поместите на фильтровальную бумагу 1 каплю раствора соли никеля и 1 каплю спиртового раствора диметилглиоксима. Смоченную бумагу обработайте парами аммиака над фарфоровой чашкой. При достаточном насыщении аммиаком на бумаге в присутствии никеля образуется красное пятно – осадок бис(диметилглиоксимато) никеля (II):
Если присутствует мешающий проведению реакции Fe2+, его предварительно окисляют Н2О2 до Fe3+.
Опыт 4. Получение тиоцианатных комплексов железа (III) и кобальта (II) Ход работы: Ионы Fe3+ с тиоцианат-ионами образуют железа (III) тиоцианат:
Состав образующегося комплекса непостоянен и в зависимости от концентрации Fе3+ и NCS– может колебаться от [Fе(Н2О)5(NСS)6]2+ до [Fе(NСS)6]3–. Реакция может быть использована для количественного определения колориметрическим (визуальным) методом. Кобальт (II) образует с тиоцианат-ионами комплекс сине-голубого цвета, экстрагирующийся в слой амилового спирта. a) К 2-3 каплям раствора соли железа (III) прибавьте 2-3 капли раствора калия (или аммония) тиоцианата. Запишите наблюдения. б) Поместите в пробирку 3 капли соли кобальта (II) и прибавьте несколько кристалликов NH4NСS. Что наблюдаете? К полученному раствору прибавьте несколько капель смеси этилового эфира и амилового спирта и содержимое пробирки взболтайте. Запишите наблюдения. в) Поместите 1 каплю раствора соли кобальта (II) на часовое стекло и добавьте 2–3 капли раствора NH4NСS в ацетоне. Наблюдайте эффект, поставив часовое стекло на лист белой бумаги. Запишите наблюдения. г) На фильтровальную бумагу поместите 1 каплю раствора NH4NСS, а затем 1 каплю раствора соли кобальта (II). Бумагу выдержите в парах аммиака и подсушите над пламенем горелки. Периферическая часть пятна должна быть окрашена в синий цвет. Опишите и зарисуйте наблюдаемое явление. Этой реакцией кобальт можно обнаружить в присутствии всех катионов.
Занятие № 6 ХИМИЧЕСКАЯ КИНЕТИКА Цель деятельности студентов на занятии: Студент должен знать:
а) Что такое скорость химической реакции. Факторы, влияющие на скорость реакции. Константа скорости реакции. Закон действующих масс. Правило Вант-Гоффа. Уравнение Аррениуса. б) Молекулярность реакции, порядок реакции.
Студент должен уметь: а) Определять константу скорости реакции; б) Экспериментально доказать, что константа скорости не зависит от концентрации реагентов; в) Объяснять в каких случаях порядок и молекулярность реакции не совпадают. г) описывать кинетику процессов всасывания, распределения метаболитов. Химической кинетикой называется учение о скорости химической реакции и ее зависимости от различных факторов – природы и концентрации реагирующих веществ, давления, температуры, присутствия катализаторов. Скорость реакции – это изменение концентрации одного из веществ в единицу времени при неизменном объеме. При рассмотрении вопроса о скорости реакции необходимо различать реакции, протекающие в гомогенной системе (гомогенные реакции) и реакции, протекающие в гетерогенной системе (гетерогенные реакции). Гомогенной называется система, состоящая из одной фазы, гетерогенной – система, состоящая из нескольких фаз. Фаза – часть системы, отделенная от других ее частей поверхностью раздела, при переходе через которую свойства изменяются скачком. Скоростью гомогенной реакции называется количество вещества, вступившего в реакцию или образующегося при реакции за единицу времени в единице объема системы Скоростью гетерогенной реакции называется количество вещества, вступающего в реакцию или образующегося при реакции за единицу времени на единице площади поверхности фазы. Оба эти определения можно записать в математической форме:
где υгомог . – скорость реакции в гомогенной системе; υгетерог. – скорость реакции в гетерогенной системе; n – число молей какого-либо из получающихся при реакции веществ; V – объем системы; t – время; S – площадь поверхности фазы, на которой протекает реакция. Средняя скорость реакции
где Δ С – изменение концентрации определяемого вещества за промежуток времени Δ t. Средняя скорость реакции Средняя скорость не отражает истинной скорости в каждый момент времени, поэтому математически истинную скорость υ реакции в данный момент принято выражать отношением бесконечно малого изменения концентрации dC к бесконечно малому отрезку времени dt, в течение которого произошло изменение концентрации:
Скорость химической реакции зависит от концентрации, температуры, давления (для газов), степени измельченности (для твердых веществ), присутствия катализаторов, от природы вещества и среды.
Основной постулат химической кинетики – закон действия масс: При постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ. Так, скорость реакции
может быть записана
где [A], [B] – концентрации реагирующих веществ; k – коэффициент пропорциональности, который называется константой скорости химической реакции. k зависит от тех же факторов, что и скорость, кроме концентрации. В случае гетерогенных реакций в уравнения закона действия масс входят концентрации только тех веществ, которые находятся в газовой фазе или в растворе. Концентрация вещества, находящегося в твердой фазе, обычно представляет собой постоянную величину и поэтому входит в константу скорости.
В случаях, когда при реакции выделяется газ, выпадает осадок, образуется малодиссоциируемое вещество, выделяется большое количество энергии, реакции практически необратимы. Принцип Ле-Шателье: Если на систему, находящуюся в равновесии, производится какое-либо внешнее воздействие (изменяется концентрация, температура, давление), то оно благоприятствует протеканию той из двух противоположных реакций, которая ослабляет воздействие.
Количественной характеристикой химического равновесия служит величина, называемая константой химического равновесия. Для реакции
Согласно закону действия масс, скорости прямой υ 1 и обратной υ 2 реакций выражаются уравнениями:
При равновесии скорости прямой и обратной реакции равны друг другу, откуда
Константа равновесия K равна отношению констант скорости прямой и обратной реакций
Константа равновесия K связана с выходом реакции следующим образом: при K >> 1 выход продуктов реакции большой; при K << 1 выход продуктов реакции маленький.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-09-18; просмотров: 2328; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.157.186 (0.114 с.) |
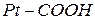
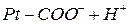
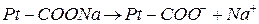

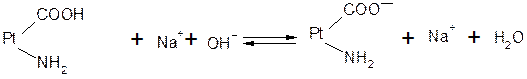
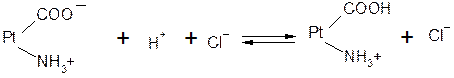
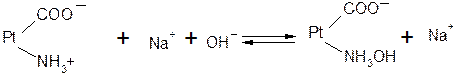


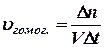 ;
;  ,
,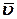 за данный промежуток времени t2 – t1 будет
за данный промежуток времени t2 – t1 будет ,
,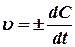 .
.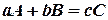
 ,
,

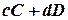
 ;
; 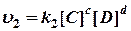 .
.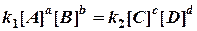 .
.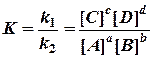 .
.