Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Концептуальные представления о различиях в строении твёрдых, жидких и газообразных тел. Роль давления и температуры в агрегатных переходах.
Выделяют три основных агрегатных состояния: твёрдое тело, жидкость и газ. Иногда не совсем корректно к агрегатным состояниям причисляют плазму. Существуют и другие агрегатные состояния, но они могут быть получены только в лабораторных условиях. Изменения агрегатного состояния это термодинамические процессы, называемые фазовыми переходами. Выделяют следующие их разновидности: из твёрдого в жидкое — плавление; из жидкого в газообразное — испарение и кипение; из твёрдого в газообразное — сублимация; из газообразного в жидкое или твёрдое — конденсация; из жидкого в твёрдое — кристаллизация. Отличительной особенностью является отсутствие резкой границы перехода к плазменному состоянию. Определения агрегатных состояний не всегда являются строгими. Так, существуют аморфные тела, сохраняющие структуру жидкости и обладающие небольшой текучестью и способностью сохранять форму; жидкие кристаллы текучи, но при этом обладают некоторыми свойствами твёрдых тел, в частности, могут поляризовать проходящее через них электромагнитное излучение. Для описания различных состояний в физике используется более широкое понятие термодинамической фазы. Явления, описывающие переходы от одной фазы к другой, называют критическими явлениями. Переходы между агрегатными состояниями вещества в зависимости от температуры и давления. Диаграммы состояния. Различные агрегатные состояния вещества определяются, прежде всего, температурой и давлением: если давление мало, температура достаточно высока, то вещество будет находиться в газообразном состоянии, при низкой температуре вещество будет твердым, при умеренных (промежуточных) температурах — жидким. В соответствии с этим для количественной характеристики агрегатных состояний вещества часто используется очень наглядная фазовая диаграмма вещества, которая показывает зависимость агрегатного состояния от давления и температуры (см. рисунок).
Диаграмма состоит из трех областей, отвечающих кристаллическому (К), жидкому (Ж) и газообразному (парообразному) (Г) состояниям. Эти области отделены друг от друга кривыми: плавление кристаллизация Ob, кипение конденсация Ok и сублимация десублимация Оа. Точка пересечения этих кривых О называется тройной точкой: при Р = Р0 и Т = Т0 вещество может сосуществовать в трех агрегатных состояниях, причем жидкость и твердое вещество имеют одинаковое давление пара. Координаты Р = Р0 и T = Т0 тройной точки — это единственная пара значений давления и температуры, при которых одновременно могут сосуществовать три фазы. Пример: на диаграмме состояния воды этой точке соответствуют давление 4,58мм рт. ст. (0,61 кПа) и температура 273 К (0 °С).
При температуре выше критической (на диаграмме ей соответствует точка k) кинетическая энергия частиц становится больше энергии их взаимодействия, и поэтому вещество существует в газообразном состоянии при любом давлении. На рисунке видно, что при давлении, большем Р0, нагревание твердого вещества приводит к его плавлению (при Р1 плавление происходит в точке d).После того как все вещество расплавится, дальнейшее повышение давления приводит к повышению соответствующих температур кипения (при давлении Р1 кипение жидкости происходит в точке е при температуре T1). При давлении, меньшем Р0 (при Р2)нагревание твердого вещества приводит к переходу из кристаллического состояния непосредственно в газообразное (в точке g), т. е. к сублимации. Для большинства веществ Р0 < Рнасыщ. паров. Лишь для немногих веществ р0 > Рнасыщ. паров, и нагревание кристаллов приводит к их сублимации — примерами таких веществ являются иод и “ сухой лед” — твердый диоксид углерода. Концепция атомизма от Демокрита до наших дней. Планетарная модель атома Резерфорда. Постулаты Бора. В противоположность элеатам Демокрит учил, что реально существует не только бытие, но и небытие. Бытие - это атомы, небытие - пустота, пустое пространство. Пустота неподвижна и беспредельна; она не оказывает никакого влияния на находящиеся в ней тела, на бытие. Атом - неделимая, совершенно плотная, непроницаемая, не-воспринимаемая чувствами (вследствие своей, как правило, малой величины), самостоятельная частица вещества, атом неделим, вечен, неизменен. Атомы никогда не возникают и никогда не погибают. Они бывают самой разнообразной формы - шарообразные, угловатые, крючкообразные, вогнутые, выпуклые и т.п. Атомы различны по размерам. Они невидимы, их можно только мыслить. В процессе движения в пустоте атомы сталкиваются друг с другом и сцепливаются, получаются вещи. Изменяется положение атомов – изменяется вещь.
В 17—18 вв., когда развилась механика, Атомизм приобрёл механистический характер; этот вид Атомизм был несколько более конкретен, чем натурфилософия древних, но всё же ещё в большей мере оставался абстрактным и мало связанным с опытной наукой. Атомам приписывались теперь чисто механические свойства. Представители «механики контакта» считали, что причиной соединения атомов является фигура, геометрическая форма, наделяли атомы крючочками, посредством которых атомы якобы сцепляются между собой; иногда атомы изображались в виде зубчатых колесиков, зубцы которых подходят друг к другу в случае растворения тел или не подходят в случае их нерастворения (М. В. Ломоносов). Представители «механики сил» (динамики) объясняли взаимодействие атомов наподобие гравитационного тяготения. Поэтому здесь играл роль только вес частиц, а не их геометрическая форма (она принималась шаровидной, как у небесных тел). От динамики И. Ньютона берёт начало особая ветвь Атомизм (хорватский физик Р. И. Бошкович), в которой сочетается идея Г. Лейбница о непространственных монадах (в виде геометрических точек — центров сил) с понятием «силы» (Ньютон). Этот динамический Атомизм явился предвосхищением современного Атомизм, в котором неразрывно сочетается представление о дискретности материи с идеей неразрывности материи и движения (или «силы» в прежнем понимании). Исходя из взглядов Ньютона, Дж. Дальтон (1803) создал химический Атомизм, способный теоретически обобщать и объяснять наблюдённые химические факты и предвидеть явления, ещё не обнаруженные на опыте. Дальтон наделил атомы «атомным весом», т. е. специфической массой, характерной для каждого химического элемента. В «атомном весе» нашла своё выражение мера химического элемента, представляющая собой единство его качественной (химическая индивидуальность) и количественной (значение «атомного веса») сторон.
Признание единства строения макро и микрокосмоса открывало путь к перенесению на атомы таких механических, физических или химических свойств и отношений, которые обнаруживались у макротел. Исходя из теоретически предугаданных свойств атомов, можно было сделать заключение о поведении тел, образованных из атомов, а затем экспериментально проверить это теоретическое заключение на опыте. Модель атома Резерфорда (Ядерная или Планетарная модель атома) Рассеяние отдельных α-частиц на большие углы Резерфорд объяснил тем, что положительный заряд в атоме не распределен равномерно в шаре радиусом 10-10 м, как предполагали ранее, а сосредоточен в центральной части атома (атомном ядре) в области значительно меньших размеров. Расчеты Резерфорда показали, что для объяснения опытов по рассеянию α-частиц нужно принять радиус атомного ядра равным примерно 10-15 м.
Планетарная модель атома объясняет основные закономерности рассеяния заряженных частиц. Так как большая часть пространства в атоме между атомным ядром и обращающимися вокруг него электронами пуста, быстро заряженные частицы могут почти свободно проникать через довольно значительные слои вещества, содержащие несколько тысяч слоев атомов. При столкновениях с отдельными электронами быстрые заряженные частицы испытывают рассеяние на очень большие углы, так как масса электрона мала. Однако в тех редких случаях, когда быстрая заряженная частица пролетает на очень близком расстоянии от одного из атомных ядер, под действием силы электрического поля атомного ядра может произойти рассеяние заряженной частицы на любой угол до 180°. ↑ На начало страницы Квантовые постулаты Бора Датский физик Нильс Бор (1885-1962) обосновал планетарную модель атома Резерфорда. Свои представления об особых свойствах атомов (устойчивости атома и спектральных закономерностей его излучения) Бор сформулировал в виде постулатов следующего содержания:
Все стационарные состояния, кроме одного, являются стационарными лишь условно. Бесконечно долго каждый атом может находиться лишь в стационарном состоянии с минимальным запасом энергии. Это состояние атома называется основным. Все остальные стационарные состояния атома называются возбужденными.
|
|||||||
|
Последнее изменение этой страницы: 2016-08-26; просмотров: 684; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.19.56.114 (0.009 с.) |

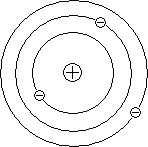 Резерфорд предположил, что атом устроен подобно планетарной системе. Как вокруг Солнца на больших расстояниях от него обращаются планеты, так электроны в атоме обращаются вокруг атомного ядра.
Резерфорд предположил, что атом устроен подобно планетарной системе. Как вокруг Солнца на больших расстояниях от него обращаются планеты, так электроны в атоме обращаются вокруг атомного ядра.  Радиус круговой орбиты самого далекого от ядра электрона и есть радиус атома. Такая модель атома была названа планетарной моделью.
Радиус круговой орбиты самого далекого от ядра электрона и есть радиус атома. Такая модель атома была названа планетарной моделью.