
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Фосфоресцентная спектроскопия.
Фосфоресценция происходит из-за излучательного перехода с нижнего триплетного уровня. Этот переход запрещен, следовательно, время жизни от 10’-5 до десятков секунд. За столь длительное время жизни возрастает вероятность дезактивации за счет безизлучательных переходов – колебательной деградации.
Поэтому понижение температуры (уменьшение эффективности колебаний) увеличивает интенсивность фосфоресценции. Таким образом, измеряя люминесценцию при обычных температурах(300-77 К), можно определить, какую составляющую люминесценции мы регистрируем - флуоресценцию или фосфоресценцию. Фосфоресценцию также удобно использовать для определения наличия в окружающей среде тяжелых атомов. Дело в том, что запрет на фосфоресценцию объясняется правилом Вигнера: излучательные переходы между состояниями различной мультиплетности запрещены. В основе правила Вигнера лежит закон сохранения момента импульса. Наблюдаются же переходы между состояниями различной мультиплетностью из-за того, что есть взаимодействие молекул (их сталкивание), которые и снимают запрет Вигнера для одной молекулы, не нарушается закон сохранения момента импульса для множества молекул. Если же в окружении присутствуют тяжелые атомы, то есть такие, у которых имеется много электронов на различных орбиталях, то снятие запрета Вигнера существенно упрощается при взаимодействии тяжелого атома с исследуемой молекулой. Различают внутренний и внешний эффект тяжелого атома. Регистрация триплетных состояний возможна не только с помощью люминесцентной спектроскопии, но и с помощью ЭПР (электронный парамагнитный резонанс)(ESR/EPR). Инфракрасная спектроскопия. Инфракрасная спектроскопия изучает спектры поглощения в инфракрасной области: это от 10’3 до 10’6 нм (от 10’-6 до 10’-3 метра). Кроме того в ИК спектроскопии принято обозначать частоту света в волновых числах (ν), которые измеряются в см’-1. Для того, чтобы перейти от волновых чисел к длинам волн: [λнм=10’7/ ν ]. Для регистрации ИК спектров, которые также называются колебательные спектры, используется схема обычного спектрофотометра.
Только в ИК спектрофотометрах все элементы другие. В качестве источника света используются раскаленные тела (дают сплошной ИК спектр). В качестве диспергирующего элемента (раскладывает излучение в спектр) применяют либо дифракционные решетки (300 штрихов на мм и меньше), либо призмы из щелочногаллоидных веществ: NaCl, LiF, CsCl, CsF, KF. Диспергирующие элементы (легко повреждаются атмосферной влагой) помещаются в кондиционеры, и выключать питание ИК спектрометра никогда нельзя. Разворачивание спектра на выходную щель осуществляется поворотом призмы или решетки. В качестве приемников излучения используются термопары (измеряют тепло), металлические и полупроводниковые термосопротивления, которые называются болометрами, и газовые термодатчики, принцип действия которых заключается в том, что падающее на них тепловое излучение падает на газ, давление увеличивается, это увеличение давления и регистрируется. Кюветы для ИК измерений стоят дорого, потому что изготавливаются из прозрачных в ИК области материалов (NaCl, NaF и др.). Обычно эти кюветы представляют собой кварцевые сосуды, у которых 2 стенки - это наклеиваемые окошки из щелочногаллоидных материалов (например, из эбонита).
Для работы с химически активными жидкостями и газами применяют защитные напыления на окна кювет (Ge). В качестве растворителей приходится использовать жидкости, прозрачные в ИК области спектра, это: CCl4, CH2Cl2, CHCl3, CH3Cl. Для регистрации твердых тел, их измельчают и затем спрессовывают с порошком KBr (прозрачен во всех областях спектра) в таблетки, которые помещают в кюветы. Колебательные спектры молекул возникают в результате переходов электронов между колебательными уровнями. Колебательные же уровни по определению определяются колебаниями атомных ядер. Колебательные уровни энергии определяются квантованием колебательных движений атомных ядер. Диапазон волновых чисел от 10 до 4000 см’-1 (частоты колебательных переходов 3*10’11-10’14 Гц).
Зависимость потенциальной энергии V, гармонического осциллятора (коричневая кривая) и реальной двухатомной молекулы (красная кривая), от межъядерного расстояния r (re- равновесное значение r); горизонтальными прямыми линиями показаны колебательные уровни (0,1,2,… -значения колебательного квантового числа); вертикальными стрелами показаны некоторые колебательные переходы; Do- энергия диссоциации; сплошная серая область отвечает сплошному спектру.
В классическом варианте частота гармонических колебаний равна:
,где K – силовая константа m – эффективная масса колеблющегося фрагмента
Энергия колебаний после решения уравнения Шредингера для колебаний подсистемы молекулы:
,где Даже при абсолютном нуле,когда Оказывается, возможны оптические переходы не между любыми колебательными уровнями, а только между некоторыми (правило отбора). Природа колебательного правила отбора связана с симметрией исходного и конечного колебательных состояний. Для многоатомных молекул можно выделить множество колебаний вдоль различных связей (сложные колебательные движения ядер можно представить в виде суперпозиции отдельных гармонических колебаний νк, где к-количество колебательных координат молекулы (к=1,2…n). Такие координаты, которым можно приписать гармонические колебания определённой частоты, называются естественными. А колебания вдоль этих координат – нормальными. Например, 3-ёхатомная линейная молекула имеет 3 нормальные колебания.
ν1 ν2 ν3
ν1 – симметричное валентное колебание (СВК) ν2 – деформационное валентное колебание (ДВК) ν3 – антисимметричное валентное колебание (АВК)
Энергия колебаний может принимать следующие значения:
, где Основные частоты в колебательном спектре обусловлены переходами с нулевого колебательного уровня:

Система колебательных уровней (термов) для молекулы воды и некоторые переходы. Инфракрасная спектроскопия позволяет определять: 1) пространственные и конформационные изомеры; 2) характер химических связей; 3) распределение зарядов в молекулах; 4) геометрические параметры молекул. А также изучать внутри- и межмолекулярное взаимодействие (абсолютно все межмолекулярные взаимодействия (даже обусловленные таким слабыми силами как Ван дер Ваальсовыми, водородными) изменяют частоты нормальных колебаний молекулы), регистрировать короткоживущие частицы (до В настоящее время существуют программы расчёта ИК спектров молекул, состоящих до 100 атомов. При этом необходимо знать состав этой молекулы и силовые постоянные её связей (могут быть определены экспериментально или найдены из квантовых расчётов). Из-за всех этих преимуществ ИК спектроскопия получила наиболее широкое распространение в органической и электроэлементоорганической химии. Определение отдельных элементов становится возможным из-за того, что определённые группы атомов имеют строго фиксированные колебательные частоты.
Пример: 1700 см
Также ИК спектроскопия позволяет определять наличие в образце изотопов и их процентный состав.
Пример: масса атома дейтерия примерно в 2 раза тяжелее протия. То есть m (см.
Масспектроскопия - это метод определения массовых чисел частиц (молекулы + их осколки). Для того чтобы получить масспектр образца, необходимо перевести в заряженное состояние его молекулы. Поэтому, на самом деле анализируются не нейтральные молекулы, а их ионы; и определяются не их заряды, а отношение заряда к массе (e/m). В результате получается зависимость ионов определенной массы (e/m).
В массспектрометрах используется разделение ионов различных масс под воздействием электрических и магнитных полей. Это всегда происходит в вакууме. На первом этапе регистрации массспектра нужно вещество ионизовать. Существуют различные способы ионизации вещества.
Ионные источники. Наиболее распространенными методами ионизации являются:
В этом случае пучок электронов с большой кинетической энергией (в несколько раз большей энергии ионизации исходных молекул) направляется на образец или проходит через газовую камеру в которой в газовой фазе присутствуют исследуемые молекулы. 2. Фотоионизация В этом случае исследуемые молекулы облучаются излучением с Е квантов, превышающих их Е ионизации. (Обычно это УФ или мягкий рентгеновский диапозон). 3. Ионизация в сильном электрическом поле (= полевая ионная эмиссия) В вакуумной камере или над образцом помещается металлическое острие, находящиеся под большим потенциалом. Возникающее электрическое поле вокруг острия с очень большой напряженностью вызывает автоэмиссию электронов. 4. Ионизация ионным ударом Образец облучается потоком ионов Этот способ применяется при необходимости исследования тяжелых ионов, т.к. кинетическая Е возбужденных ионов много больше кинетической Е возбужденных электронов. 5. Электрическая искра в вакууме (высокочастотный разряд) 6. Ионизация лазерным пучком Применяется для получения масспектра тугоплавких соединений (Они испаряются и ионизуются.)
Обычно используются положительные ионы вещества (катионы); хотя в некоторых случаях используют и отрицательные (анионы). Изучение положительных облегчается тем, что их легче получить. С помощью масспектроскопии можно определить изотопный состав элементов. Массу, состав и даже структуру молекулы.
Существуют различные методы разделения ионов в вакууме. Различают:
Ионизация, обычно, электромагнитным полем: очень короткий высочайший импульс ионизирует исследуемый газ. Затем ионы движутся под действием ускоряющей разности потенциалов к коллектору ионов. Т.к. всем ионам придается одно и то же ускорение, они получают одну и ту же кинетическую Е, то из-за различия их масс, скорости их будут различны.
, где V- разность потенциалов между ускоряющими электродами, а е- заряд иона – численное значение элементарного заряда
, где t – время пролета ионов различной массы через пространство l. Значит, более легкие ионы придут на коллектор раньше, тяжелые – позже. Поэтому, время пролета определяет масспектр.
В большинстве случаев условия ионизации подбираются таким образом, чтобы в камере возникали однозарядные ионы. Очень редко используется анализ многозарядных ионов (в случаях, если массы молекул огромны, а различие в 2-3 атомных единицы).
Основаны на том, что ионы в ионизационной камере получают одинаковую Е (так же как и во времяпролетных). Затем они проходят через систему сеточных каскадов, к которым применяется переменное электрическое поле. К промежуточным сеткам (обычно их три, т.е. промежуточная - средняя) при определенной частоте траектория движения иона представляет собой колеблющуюся синусоиду. При фиксированной частоте высокочастотного поля и энергии вылетаемых ионов в щель на коллекторе проходят ионы только одной массы. Меряя частоту поля, можем получить масспектр.
Разделение электронов по массе происходит при одновременном наложении электрического и магнитного полей.
Применяется комбинирование электрического и магнитных полей
Диаметр описываемой спирали зависит от массы
Проблемой в масспектрометрах является регистрация ионных токов, которые исключительно малы. В МС с электронными умножителями чувствительность увеличивается на четыре порядка.
В биологии с помощью масспектроскопии исследуются процессы биохомической кинетики, газовый анализ дыхания и газообмена. Хроматография -один из чувствительных методов разделения смеси веществ. Разделение производится на каких-либо носителях. Самый простой пример – хроматографическая колонка
Элюэнт - это газ или жидкость в которых находится смесь исследуемых веществ, и который продвигается мимо неподвижной подложки. В зависимости от исследуемых веществ элюэнты бывают разные. Подложки тоже бывают разные – твердые, жидкие, пористые, ионообменные смолы. В соответствии с этим различают следующие виды хроматографии: адсорбционная, ионообменная, жидкостная, бумажная и тонкослойная.
Адсорбционная хроматография В этом случае разделение осуществляется за счет различной адсорбционной способности неподвижного носителя к различным компонентам смеси. Обычно, к такой хроматографии прибегают, когда исследуемые соединения обладают полярными группами. Практически всегда поверхность носителя покрыта гидроксильными группами различнойсилы. Одной из разновидностей адсорбционной хроматографии можно считать ионообменную; где носителем являются ионообменные смолы, расположенные либо в колонке, либо тонким слоем на бумаге. Поверхность этих смол состоит из заряженных функциональных групп, ковалентно связанных с нитями решетки ионообменной смолы.
Жидкостная хроматография Здесь роль неподвижного носителя играет жидкость. Разделение происходит за счет различной растворимости исследуемых соединений.
Тонкостная хроматография -любая система, в которой носитель представляет собой тонкий слой (Пример: оксид алюминия III на стеклянной пластинке.)
|
|||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-12; просмотров: 479; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.15.190.144 (0.046 с.) |








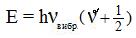
 - колебательное квантовое число (
- колебательное квантовое число ( .
.




 - степень вырождения уровня энергии по k-ому колебательному квантовому числу. Степень вырождения означает число уровней энергии, имеющих одинаковое значение.
- степень вырождения уровня энергии по k-ому колебательному квантовому числу. Степень вырождения означает число уровней энергии, имеющих одинаковое значение.
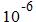 сек.)
сек.)
 (с точностью до ±1 см
(с точностью до ±1 см  ) в 2 раза больше. Тогда значение ν окажется в √2 раз меньше.
) в 2 раза больше. Тогда значение ν окажется в √2 раз меньше.











