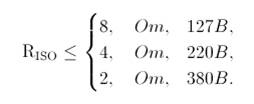Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Умови і правила експлуатаціїСодержание книги
Поиск на нашем сайте
ДОМАШНЯ РОБОТА на тему: « Розробка програми сертифікаційних випробувань БМА » з дисципліни «Сертифікаційні випробування БМА»
Варіант № 4
Виконав: Студент групи БМ-562 Хижняк Антон Перевірив: Проф..Кошева Л.О.
Київ 2014
Завдання 1. Тема завдання: Розробка програми сертифікаційних випробувань БМА. 2. Конкретний вид БМА вибирається по варіантах, представлених в таблиці 2.1. Варіант вибирається за останньою цифрою суми двох останніх цифр залікової книжки. Наприклад, дві останні цифри 0 4, сума їх дорівнює 4, остання цифра суми – 4, тобто обирається прилад відповідно до нульового варіанту. Згідно з моєю заліковою книжкою номер мого варіанту – 4:
3. Зміст завдання – вивчити документацію, що регламентує технічні вимоги до БМА, що сертифікується; – оцінити можливі види небезпек, які можуть виникнути в цьому БМА; –визначити види зовнішніх впливних чинників, які можуть інтенсифікувати вірогідність зниження безпеки виробу; – вибрати схему сертифікації; – встановити склад видів випробувань на безпеку. – вибрати випробувальне устаткування і засоби вимірювань. Зміст Вступ…………………………………………………………………………………4 1. Теоретичні відомості……………………………………………….……….5 2. Практична частина…………………………………………………………..7 2.1. Загальні вимоги до безпеки медичних виробів та ознайомлення з класифікацією БМА. 2.2. Програма випробувань апарату УЗД………………………………...8 2.2.1. Об’єкт випробувань…………………………...………………………9 2.2.2. Мета випробувань…………………………...………………………..9 2.2.3. Загальні положення…………….……………...……………………10 2.2.4. Об'єм випробування…………………………...…………………….10 3. Висновок по роботі…………………………………………………………15 Рекомендована література Додаток 1 Вступ Сертифікація - це один із способів підтвердження відповідності продукції висунутим вимогам або оцінка продукції з погляду її відповідності вимогам стандарту. Сертифікат підтверджує безпечність й екологічну чистоту продукції для споживача, а виробництва - для навколишнього середовища. Він сприяє участі суб'єктів підприємницької діяльності в міжнародному економічному співробітництві. У практиці застосовуються різні методи підтвердження відповідності того чи іншого виду продукту необхідним вимогам. Це можуть здійснювати виробники, замовники, продавці або незалежні органи й організації. Незалежним може бути державний нагляд за дотриманням обов'язкових вимог стандартів, технічний і санітарний нагляд за безпекою, а також відомчий контроль і приймання продукції для державних потреб. Відповідні органи сертифікують продукцію, видають сертифікати відповідності та ліцензії, а також призупиняють або скасовують їхню дію.
1. Теоретичні відомості
Підготовка до сертифікаційних випробувань. Щоб провести випробування, в центр сертифікації необхідно оформити і представити наступні документи: – заявка на сертифікацію (завірена підписом і печаткою, реєстраційні дані фірми-заявника); – Рішення на проведення сертифікації; – укладення Договору на проведення сертифікаційних випробувань; – підготовка початкових даних (технічний опис продукції, відібрані зразки продукції); Програма і методика випробувань. Сертифікаційні випробування проводяться відповідно до програми і методики, узгоджених з органом по сертифікації. Програма і методика може бути розроблена виробником, а також випробувальною лабораторією. У цих документах необхідно прописати перелік перевірок, які мають бути проведені в ході досліджень для підтвердження відповідності технічного пристрою вимогам технічного завдання. Правильно оформлений документ повинен містити наступні розділи: – об'єкт випробувань; – мета випробувань; – обсяг, умови і організація випробувань; – вимоги до характеристик продукції; – вимоги до пакування та марковання продукції; – склад і порядок випробувань; – методи випробувань. – обробку та аналіз результатів випробувань; – звіт за результатами випробувань. У разі потреби (особлива специфіка продукції), в зміст можуть бути внесені корективи, наприклад, додані нові розділи. Якщо ж зміст і оформлення методики і програми випробувань радикально відрізняється від типової програми, то фірма, що розробила її, повинна провести атестацію документу. Проведення сертифікаційних випробувань. Сертифікаційні випробування проводять випробувальні підрозділи, якими є спеціально обладнані лабораторії, що мають державну акредитацію на технічну компетентність і незалежність. Сертифікаційні випробування можуть проводитися на устаткуванні і території виробника або замовника за умови попередньої атестації випробувального устаткування і присутності експерта по сертифікації при випробуваннях для забезпечення їх об'єктивності. Оформлення результатів. За результатами випробувань складається протокол – офіційний документ, в якому фіксуються результати проведених сертифікаційних випробувань продукції і аналіз цих результатів. Протокол випробувань містить встановлені виробником характеристики продукції, показники безпеки з посиланням на вимоги нормативних документів, методи випробувань, числові значення характеристик і результати оцінювання, що підтверджують виконання вимог. У протоколі також приводиться інформація про випробувальне устаткування і засоби вимірювань, вживаних при сертифікаційних випробуваннях. Протокол містить результати випробувань заявленого виробу і є офіційним документом, основою, що служить, для видачі сертифікату відповідності. Видача Сертифікату. Для видачі Сертифікату оформляється Протокол сертифікаційних випробувань, Технічний висновок, Договір про проведення експертизи та Експертиза результатів сертифікаційних випробувань в Органі по сертифікації. Протоколи сертифікаційних випробувань і технічний висновок за результатами сертифікаційних випробувань оформляються відповідно до ДСТУ ISO/IEC 17025:2006 «Загальні вимоги до компетентності випробувальних і калібрувальних лабораторій».
2. Практична частина 2.1. Загальні вимоги до безпеки медичних виробів та ознайомлення з класифікацією БМА. Відповідно до ДСТУ 3798-98. Вироби медичні електричні. Частина 1. Загальні вимоги безпеки (ІЕС 60601-1:1988), загальні вимоги до безпеки медичних виробів має наступний зміст. Медичні вироби при експлуатації не повинні створювати на робочих місцях медичного персоналу та інших користувачів рівні шкідливих факторів (фізичних, хімічних і біологічних), що перевищують гранично допустимі, відповідно до вимог санітарного законодавства. Вироби повинні забезпечувати безпеку пацієнта або безпеку і здоров'я користувачів або, у відповідних випадках, інших осіб, і будь-який ризик пов'язаний з їх застосуванням, повинен бути прийнятним у порівнянні з користю для пацієнта і рівнем забезпечення здоров'я та безпеки. Технічні характеристики та експлуатаційні властивості виробу не повинні чинити такий шкідливий вплив, яке піддавав би ризику безпеку пацієнтів і медичного персоналу або інших осіб протягом терміну служби виробу, зазначеного виробником, при експлуатації відповідно до інструкцій виробника. На кожен вид вироби медичного призначення, вихідної сировини і матеріалів для їх виготовлення підприємство-виробник оформляє і затверджує в установленому порядку нормативно-технічну документацію, в тому числі рецептуру або склад. У нормативній документації та інших, які подаються для санітарно-гігієнічної оцінки матеріалах на медичні вироби зазначаються: - Призначення продукції і область застосування; - Опис вироби із зазначенням (за необхідності) виду і тривалості контакту з організмом; - Склад або рецептура використовуваних матеріалів; - Гігієнічно значущі технічні параметри та характеристики (для виробів медичної техніки), - Дата виробництва; - Рекомендації щодо безпечної експлуатації. В експлуатаційній документації на вироби медичної техніки вказуються всі можливі види небезпек (тобто фізичні та інші фактори, що генеруються даним обладнанням), їх гігієнічно значущі технічні параметри та характеристики, а також вимоги і засоби забезпечення безпеки при експлуатації та обслуговуванні виробів. Вироби повинні бути розроблені, виготовлені і упаковані таким чином, щоб їх технічні характеристики та експлуатаційні властивості в період використання виробів за призначенням не відчували шкідливого впливу при транспортуванні і зберіганні виробі. Вироби медичного призначення і медичної техніки повинні бути забезпечені етикеткою (маркуванням), яка інформує користувача про виробника, області застосування продукції, про терміни і умови застосування та зберігання, а також попереджає про заходи безпеки при експлуатації продукції. За відсутності необхідності прийняття заходів безпеки виробник вказує: «Дотримання заходів безпеки не потрібно». Виробник ІМТ, генеруючого рівні фізичних факторів, що перевищують допустимі, в комплект поставки повинен включати засоби індивідуального захисту (протишумові вкладиші, захисні окуляри, рукавиці) в кількості не менше 2-х шт.
2.2. Програма випробувань АПАРАТ ДЛЯ УЗТ-3.02: Ультразвукова терапія - лікувальне використання ультразвуку шляхом застосування високочастотних ультразвукових хвиль (механічних коливань). Зовнішній вигляд апарту наведено на рисунку 1.
Рисунок 1 - Зовнішній вигляд апарату УЗТ-3.02 2.2.1.Об’єкт випробувань: Повна назва системи – Апарат для ультразвукової терапії – 3.02. Комплектність випробувальної системи наведено у таблиці 1: Таблиця 1 - Комплектність випробувальної системи
2.2.2. Метою випробування є визначення: 1) безпечності апарату УЗТ-3.02; 2) випробування на ЕМС; 3) Безпека довкілля при роботі ультразвуковим обладнанням. 2.2.3. Загальні положення: 1) Документи, на підставі яких проводять випробування: ДСТУ 30324.5-95 Вироби медичні електричні. Частина 2. Окремі вимоги безпеки до апаратів ультразвукової терапії (IEC 601-2-5-84) 2) Місце і тривалість випробувань: лабораторія УкрСЕПРО, 2,5 години. 3) Організації, що беруть участь у випробуваннях: два інженери-метрологи. 4) Документація: довідник з експлуатації УЗТ. 2.2.4. Об'єм випробування. Технічні параметри - Частота ультразвукових коливань 2,64 МГц ± 0,1%; - Інтенсивність ультразвукових коливань регулюється чотирма ступенями 0,05; 0,2; 0,5 і 1,0 Вт/см2; - Ефективна площа великого випромінювача 2 см2, малого - 0,5 см2; - Передбачений імпульсний режим роботи при тривалості імпульсів 2, 4 і 10 мс, частоті проходження 50 Гц; живлення від мережі змінного струму частотою 50 Гц напругою 220 В ± 10%; - Споживана потужність не більше 50 ВА; - По захисту від ураження електричним струмом апарат виконаний по класу I; - Габаритні розміри 342×274×142 мм; маса не більше 10 кг. Зберігання Апаратат УЗТ повинен зберігатися в опалювальних (охолоджуваних) і вентильованих приміщеннях при наступних умовах: температура навколишнього середовища від 1 до 40 ° С; відносна вологість повітря не більше 80% при температурі 25 ° С і нижче. При більш високій температурі вологість повинна бути нижче зазначеної; в приміщеннях для зберігання не повинно бути пилу, парів кислот, лугів, а також газів, що викликають корозію. Зберігання дефібрилятора проводити в футлярі або споживчій тарі. Транспортування Транспортування апарата слід проводити в транспортній тарі будь-яким критим транспортним засобом при температурі зовнішнього середовища від мінус 50 до плюс 50 ° С. Експлуатаційне транспортування виробляється в діапазоні температур від 1 до 40 ° С. Апарат УЗТ відновлює працездатність в приміщеннях з температурою від 10 до 35 ° С через 15 хвилин після закінчення експлуатаційного транспортування. При експлуатації рекомендується переносити в футлярі і оберігати від поштовхів і ударів. Після транспортування при температурі нижче +5 ° С експлуатація БМА може починатися не раніше, ніж через 4 години перебування в приміщенні з температурою від 10 до 35 ° С. Безпечність. Щоб бути впевненим у безпеці роботи, необхідно провести ряд випробувань, які спрямовані на підтримку безпеки та запобігання травм і пошкоджень, які можуть бути викликані наступними чинниками: · ураження електричним струмом; · енергетична небезпека; · пожежа; · механічна і термічна небезпеки; Значення опору заземлення Значення опору заземлювального пристрою з приєднаними нейтралями генераторів і трансформаторів або висновками джерела однофазного струму в електричних установках напругою до 1000 вольт з глухозаземленою нейтраллю повинен бути менше або дорівнює 8, 4 і 2 Ом при лінійних напругах 127, 220 і 380 В джерела однофазного струму або 220, 380 і 660 В джерела трифазного струму відповідно: Вимірювання заземлення Однофазний струм:
Трифазний струм:
Значення опору заземлювального пристрою як захисного заземлення в електричних установках напругою до 1000 вольт з ізольованою нейтраллю повинен задовольняти умові R3yI3 <50 В. При потужності трансформаторів і генераторів рівної 100 кВА і менше опір заземлюючих пристроїв може бути не більше 10 Ом. Для отримання найбільш реальних результатів вимірювання заземлення проводиться при максимальному питомому опорі ґрунту, тобто при максимальному промерзанні (взимку), або найбільшому просиханні (влітку).
Висновок по роботі Після закінчення випробування інженер-метролог зобов’язаний зробити висновок по проведеній роботі. Протестувавши апарат для ультразвукової діагностики, можемо сказати, що він працює справно, не несе небезпеки у використанні оператором медичного закладу або пацієнтом. Інженер метролог занотовує висновки до відпорного бланку, складає всю документацію. Видає замовникам документ, що засвідчує якість продукції – сертифікат відповідності. (Див. Додаток 1)
Використана література: 4.4. ДСТУ 3798-98. Вироби медичні електричні. Частина 1. Загальні вимоги безпеки (ІЕС 60601-1:1988). 4.5. ДСТУ 4388:2005. Вироби медичні. Класифікування залежно від потенційного ризику застосування. Загальні вимоги. 4.6. ДСТУ ISO/IEC 17025:2006. «Загальні вимоги до компетентності випробувальних і калібрувальних лабораторій».
Додаток 1
ДОМАШНЯ РОБОТА на тему: « Розробка програми сертифікаційних випробувань БМА » з дисципліни «Сертифікаційні випробування БМА»
Варіант № 4
Виконав: Студент групи БМ-562 Хижняк Антон Перевірив: Проф..Кошева Л.О.
Київ 2014
Завдання 1. Тема завдання: Розробка програми сертифікаційних випробувань БМА. 2. Конкретний вид БМА вибирається по варіантах, представлених в таблиці 2.1. Варіант вибирається за останньою цифрою суми двох останніх цифр залікової книжки. Наприклад, дві останні цифри 0 4, сума їх дорівнює 4, остання цифра суми – 4, тобто обирається прилад відповідно до нульового варіанту. Згідно з моєю заліковою книжкою номер мого варіанту – 4:
3. Зміст завдання – вивчити документацію, що регламентує технічні вимоги до БМА, що сертифікується; – оцінити можливі види небезпек, які можуть виникнути в цьому БМА; –визначити види зовнішніх впливних чинників, які можуть інтенсифікувати вірогідність зниження безпеки виробу; – вибрати схему сертифікації; – встановити склад видів випробувань на безпеку. – вибрати випробувальне устаткування і засоби вимірювань. Зміст Вступ…………………………………………………………………………………4 1. Теоретичні відомості……………………………………………….……….5 2. Практична частина…………………………………………………………..7 2.1. Загальні вимоги до безпеки медичних виробів та ознайомлення з класифікацією БМА. 2.2. Програма випробувань апарату УЗД………………………………...8 2.2.1. Об’єкт випробувань…………………………...………………………9 2.2.2. Мета випробувань…………………………...………………………..9 2.2.3. Загальні положення…………….……………...……………………10 2.2.4. Об'єм випробування…………………………...…………………….10 3. Висновок по роботі…………………………………………………………15 Рекомендована література Додаток 1 Вступ Сертифікація - це один із способів підтвердження відповідності продукції висунутим вимогам або оцінка продукції з погляду її відповідності вимогам стандарту. Сертифікат підтверджує безпечність й екологічну чистоту продукції для споживача, а виробництва - для навколишнього середовища. Він сприяє участі суб'єктів підприємницької діяльності в міжнародному економічному співробітництві. У практиці застосовуються різні методи підтвердження відповідності того чи іншого виду продукту необхідним вимогам. Це можуть здійснювати виробники, замовники, продавці або незалежні органи й організації. Незалежним може бути державний нагляд за дотриманням обов'язкових вимог стандартів, технічний і санітарний нагляд за безпекою, а також відомчий контроль і приймання продукції для державних потреб. Відповідні органи сертифікують продукцію, видають сертифікати відповідності та ліцензії, а також призупиняють або скасовують їхню дію.
1. Теоретичні відомості
Підготовка до сертифікаційних випробувань. Щоб провести випробування, в центр сертифікації необхідно оформити і представити наступні документи: – заявка на сертифікацію (завірена підписом і печаткою, реєстраційні дані фірми-заявника); – Рішення на проведення сертифікації; – укладення Договору на проведення сертифікаційних випробувань; – підготовка початкових даних (технічний опис продукції, відібрані зразки продукції); Програма і методика випробувань. Сертифікаційні випробування проводяться відповідно до програми і методики, узгоджених з органом по сертифікації. Програма і методика може бути розроблена виробником, а також випробувальною лабораторією. У цих документах необхідно прописати перелік перевірок, які мають бути проведені в ході досліджень для підтвердження відповідності технічного пристрою вимогам технічного завдання. Правильно оформлений документ повинен містити наступні розділи: – об'єкт випробувань; – мета випробувань; – обсяг, умови і організація випробувань; – вимоги до характеристик продукції; – вимоги до пакування та марковання продукції; – склад і порядок випробувань; – методи випробувань. – обробку та аналіз результатів випробувань; – звіт за результатами випробувань. У разі потреби (особлива специфіка продукції), в зміст можуть бути внесені корективи, наприклад, додані нові розділи. Якщо ж зміст і оформлення методики і програми випробувань радикально відрізняється від типової програми, то фірма, що розробила її, повинна провести атестацію документу. Проведення сертифікаційних випробувань. Сертифікаційні випробування проводять випробувальні підрозділи, якими є спеціально обладнані лабораторії, що мають державну акредитацію на технічну компетентність і незалежність. Сертифікаційні випробування можуть проводитися на устаткуванні і території виробника або замовника за умови попередньої атестації випробувального устаткування і присутності експерта по сертифікації при випробуваннях для забезпечення їх об'єктивності. Оформлення результатів. За результатами випробувань складається протокол – офіційний документ, в якому фіксуються результати проведених сертифікаційних випробувань продукції і аналіз цих результатів. Протокол випробувань містить встановлені виробником характеристики продукції, показники безпеки з посиланням на вимоги нормативних документів, методи випробувань, числові значення характеристик і результати оцінювання, що підтверджують виконання вимог. У протоколі також приводиться інформація про випробувальне устаткування і засоби вимірювань, вживаних при сертифікаційних випробуваннях. Протокол містить результати випробувань заявленого виробу і є офіційним документом, основою, що служить, для видачі сертифікату відповідності. Видача Сертифікату. Для видачі Сертифікату оформляється Протокол сертифікаційних випробувань, Технічний висновок, Договір про проведення експертизи та Експертиза результатів сертифікаційних випробувань в Органі по сертифікації. Протоколи сертифікаційних випробувань і технічний висновок за результатами сертифікаційних випробувань оформляються відповідно до ДСТУ ISO/IEC 17025:2006 «Загальні вимоги до компетентності випробувальних і калібрувальних лабораторій».
2. Практична частина 2.1. Загальні вимоги до безпеки медичних виробів та ознайомлення з класифікацією БМА. Відповідно до ДСТУ 3798-98. Вироби медичні електричні. Частина 1. Загальні вимоги безпеки (ІЕС 60601-1:1988), загальні вимоги до безпеки медичних виробів має наступний зміст. Медичні вироби при експлуатації не повинні створювати на робочих місцях медичного персоналу та інших користувачів рівні шкідливих факторів (фізичних, хімічних і біологічних), що перевищують гранично допустимі, відповідно до вимог санітарного законодавства. Вироби повинні забезпечувати безпеку пацієнта або безпеку і здоров'я користувачів або, у відповідних випадках, інших осіб, і будь-який ризик пов'язаний з їх застосуванням, повинен бути прийнятним у порівнянні з користю для пацієнта і рівнем забезпечення здоров'я та безпеки. Технічні характеристики та експлуатаційні властивості виробу не повинні чинити такий шкідливий вплив, яке піддавав би ризику безпеку пацієнтів і медичного персоналу або інших осіб протягом терміну служби виробу, зазначеного виробником, при експлуатації відповідно до інструкцій виробника. На кожен вид вироби медичного призначення, вихідної сировини і матеріалів для їх виготовлення підприємство-виробник оформляє і затверджує в установленому порядку нормативно-технічну документацію, в тому числі рецептуру або склад. У нормативній документації та інших, які подаються для санітарно-гігієнічної оцінки матеріалах на медичні вироби зазначаються: - Призначення продукції і область застосування; - Опис вироби із зазначенням (за необхідності) виду і тривалості контакту з організмом; - Склад або рецептура використовуваних матеріалів; - Гігієнічно значущі технічні параметри та характеристики (для виробів медичної техніки), - Дата виробництва; - Рекомендації щодо безпечної експлуатації. В експлуатаційній документації на вироби медичної техніки вказуються всі можливі види небезпек (тобто фізичні та інші фактори, що генеруються даним обладнанням), їх гігієнічно значущі технічні параметри та характеристики, а також вимоги і засоби забезпечення безпеки при експлуатації та обслуговуванні виробів. Вироби повинні бути розроблені, виготовлені і упаковані таким чином, щоб їх технічні характеристики та експлуатаційні властивості в період використання виробів за призначенням не відчували шкідливого впливу при транспортуванні і зберіганні виробі. Вироби медичного призначення і медичної техніки повинні бути забезпечені етикеткою (маркуванням), яка інформує користувача про виробника, області застосування продукції, про терміни і умови застосування та зберігання, а також попереджає про заходи безпеки при експлуатації продукції. За відсутності необхідності прийняття заходів безпеки виробник вказує: «Дотримання заходів безпеки не потрібно». Виробник ІМТ, генеруючого рівні фізичних факторів, що перевищують допустимі, в комплект поставки повинен включати засоби індивідуального захисту (протишумові вкладиші, захисні окуляри, рукавиці) в кількості не менше 2-х шт.
2.2. Програма випробувань АПАРАТ ДЛЯ УЗТ-3.02: Ультразвукова терапія - лікувальне використання ультразвуку шляхом застосування високочастотних ультразвукових хвиль (механічних коливань). Зовнішній вигляд апарту наведено на рисунку 1.
Рисунок 1 - Зовнішній вигляд апарату УЗТ-3.02 2.2.1.Об’єкт випробувань: Повна назва системи – Апарат для ультразвукової терапії – 3.02. Комплектність випробувальної системи наведено у таблиці 1: Таблиця 1 - Комплектність випробувальної системи
2.2.2. Метою випробування є визначення: 1) безпечності апарату УЗТ-3.02; 2) випробування на ЕМС; 3) Безпека довкілля при роботі ультразвуковим обладнанням. 2.2.3. Загальні положення: 1) Документи, на підставі яких проводять випробування: ДСТУ 30324.5-95 Вироби медичні електричні. Частина 2. Окремі вимоги безпеки до апаратів ультразвукової терапії (IEC 601-2-5-84) 2) Місце і тривалість випробувань: лабораторія УкрСЕПРО, 2,5 години. 3) Організації, що беруть участь у випробуваннях: два інженери-метрологи. 4) Документація: довідник з експлуатації УЗТ. 2.2.4. Об'єм випробування. Технічні параметри - Частота ультразвукових коливань 2,64 МГц ± 0,1%; - Інтенсивність ультразвукових коливань регулюється чотирма ступенями 0,05; 0,2; 0,5 і 1,0 Вт/см2; - Ефективна площа великого випромінювача 2 см2, малого - 0,5 см2; - Передбачений імпульсний режим роботи при тривалості імпульсів 2, 4 і 10 мс, частоті проходження 50 Гц; живлення від мережі змінного струму частотою 50 Гц напругою 220 В ± 10%; - Споживана потужність не більше 50 ВА; - По захисту від ураження електричним струмом апарат виконаний по класу I; - Габаритні розміри 342×274×142 мм; маса не більше 10 кг. Умови і правила експлуатації - температура навколишнього середовища від 7 до 43 ° С; - відносна вологість повітря до 97% при температурі 26 ° С; - атмосферний тиск від 630 до 800 мм рт.ст. (від 83,9 до 106,6 кПа). Не рекомендовано розташовувати прилад близько потужних трансформаторів,рентгенівських установок та інших пристроїв, що створюють електричні та акустичні перешкоди.
|
||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-06; просмотров: 242; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.119.106.66 (0.013 с.) |