
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Уравнение Ван-дер-Ваальса, физический смысл поправок. Изотермы Ван-дер-Ваальса и их сравнение с экспериментальными изотермами
Для реальных газов необходимо ввести поправки в уравнение состояния идеального газа, учитывающие объем молекул и силы их взаимодействия. Эти поправки были учтены голландским физиком Ван-дер-Ваальсом. Часть объема V газа занята самими молекулами. Поэтому объем, занимаемый газом, должен быть уменьшен на величину b, пропорциональную объему молекул:
где В реальных газах имеются силы взаимного притяжения молекул, которые действуют дополнительно к силам внешнего давления и как бы сжимают газ. Вследствие этого возникает добавочное внутреннее давление
где
Принимая данные обстоятельства во внимание, уравнение состояния реального газа принимает следующий вид:
где а, Изотермы Исследование уравнения (4) удобно производить, рассматривая изотермы Ван-дер-Ваальса. Анализируя графики
1. При высоких температурах (например, T 1, которой соответствует изотерма 1) изобара AD пересекает изотерму в одной точке. Уравнение Ван-дер-Ваальса имеет один вещественный корень, т.е. каждому значению T соответствует единственное значение объема. Из этого следует, что при высоких температурах вещество находится в однофазном – газообразном состоянии. 2. Невысоким температурам соответствуют изотермы 2, 3, 4, на которых имеются перегибы. Изобара AD пересекает изотерму 4 в трех точках А, B, C. В уравнении Ван-дер-Ваальса это состояние соответствует трём вещественным значениям объема при данных p и T. Это означает, что вещество находится в трёх фазовых состояниях. Под фазой понимают совокупность всех частей системы, обладающих одинаковыми физическими и химическими свойствами. 3. Переход изотермы 5 к изотермам 4, 3 и т. д., соответствующий повышению температуры, приводит к тому, что изгибы на изотермах сглаживаются. Расстояние, например, между точками A и C уменьшается и уже на изотерме 2 они сливаются в одну точку – точку К перегиба. В точке перегиба изобара
Экспериментальные изотермы (рис. 2) могут быть получены путём сжатия газа в изотермических условиях. Экспериментальные и теоретические изотермы на участках 1 – 2 и 3 – 4 с известным приближением можно считать совпадающими. При особых условиях эксперимента могут быть получены участок 2 – 2/, соответствующий пересыщенному пару, и участок 3 – 3/, относящийся к перегретой жидкости. Это малоустойчивые, метастабильные состояния.
Метастабильным состоянием называется равновесное состояние с ограниченной устойчивостью. При отклонении от этого состояния вещество не стремится к нему обратно, а легко переходит в другое устойчивое состояние. Метастабильные состояния существуют ограниченное время. Чтобы получить такое метастабильное состояние как перегретый пар необходимо отсутствие в газе инородных и смачиваемых включений, которые являются центрами конденсации. Перегретой может быть только очень чистая жидкость, в которой нет зародышей газовой фазы. Как правило, они всегда присутствуют в виде мельчайших пузырьков на стенках сосуда, содержащего жидкость, или на взвешенных в жидкости пылинках. Вещество на участке 2 – 3 находиться в двухфазном состоянии, т. е. часть первоначального газообразного вещества превратилась в жидкость, а часть осталась в газообразном состоянии. Соответствующее участку 2 – 3 давление называется давлением насыщения. Точка 3 (рис. 2) соответствует состоянию, когда весь газ превращается в жидкость. С ростом температуры участки, соответствующие двухфазному состоянию, становятся уже (рис. 3). Затем появляется изотерма, на которой этот участок превращается в точку перегиба К; ей соответствует критическая температура. При температурах ниже критической есть участок насыщения, и вещество может переходить из газообразного состояния в жидкое состояние (область I, рис. 3). Температурам выше критической соответствует только газообразное состояние (область II, рис. 3). Область III, примыкающая к оси ординат (рис. 3), относится к жидкому состоянию системы.
Критическая температура – это наивысшая температура, при которой газ может ещё быть превращён в жидкость. Давление и объем, соответствующие точке перегиба К, называются критическими. При критическом состоянии вещества различия в свойствах пара и жидкости отсутствуют. Критическое состояние характеризуется непрерывным переходом пара в жидкость и жидкости в пар. При этом удельная теплота парообразования и коэффициент поверхностного натяжения равны нулю. Параметры критического состояния вещества связаны с постоянными Ван-дер-Ваальса
или
|
||||||||||||
|
Последнее изменение этой страницы: 2016-08-01; просмотров: 2489; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.221.235.209 (0.007 с.) |
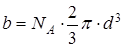 , (1)
, (1) – постоянная Авогадро,
– постоянная Авогадро,  – диаметр молекулы. Теоретические расчёты показывают, что величина b в четыре раза превосходит объем молекул.
– диаметр молекулы. Теоретические расчёты показывают, что величина b в четыре раза превосходит объем молекул. , которое пропорционально квадрату концентрации молекул или обратно пропорционально квадрату объема газа:
, которое пропорционально квадрату концентрации молекул или обратно пропорционально квадрату объема газа: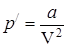 , (2)
, (2)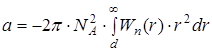 , (3)
, (3)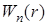 – потенциальная энергия притяжения двух молекул (
– потенциальная энергия притяжения двух молекул (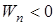 ).
). , (4)
, (4) – константы, определяемые экспериментальным путём,
– константы, определяемые экспериментальным путём, 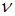 –количество вещества,
–количество вещества, 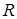 – универсальная газовая постоянная.
– универсальная газовая постоянная.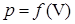 на рис. 1, можно сделать три вывода.
на рис. 1, можно сделать три вывода.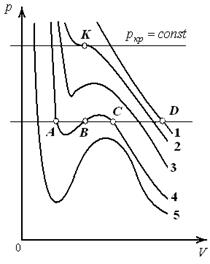
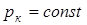 является касательной к изотерме. Температура Tк, соответствующая этой изотерме называется критической температурой.
является касательной к изотерме. Температура Tк, соответствующая этой изотерме называется критической температурой.

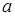 и
и 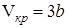 ,
, 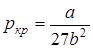 ,
,  , (5)
, (5)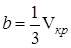 ,
, 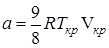 .
.


