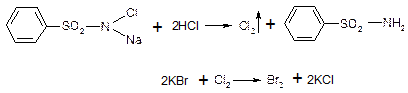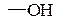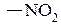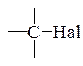Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Анализ неорганических лекарственных веществ по наличию катионов и анионов и органических лекарственных веществ по функциональным группам
МЕТОДИЧЕСКИЕ УКАЗАНИЯ К ЛАБОРАТОРНОМУ ЗАНЯТИЮ ПО ФАРМАЦЕВТИЧЕСКОЙ ХИМИИ ДЛЯ СТУДЕНТОВ III КУРСА ФАРМАЦЕВТИЧЕСКОГО ФАКУЛЬТЕТА (10 часов)
Архангельск 2005 Авторы: канд. фарм. наук доц. курса фармации кафедры фармакологии Струсовская О.Г.
Рецензенты: доктор мед. наук проф. кафедры фармакологии Буюклинская О.В.
канд. биол. наук доц. кафедры биомедицинской химии Айвазова Е.А.
УТВЕРЖДЕНО на заседании ЦКМС СГМУ «____»_____________2005 г. Председатель ЦКМС, профессор Вязьмин А.М.
Методические указания ставят своей целью более глубокое усвоение студентами общих методов анализа органических лекарственных веществ по функциональным группам, приобретение умений и навыков будущего специалиста.
Лабораторная работа № 1 Тема: Общие реакции на подлинность. Анализ неорганических лекарственных препаратов.
Цель работы: Освоить способы выполнения общих реакций установления подлинности неорганических лекарственных препаратов.
Для выполнения практической части работы задания студент должен знать:
- Содержание общей статьи «Химические методы анализа. Общие реакции на подлинность» (ГФ XI, вып. I, стр. 159-165). - механизмы химических реакций, используемые в фармацевтическом анализе для установления подлинности неорганических лекарственных препаратов; - способы расчета массы препарата, необходимой для определения ионов, входящих в состав молекулы исследуемого лекарственного вещества.
В процессе выполнения задания студент должен уметь: - брать навеску на аптечных и аналитических весах; - работать с пипетками и бюретками; - проводить определение подлинности неорганических лекарственных препаратов; - рассчитывать массу препарата, необходимую для определения иона, входящего в состав вещества. - делать заключение о подлинности лекарственных веществ на основе проведенных химических реакций.
Литература 1. Государственная фармакопея СССР.- XI изд.- М,: Медицина, 1987.-Вып.1.-с. 159-165. Методические указания «Анализ неорганических лекарственных веществ по наличию катионов и анионов и органических лекарственных веществ по функциональным группам».
Задания для самостоятельной работы студентов Задание 1. Провести реакции подлинности на определяемые катионы и анионы, входящие в состав молекул неорганических лекарственных веществ. Вопросы для самоподготовки 1. С помощью каких химических реакций можно отличить галогенид-ионы друг от друга? 2. Растворы нитратов и нитритов дают одинаковый аналитический эффект с раствором дифениламина. С помощью какого реактива можно различить эти анионы? 3. Как отличить карбонат и гидрокарбонат-ионы? 4. По какой формуле можно рассчитать массу вещества, необходимую для проведения реакции на обнаружение определенного катиона или аниона? 5. С помощью каких реакций идентифицируют катионы натрия, калия, кальция, аммония, магния, цинка, висмута, железа (II), железа (III)? 6. Напишите механизмы реакций идентификации анионов: карбонат – и гидрокарбонат-ионов; нитрат- и нитрит-ионов; фосфат-, сульфат-, сульфит-, хлорид-, бромид- и иодид-ионов. Информационный блок Анализ неорганических веществ основан на взаимодействии отдельных ионов. Определенный катион с одним и тем же анионом дают одинаковый продукт реакции независимо от того, в составе какого соединения они были до реакции. Это свойство позволяетустановить подлинность катионов или анионов в различных неорганических лекарственных веществах похарактерным для них реакциям. Количество вещества, необходимое для определения иона рассчитывают по формуле:
Mr – молярная масса лекарственного вещества; F – минимальное содержание определяемого иона, г; Ar – атомная масса определяемого иона.
Например, для обнаружения иона натрия следует взять на анализ 1 мл раствора соли, содержащей 0,01-0,03 г иона натрия, подкислить разведенной уксусной кислотой, прибавить 0,5 мл раствора цинк-уранил-ацетата.
1. Рассчитываем содержание соли натрия, например, натрия хлорида в граммах:
2. Т.к. 0,025 г катиона натрия должно содержаться в 1 мл раствора, 0,25 г натрия хлорида растворяем в 10 мл воды очищенной. 3. К 1 мл полученного раствора, прибавляем 2-3 капли раствора кислоты уксусной разведенной и 0,5 мл раствора цинк-уранил-ацетата. Образуется желтый кристаллический осадок.
1. Определение иона натрия а) Отмеривают 1 мл 10%-ного раствора натрия сульфата, подкисляют разведенной уксусной кислотой, если необходимо, фильтруют, затем прибавляют 0,5 мл раствора цинк-уранил-ацетата; образуется желтый кристаллический осадок:
NaCl + Zn[(UO2)3(CH3COO)8] + CH3COOH+9H2O→ NaZn[(UO2)3(CH3COO)9]∙9H2O↓+HCl
б) Соль натрия, внесенная в бесцветное пламя, окрашивает его в желтый цвет.
2. Определение иона калия а) К 1 мл 10%-ного раствора калия иодида прибавляют 1 мл раствора винной кислоты, 1 мл раствора ацетата натрия, 0,5 мл спирта этилового 95% и встряхивают. Постепенно выпадает белый кристаллический осадок:
Осадок растворяется в разведенных минеральных кислотах и растворах едких щелочей.
б) К 1 мл 10%-ного раствора калия иодида прибавляют 0,5 мл разведенной уксусной кислоты, 0,5 мл раствора кобальтинитрита натрия; образуется желтый кристаллический осадок:
Na3[Co(NO2)6] + 2KCl → K2Na[Co(NO2)6]↓ + 2NaCl
в) Соль калия, внесенная в бесцветное пламя горелки окрашивает его в фиолетовый цвет.
3. Определение иона серебра а) К 1 мл 2%-ного раствора серебра нитрата прибавляют 2-3 капли разведенной хлористоводородной кислоты или раствора хлорида натрия; образуется белый творожистый осадок, нерастворимый в азотной кислоте, растворимый в растворе аммиака:
AgNO3 + NaCl → NaNO3 + AgCl↓ AgCl + 2NH4OH → [Ag(NH3)2]Cl + 2H2O
б) К 1 мл 2%-ного раствора серебра нитрата прибавляют раствор аммиака до растворения образующегося вначале осадка, затем 2-3 капли раствора формальдегида и нагревают. На стенках пробирки образуется блестящий налет металлического серебра:
2AgNO3 + 2NH4OH → Ag2O↓ + 2NH4NO3 + H2O CH2O + Ag2O → 2Ag↓ + HCOOH 4. Определение иона магния К 1 мл 5% раствора магния сульфата прибавляют 1 мл раствора хлорида аммония, 0,5 мл раствора гидрофосфата натрия и 1 мл раствора аммиака. Образуется белый кристаллический осадок, растворимый в уксусной кислоте: MgSO4 + Na2HPO4 + NH4OH 5. Определение иона кальция а) К 1 мл 5% раствора кальция хлорида добавляют 1 мл раствора оксалата аммония. Образуется белый осадок:
CaCl2 + (NH4)2C2O4 → CaC2O4↓ + 2NH4Cl
Осадок нерастворим в разведенной уксусной кислоте и растворе аммиака, но растворим в разведенных минеральных кислотах.
б) Соль кальция, смоченная хлористоводородной кислотой и внесенная в бесцветное пламя, окрашивает его в кирпично-красный цвет.
6. Определение иона цинка а) К 2 мл нейтрального 5%-ного раствора цинка сульфата прибавляют 0,5мл раствора сульфида натрия. Образуется белый осадок:
ZnSO4 + Na2S → ZnS ↓ + Na2SO4
Осадок нерастворим в разведенной уксусной кислоте, но легко растворим в разведенной хлористоводородной кислоте.
б) К 2 мл 5%-ного раствора цинка сульфата прибавляют 0,5 мл раствора гексацианоферрата (II) калия (ферроцианида калия); образуется белый студенистый осадок:
ZnSO4 + K4[Fe(CN)6] → ZnK2[Fe(CN)6] ↓ + K2SO4
Осадок нерастворим в разведенной хлористоводородной кислоте.
7. Определение иона аммония 1 мл 1 %-ного раствора аммония хлорида нагревают с 0,5 мл раствора гидроксида натрия. Выделяется аммиак, обнаруживаемый по запаху и по посинению влажной красной лакмусовой бумаги:
NH4Cl + NaOH → NH3 ↑ + H2O
8. Определение иона висмута а) Массу висмута нитрата основного (около 0,1 г) взбалтывают с 3 мл разведенной хлористоводородной кислоты и фильтруют. К фильтрату прибавляют 1 мл раствора сульфида натрия. Появляется коричнево-черный осадок:
2Bi(NO3)3 +3Na2S → Bi2S3↓ + 6NaNO3
Осадок растворим в равном объеме концентрированной азотной кислоты.
б) Массу висмута нитрата основного (около 0,1 г) взбалтывают с 5 мл разведенной серной кислоты и фильтруют. К фильтрату прибавляют 2 капли раствора иодида калия, выпадает черный осадок, растворимый в избытке реактива с образованием раствора желтовато-оранжевого цвета:
Bi(NO3)3 + 3KI → BiI3 ↓ + 3KNO3 BiI3 + KI → KBiI4
9. Определение иона железа (II) К 2 мл свежеприготовленного 5%-ногораствора железа (II) сульфата прибавляют раствор сульфида аммония. Образуется черный осадок:
FeSO4 + Na2S → FeS ↓ + Na2SO4
Осадок растворим в разведенных минеральных кислотах.
10. Определение иона железа (III) а) К 1 мл 3% раствора железа (III) хлорида прибавляют 5 мл воды, 0,5 мл разведенной хлористоводородной кислоты и 1-2 капли раствора гексацианоферрата (II) калия. Образуется синий осадок:
FeCl3 + K4[Fe(CN)6] → KFe[Fe(CN)6] ↓ + 3KCl
б) К 1 мл 3% раствора железа (III) хлорида прибавляют 5 мл воды, 0,5 мл разведенной хлористоводородной кислоты и 1-2 капли раствора тиоцианата аммония. Появляется красное окрашивание:
FeCl3 + 3NH4NCS → Fe(NCS)3 + 3NH4Cl
в) К 1 мл 3% раствора железа (III) хлорида прибавляют 5 мл воды и 2-3 капли раствора сульфида аммония. Образуется черный осадок:
2FeCl3 + 3(NH4)2S → Fe2S3 ↓ + 6NH4Cl Осадок растворим в разведенных минеральных кислотах. 11. Определение карбонат- (гидрокарбонат)-иона а) К 0,2 г натрия карбоната (гидрокарбоната) или к 2 мл 10% раствора натрия карбоната (гидрокарбоната) прибавляют 0,5 мл кислоты хлористоводородной разведенной. Выделяются пузырьки диоксида углерода. При пропускании их через известковую воду образуется белый осадок кальция карбоната:
Na2CO3 + 2HCl → 2NaCl + H2O + CO2↑ Ca(OH)2 + CO2 → CaCO3↓ + H2O
б) К 2 мл 10%-ного раствора натрия карбоната прибавляют 54 капли насыщенного раствора сульфата магния, образуется белый осадок (гидрокарбонат образует осадок только при кипячении смеси):
4Na2CO3 + 4MgSO4 + 4H2O → 3MgCO3∙ Mg (OH)2∙3H2O↓ + 4Na2SO4+ CO2↑
в) Раствор натрия карбоната 10%-ный при прибавлении 1 капли раствора фенолфталеина окрашивается в красный цвет (отличие от гидрокарбоната).
12. Определение нитрат-иона а) К 0,01 г натрия нитрата прибавляют несколько капельраствора дифениламина. Появляетсясинее окрашивание:
б) Натрия нитрат (около 0,005 г) не обесцвечивает раствор перманганата калия, подкисленный серной кислотой (отличие от нитритов).
в) К 0,005г натрия нитрата прибавляют по2-3 капли водыи концентрированной серной кислоты, кусочек металлической меди и нагревают. Выделяются бурые пары диоксида азота:
Cu + 2NaNO3 + 2H2SO4 → CuSO4 + 2NO2↑ + 2H2O + Na2SO4
13. Определение нитрит-иона а) К 0,002 г натрия нитрита прибавляют несколько капельраствора дифениламина. Появляетсясинее окрашивание:
б) К 1 мл 10%-ного раствора натрия нитрита прибавляют 1 мл разведенной серной кислоты. Выделяются желто-бурые пары (отличие от нитратов):
2NaNO2 + H2SO4 → NO↑ + NO2↑ + Na2SO4 + H2O
в) Несколько кристаллов антипирина растворяют в фарфоровой чашке в 2 капляхразведенной хлористоводородной кислоты, прибавляют 1 каплю 10%-ного раствора натрия нитрита. Появляется зеленое окрашивание (отличие от нитратов):

14. Определение фосфат-иона а) К 2 мл нейтрального 5%-ного раствора натрия фосфата двузамещенного прибавляют несколько капель раствора нитрата серебра. Образуется желтый осадок, растворимый в разведенной азотной кислоте и растворе аммиака.
3AgNO3 + Na2HPO4 → Ag3PO4↓ + 2NaNO3 + HNO3
б) К 2 мл 5%-ного раствора натрия фосфата двузамещенного в разведенной азотной кислоте прибавляют 2 мл раствора молибдата аммония и нагревают. Образуется желтый кристаллический осадок, растворимый в растворе аммиака.
H3PO4 + 21 HNO3 + 12(NH4)2MoO4 → (NH4)3PO4∙12MoO3↓ + 21NH4NO3 + 12H2O
15. Определение хлорид-иона К 2 мл 0,5% раствора натрия хлорида прибавляют 0,5 мл разведенной азотной кислоты и 0,5 мл раствора нитрата серебра. Образуется белый творожистый осадок, растворимый в растворе аммиака. При испытании подлинности гидрохлоридов органических оснований растворимость образовавшегося осадка хлорида серебра устанавливают после отфильтровывания и промывания его водой.
AgNO3 + NaCl → NaNO3 + AgCl↓ AgCl + 2NH4OH → [Ag(NH3)2]Cl + 2H2O
16. Определение бромид-иона а) К 1 мл 1% -ного раствора калия бромида прибавляют 1 мл разведенной хлористоводородной кислоты, 0,5 мл раствора хлорамина, 1 мл хлороформа и взбалтывают. Хлороформный слой окрашивается в желто-бурый цвет:
б) К 1 мл 1%-ного раствора калия бромида, подкисленного азотной кислотой, прибавляют несколько капель раствора нитрата серебра. Образуется желтоватый осадок, мало растворимый в растворе аммиака:
AgNO3 + NaBr → NaNO3 + AgBr↓ AgBr + 2NH4OH → [Ag(NH3)2]Br + 2H2O
17. Определение йодид-иона а) К 2 мл 1%-ного раствора калия йодида прибавляют 0,2 мл разведенной серной кислоты, 0,2 мл раствора нитрита натрия или раствора хлорида железа (III) и 2 мл хлороформа. При взбалтывании хлороформный слой окрашивается в фиолетовый цвет:
2NaNO2 + 2KI + 2H2SO4 → I2 ↓ + 2NO↑ + K2SO4 + Na2SO4 + 2H2O
б) К 2 мл 1%-ного раствора калия иодида прибавляют 0,5 мл азотной кислоты и 0,5 мл раствора нитрата серебра. Образуется желтый творожистый осадок: 8HI + H2SO4 → 4I2↑ + H2S↑ + 4H2O
Анионы органических кислот Ацетат ион а) 2 мл 2% раствора калия ацетата нагревают с равным объемом концентрированной серной кислоты и 0,5 мл спирта этилового 95%. Ощущается запах этилацетата: 2CH3COOK + 2C2H5OH + H2SO4 → 2CH3COOC2H5 ↑ + 2H2O + K2SO4
б) К 2 мл нейтрального 2% раствора калия ацетата прибавляют 0,2 мл раствора хлорида железа (III). Появляется красно-бурое окрашивание, исчезающее при прибавлении разведенных минеральных кислот:
9CH3COOK+3FeCl3 + 2H2O → [(CH3COO)6∙Fe3(OH)2] + CH3COO - + 9KCl + 2CH3COOH Бензоат-ион К 2 мл нейтрального 1%-ного раствора натрия бензоата прибавляют 0,2 мл раствора хлорида железа (III). Образуется осадок розовато-желтого цвета, растворимый в эфире:
Салицилат-ион К 2 мл нейтрального 0,5% раствора натрия салицилата прибавляют 2 капли раствора хлорида железа (III); появляется сине-фиолетовое или красно-фиолетовое окрашивание:
Окраска сохраняется при добавлении небольшого объема уксусной кислоты, но исчезает при добавлении разведенной хлористоводородной кислоты. При этом выделяется белый кристаллический осадок салициловой кислоты.
Тартрат-ион а) К 1 мл свежеприготовленного 2%-ного раствора винной кислоты прибавляют кристаллик калия хлорида, 0,5 мл спирта этилового 95% и потирают стеклянной палочкой о стенки пробирки. Выделяется белый кристаллический осадок, растворимый в разведенных кислотах и растворах едких щелочей:
б) 0,25 мл свежеприготовленного 2%-ного раствора винной кислоты нагревают с 1 мл концентрированной серной кислоты и несколькими кристаллами резорцина; через 15-30 сек появляется вишнево-красное окрашивание.
Цитрат-ион а) К 1 мл нейтрального1%-ного раствора натрия цитрата прибавляют 1 мл раствора хлорида кальция; раствор остаеься прозрачным. При последующем кипячении появляется белый осадок, растворимый в хлористоводородной кислоте:
Результаты проведенных исследований студент оформляет в виде протокола, образец которого приведен ниже:
дата. Протокол анализа неорганических лекарственных веществ и анионов органических кислот
Лабораторная работа №2 Введение Методические указания «Анализ органических лекарственных веществ по функциональным группам» предназначены для самостоятельной работы студентов III курса фармацевтического факультета. Чтобы подтвердить принадлежность лекарственного вещества к той или иной химической группе, необходимо умение обнаруживать присутствие в его молекуле определенной функциональной группы и подтверждать ее присутствие. Такой вид анализа называется функциональным.
Цель работы - приобретение практических умений и навыков в анализе органические лекарственные вещества по функциональным группам.
2.1. Целевые задачи: - освоение теоретических знаний по теме: «Анализ органических лекарственных веществ по функциональным группам»; - формирование умений самостоятельной работы при подтверждении наличия в молекуле лекарственного вещества той или иной функциональной группы.
2.2. В процессе выполнения задания студент должен знать: - общие закономерности качественного анализа органических лекарственных веществ по функциональным группам; - механизмы химических реакций, происходящих при идентификации функциональных групп в молекулах лекарственных веществ.
2.3. В процессе выполнения занятия студент должен уметь: - выполнять методики анализа органических лекарственных веществ по функциональным группам; - делать заключение о присутствии той или иной функциональной группы в молекуле лекарственного вещества; - писать уравнения химических реакций, происходящих при обнаружении или подтверждении наличия функциональных групп в молекулах органических лекарственных веществ.
3. Самостоятельная внеаудиторная работа студентов по подготовке к выполнению лабораторной работы 3.1. Задание для самоподготовки Студенту необходимо знать: - названия и строение функциональных групп; - механизмы реакций, с помощью которых можно подтвердить наличие той или иной функциональной группы в органическом лекарственном веществе; - особенности проведения реакций идентификации органических лекарственных веществ по функциональным группам. Литература 1. Беликов В.Г. Фармацевтическая химия. В 2 ч.: Ч.1. Общая фармацевтическая химия; Ч. 2. Специальная фармацевтическая химия: Учеб. для вузов. – Пятигорск, 2003.- 720 с. 2. Государственная фармакопея СССР: Общие методы анализа. – 11-е изд., доп. / МЗ СССР. – Вып. 1. – М.: Медицина, 1987. – 336 с. 3. Государственная фармакопея СССР. – 10-е изд. – М.: Медицина, 1968. – 1079 с. 4. Лабораторные работы по фармацевтической химии /Под ред. проф. В.Г.Беликова. – М.: Высш.шк., 1989. – 375 с. 5. Лабораторные работы по фармацевтической химии: Учебное пособие / Беликов В.Г., Вергейчик Е.Н., Компанцева Е.В., Куль И.Я., Лукьянчикова Г.И., Саушкина А.С., Тираспольская С.Г./ под ред. Е.Н.Вергейчика, Е.В.Компанцевой.- 2-е изд., перераб. и доп. – Пятигорск, 2003. – с.342. 6. Мелентьева Г.А., Цуркан А.А., Гулимова Т.Е. Анализ фармакопейных препаратов по функциональным группам (Методические разработки для самостоятельной подготовки студентов). – I – IV, Рязань, 1981. 7. Методы анализа лекарств /Максютина Н.П., Каган Ф.Е., Митченко Ф.А. – Киев: Здоров^я, 1984. – 224 с. 8. Руководство к лабораторным занятиям по фармацевтической химии / Под ред. П.С.Сенова. – М.: Медицина, 1978. – 360 с. 9. Руководство к лабораторным занятиям по фармацевтической химии: Учеб. пособие /Аксенова Э.Н., Андрианова О.П., Арзамасцев А.П. и др. / Под ред. А.П.Арзамасцева. – 3-е изд., перераб. и доп. – М.: Медицина, 2001. – 384 с. 10. Фармацевтический анализ по функциональным группам (Методические указания для студентов очного факультета). – Пермь, 1991. – 42 с.
Информационный блок
Органические лекарственные средства идентифицируются, как правило, по функциональным группам и структурным фрагментам молекул. Функциональные группы – это группы атомов, которые отличаются высокой реакционной способностью и легко взаимодействуют с различными реактивами со специфическим аналитическим эффектом (цвет, запах, осадок, выделение газа и т.д.). Структурный фрагмент – это часть молекулы лекарственного вещества, которая взаимодействует с реактивом с заметным аналитическим эффектом.
Функциональные группы
5.1.1. Содержащие кислород:
а) гидроксильная группа (спиртовый и фенольный гидроксилы):
б) альдегидная группа:
в) кетонная группа:
г) гидроксиацетильная группа (α-кетольная группа):
д) карбоксильная группа:
е) сложноэфирная группа и лактонная группа:
ж) простая эфирная группа:
5.1.2. Содержащие азот: а) первичная ароматическая и алифатическая аминогруппы:
б) вторичная аминогруппа:
в) третичная аминогруппа:
г) амидная группа:
д) азометиновая группа:
е) гидразидная группа:
ж) нитрогруппа:
5.1.3. Содержащие серу: а) тиольная группа (сульфгидрильная группа):
б) сульфамидная группа:
в) органически связанная сера:
5.1.4. Содержащие галоген: а) органически связанный галоген:
5.2. Структурные фрагменты: 5.2.1. Двойная связь:
5.2.2. Фенильный радикал:
|
|||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-23; просмотров: 557; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.133.109.30 (0.191 с.) |



 MgNH4PO4↓ + Na2SO4 + H2O
MgNH4PO4↓ + Na2SO4 + H2O