
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Курс фармации кафедры фармакологииСтр 1 из 4Следующая ⇒
СЕВЕРНЫЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ КУРС ФАРМАЦИИ КАФЕДРЫ ФАРМАКОЛОГИИ
Анализ неорганических лекарственных веществ по наличию катионов и анионов и органических лекарственных веществ по функциональным группам МЕТОДИЧЕСКИЕ УКАЗАНИЯ К ЛАБОРАТОРНОМУ ЗАНЯТИЮ ПО ФАРМАЦЕВТИЧЕСКОЙ ХИМИИ ДЛЯ СТУДЕНТОВ III КУРСА ФАРМАЦЕВТИЧЕСКОГО ФАКУЛЬТЕТА (10 часов)
Архангельск 2005 Авторы: канд. фарм. наук доц. курса фармации кафедры фармакологии Струсовская О.Г.
Рецензенты: доктор мед. наук проф. кафедры фармакологии Буюклинская О.В.
канд. биол. наук доц. кафедры биомедицинской химии Айвазова Е.А.
УТВЕРЖДЕНО на заседании ЦКМС СГМУ «____»_____________2005 г. Председатель ЦКМС, профессор Вязьмин А.М.
Методические указания ставят своей целью более глубокое усвоение студентами общих методов анализа органических лекарственных веществ по функциональным группам, приобретение умений и навыков будущего специалиста.
Лабораторная работа № 1 Тема: Общие реакции на подлинность. Анализ неорганических лекарственных препаратов.
Цель работы: Освоить способы выполнения общих реакций установления подлинности неорганических лекарственных препаратов.
Для выполнения практической части работы задания студент должен знать:
- Содержание общей статьи «Химические методы анализа. Общие реакции на подлинность» (ГФ XI, вып. I, стр. 159-165). - механизмы химических реакций, используемые в фармацевтическом анализе для установления подлинности неорганических лекарственных препаратов; - способы расчета массы препарата, необходимой для определения ионов, входящих в состав молекулы исследуемого лекарственного вещества.
В процессе выполнения задания студент должен уметь: - брать навеску на аптечных и аналитических весах; - работать с пипетками и бюретками; - проводить определение подлинности неорганических лекарственных препаратов; - рассчитывать массу препарата, необходимую для определения иона, входящего в состав вещества. - делать заключение о подлинности лекарственных веществ на основе проведенных химических реакций.
Литература
1. Государственная фармакопея СССР.- XI изд.- М,: Медицина, 1987.-Вып.1.-с. 159-165. Методические указания «Анализ неорганических лекарственных веществ по наличию катионов и анионов и органических лекарственных веществ по функциональным группам».
Задания для самостоятельной работы студентов Задание 1. Провести реакции подлинности на определяемые катионы и анионы, входящие в состав молекул неорганических лекарственных веществ. Вопросы для самоподготовки 1. С помощью каких химических реакций можно отличить галогенид-ионы друг от друга? 2. Растворы нитратов и нитритов дают одинаковый аналитический эффект с раствором дифениламина. С помощью какого реактива можно различить эти анионы? 3. Как отличить карбонат и гидрокарбонат-ионы? 4. По какой формуле можно рассчитать массу вещества, необходимую для проведения реакции на обнаружение определенного катиона или аниона? 5. С помощью каких реакций идентифицируют катионы натрия, калия, кальция, аммония, магния, цинка, висмута, железа (II), железа (III)? 6. Напишите механизмы реакций идентификации анионов: карбонат – и гидрокарбонат-ионов; нитрат- и нитрит-ионов; фосфат-, сульфат-, сульфит-, хлорид-, бромид- и иодид-ионов. Информационный блок Анализ неорганических веществ основан на взаимодействии отдельных ионов. Определенный катион с одним и тем же анионом дают одинаковый продукт реакции независимо от того, в составе какого соединения они были до реакции. Это свойство позволяетустановить подлинность катионов или анионов в различных неорганических лекарственных веществах похарактерным для них реакциям. Количество вещества, необходимое для определения иона рассчитывают по формуле:
Mr – молярная масса лекарственного вещества; F – минимальное содержание определяемого иона, г; Ar – атомная масса определяемого иона.
Например, для обнаружения иона натрия следует взять на анализ 1 мл раствора соли, содержащей 0,01-0,03 г иона натрия, подкислить разведенной уксусной кислотой, прибавить 0,5 мл раствора цинк-уранил-ацетата.
1. Рассчитываем содержание соли натрия, например, натрия хлорида в граммах:
2. Т.к. 0,025 г катиона натрия должно содержаться в 1 мл раствора, 0,25 г натрия хлорида растворяем в 10 мл воды очищенной. 3. К 1 мл полученного раствора, прибавляем 2-3 капли раствора кислоты уксусной разведенной и 0,5 мл раствора цинк-уранил-ацетата. Образуется желтый кристаллический осадок.
1. Определение иона натрия а) Отмеривают 1 мл 10%-ного раствора натрия сульфата, подкисляют разведенной уксусной кислотой, если необходимо, фильтруют, затем прибавляют 0,5 мл раствора цинк-уранил-ацетата; образуется желтый кристаллический осадок:
NaCl + Zn[(UO2)3(CH3COO)8] + CH3COOH+9H2O→ NaZn[(UO2)3(CH3COO)9]∙9H2O↓+HCl
б) Соль натрия, внесенная в бесцветное пламя, окрашивает его в желтый цвет.
2. Определение иона калия а) К 1 мл 10%-ного раствора калия иодида прибавляют 1 мл раствора винной кислоты, 1 мл раствора ацетата натрия, 0,5 мл спирта этилового 95% и встряхивают. Постепенно выпадает белый кристаллический осадок:
Осадок растворяется в разведенных минеральных кислотах и растворах едких щелочей.
б) К 1 мл 10%-ного раствора калия иодида прибавляют 0,5 мл разведенной уксусной кислоты, 0,5 мл раствора кобальтинитрита натрия; образуется желтый кристаллический осадок:
Na3[Co(NO2)6] + 2KCl → K2Na[Co(NO2)6]↓ + 2NaCl
в) Соль калия, внесенная в бесцветное пламя горелки окрашивает его в фиолетовый цвет.
3. Определение иона серебра а) К 1 мл 2%-ного раствора серебра нитрата прибавляют 2-3 капли разведенной хлористоводородной кислоты или раствора хлорида натрия; образуется белый творожистый осадок, нерастворимый в азотной кислоте, растворимый в растворе аммиака:
AgNO3 + NaCl → NaNO3 + AgCl↓ AgCl + 2NH4OH → [Ag(NH3)2]Cl + 2H2O
б) К 1 мл 2%-ного раствора серебра нитрата прибавляют раствор аммиака до растворения образующегося вначале осадка, затем 2-3 капли раствора формальдегида и нагревают. На стенках пробирки образуется блестящий налет металлического серебра:
2AgNO3 + 2NH4OH → Ag2O↓ + 2NH4NO3 + H2O CH2O + Ag2O → 2Ag↓ + HCOOH 4. Определение иона магния К 1 мл 5% раствора магния сульфата прибавляют 1 мл раствора хлорида аммония, 0,5 мл раствора гидрофосфата натрия и 1 мл раствора аммиака. Образуется белый кристаллический осадок, растворимый в уксусной кислоте: MgSO4 + Na2HPO4 + NH4OH 5. Определение иона кальция а) К 1 мл 5% раствора кальция хлорида добавляют 1 мл раствора оксалата аммония. Образуется белый осадок:
CaCl2 + (NH4)2C2O4 → CaC2O4↓ + 2NH4Cl
Осадок нерастворим в разведенной уксусной кислоте и растворе аммиака, но растворим в разведенных минеральных кислотах.
б) Соль кальция, смоченная хлористоводородной кислотой и внесенная в бесцветное пламя, окрашивает его в кирпично-красный цвет.
6. Определение иона цинка а) К 2 мл нейтрального 5%-ного раствора цинка сульфата прибавляют 0,5мл раствора сульфида натрия. Образуется белый осадок:
ZnSO4 + Na2S → ZnS ↓ + Na2SO4
Осадок нерастворим в разведенной уксусной кислоте, но легко растворим в разведенной хлористоводородной кислоте.
б) К 2 мл 5%-ного раствора цинка сульфата прибавляют 0,5 мл раствора гексацианоферрата (II) калия (ферроцианида калия); образуется белый студенистый осадок:
ZnSO4 + K4[Fe(CN)6] → ZnK2[Fe(CN)6] ↓ + K2SO4
Осадок нерастворим в разведенной хлористоводородной кислоте.
7. Определение иона аммония 1 мл 1 %-ного раствора аммония хлорида нагревают с 0,5 мл раствора гидроксида натрия. Выделяется аммиак, обнаруживаемый по запаху и по посинению влажной красной лакмусовой бумаги:
NH4Cl + NaOH → NH3 ↑ + H2O
8. Определение иона висмута а) Массу висмута нитрата основного (около 0,1 г) взбалтывают с 3 мл разведенной хлористоводородной кислоты и фильтруют. К фильтрату прибавляют 1 мл раствора сульфида натрия. Появляется коричнево-черный осадок:
2Bi(NO3)3 +3Na2S → Bi2S3↓ + 6NaNO3
Осадок растворим в равном объеме концентрированной азотной кислоты.
б) Массу висмута нитрата основного (около 0,1 г) взбалтывают с 5 мл разведенной серной кислоты и фильтруют. К фильтрату прибавляют 2 капли раствора иодида калия, выпадает черный осадок, растворимый в избытке реактива с образованием раствора желтовато-оранжевого цвета:
Bi(NO3)3 + 3KI → BiI3 ↓ + 3KNO3 BiI3 + KI → KBiI4
9. Определение иона железа (II) К 2 мл свежеприготовленного 5%-ногораствора железа (II) сульфата прибавляют раствор сульфида аммония. Образуется черный осадок:
FeSO4 + Na2S → FeS ↓ + Na2SO4
Осадок растворим в разведенных минеральных кислотах.
10. Определение иона железа (III) а) К 1 мл 3% раствора железа (III) хлорида прибавляют 5 мл воды, 0,5 мл разведенной хлористоводородной кислоты и 1-2 капли раствора гексацианоферрата (II) калия. Образуется синий осадок:
FeCl3 + K4[Fe(CN)6] → KFe[Fe(CN)6] ↓ + 3KCl
б) К 1 мл 3% раствора железа (III) хлорида прибавляют 5 мл воды, 0,5 мл разведенной хлористоводородной кислоты и 1-2 капли раствора тиоцианата аммония. Появляется красное окрашивание:
FeCl3 + 3NH4NCS → Fe(NCS)3 + 3NH4Cl
в) К 1 мл 3% раствора железа (III) хлорида прибавляют 5 мл воды и 2-3 капли раствора сульфида аммония. Образуется черный осадок:
2FeCl3 + 3(NH4)2S → Fe2S3 ↓ + 6NH4Cl Осадок растворим в разведенных минеральных кислотах. 11. Определение карбонат- (гидрокарбонат)-иона а) К 0,2 г натрия карбоната (гидрокарбоната) или к 2 мл 10% раствора натрия карбоната (гидрокарбоната) прибавляют 0,5 мл кислоты хлористоводородной разведенной. Выделяются пузырьки диоксида углерода. При пропускании их через известковую воду образуется белый осадок кальция карбоната:
Na2CO3 + 2HCl → 2NaCl + H2O + CO2↑ Ca(OH)2 + CO2 → CaCO3↓ + H2O
б) К 2 мл 10%-ного раствора натрия карбоната прибавляют 54 капли насыщенного раствора сульфата магния, образуется белый осадок (гидрокарбонат образует осадок только при кипячении смеси):
4Na2CO3 + 4MgSO4 + 4H2O → 3MgCO3∙ Mg (OH)2∙3H2O↓ + 4Na2SO4+ CO2↑
в) Раствор натрия карбоната 10%-ный при прибавлении 1 капли раствора фенолфталеина окрашивается в красный цвет (отличие от гидрокарбоната).
12. Определение нитрат-иона а) К 0,01 г натрия нитрата прибавляют несколько капельраствора дифениламина. Появляетсясинее окрашивание:
б) Натрия нитрат (около 0,005 г) не обесцвечивает раствор перманганата калия, подкисленный серной кислотой (отличие от нитритов).
в) К 0,005г натрия нитрата прибавляют по2-3 капли водыи концентрированной серной кислоты, кусочек металлической меди и нагревают. Выделяются бурые пары диоксида азота:
Cu + 2NaNO3 + 2H2SO4 → CuSO4 + 2NO2↑ + 2H2O + Na2SO4
13. Определение нитрит-иона а) К 0,002 г натрия нитрита прибавляют несколько капельраствора дифениламина. Появляетсясинее окрашивание:
б) К 1 мл 10%-ного раствора натрия нитрита прибавляют 1 мл разведенной серной кислоты. Выделяются желто-бурые пары (отличие от нитратов):
2NaNO2 + H2SO4 → NO↑ + NO2↑ + Na2SO4 + H2O
в) Несколько кристаллов антипирина растворяют в фарфоровой чашке в 2 капляхразведенной хлористоводородной кислоты, прибавляют 1 каплю 10%-ного раствора натрия нитрита. Появляется зеленое окрашивание (отличие от нитратов):

14. Определение фосфат-иона а) К 2 мл нейтрального 5%-ного раствора натрия фосфата двузамещенного прибавляют несколько капель раствора нитрата серебра. Образуется желтый осадок, растворимый в разведенной азотной кислоте и растворе аммиака.
3AgNO3 + Na2HPO4 → Ag3PO4↓ + 2NaNO3 + HNO3
б) К 2 мл 5%-ного раствора натрия фосфата двузамещенного в разведенной азотной кислоте прибавляют 2 мл раствора молибдата аммония и нагревают. Образуется желтый кристаллический осадок, растворимый в растворе аммиака.
H3PO4 + 21 HNO3 + 12(NH4)2MoO4 → (NH4)3PO4∙12MoO3↓ + 21NH4NO3 + 12H2O
15. Определение хлорид-иона К 2 мл 0,5% раствора натрия хлорида прибавляют 0,5 мл разведенной азотной кислоты и 0,5 мл раствора нитрата серебра. Образуется белый творожистый осадок, растворимый в растворе аммиака. При испытании подлинности гидрохлоридов органических оснований растворимость образовавшегося осадка хлорида серебра устанавливают после отфильтровывания и промывания его водой.
AgNO3 + NaCl → NaNO3 + AgCl↓ AgCl + 2NH4OH → [Ag(NH3)2]Cl + 2H2O
16. Определение бромид-иона а) К 1 мл 1% -ного раствора калия бромида прибавляют 1 мл разведенной хлористоводородной кислоты, 0,5 мл раствора хлорамина, 1 мл хлороформа и взбалтывают. Хлороформный слой окрашивается в желто-бурый цвет:
б) К 1 мл 1%-ного раствора калия бромида, подкисленного азотной кислотой, прибавляют несколько капель раствора нитрата серебра. Образуется желтоватый осадок, мало растворимый в растворе аммиака:
AgNO3 + NaBr → NaNO3 + AgBr↓ AgBr + 2NH4OH → [Ag(NH3)2]Br + 2H2O
17. Определение йодид-иона а) К 2 мл 1%-ного раствора калия йодида прибавляют 0,2 мл разведенной серной кислоты, 0,2 мл раствора нитрита натрия или раствора хлорида железа (III) и 2 мл хлороформа. При взбалтывании хлороформный слой окрашивается в фиолетовый цвет:
2NaNO2 + 2KI + 2H2SO4 → I2 ↓ + 2NO↑ + K2SO4 + Na2SO4 + 2H2O
б) К 2 мл 1%-ного раствора калия иодида прибавляют 0,5 мл азотной кислоты и 0,5 мл раствора нитрата серебра. Образуется желтый творожистый осадок: 8HI + H2SO4 → 4I2↑ + H2S↑ + 4H2O
Анионы органических кислот Ацетат ион а) 2 мл 2% раствора калия ацетата нагревают с равным объемом концентрированной серной кислоты и 0,5 мл спирта этилового 95%. Ощущается запах этилацетата: 2CH3COOK + 2C2H5OH + H2SO4 → 2CH3COOC2H5 ↑ + 2H2O + K2SO4
б) К 2 мл нейтрального 2% раствора калия ацетата прибавляют 0,2 мл раствора хлорида железа (III). Появляется красно-бурое окрашивание, исчезающее при прибавлении разведенных минеральных кислот:
9CH3COOK+3FeCl3 + 2H2O → [(CH3COO)6∙Fe3(OH)2] + CH3COO - + 9KCl + 2CH3COOH Бензоат-ион К 2 мл нейтрального 1%-ного раствора натрия бензоата прибавляют 0,2 мл раствора хлорида железа (III). Образуется осадок розовато-желтого цвета, растворимый в эфире:
Салицилат-ион К 2 мл нейтрального 0,5% раствора натрия салицилата прибавляют 2 капли раствора хлорида железа (III); появляется сине-фиолетовое или красно-фиолетовое окрашивание:
Окраска сохраняется при добавлении небольшого объема уксусной кислоты, но исчезает при добавлении разведенной хлористоводородной кислоты. При этом выделяется белый кристаллический осадок салициловой кислоты.
Тартрат-ион а) К 1 мл свежеприготовленного 2%-ного раствора винной кислоты прибавляют кристаллик калия хлорида, 0,5 мл спирта этилового 95% и потирают стеклянной палочкой о стенки пробирки. Выделяется белый кристаллический осадок, растворимый в разведенных кислотах и растворах едких щелочей:
б) 0,25 мл свежеприготовленного 2%-ного раствора винной кислоты нагревают с 1 мл концентрированной серной кислоты и несколькими кристаллами резорцина; через 15-30 сек появляется вишнево-красное окрашивание.
Цитрат-ион а) К 1 мл нейтрального1%-ного раствора натрия цитрата прибавляют 1 мл раствора хлорида кальция; раствор остаеься прозрачным. При последующем кипячении появляется белый осадок, растворимый в хлористоводородной кислоте:
Результаты проведенных исследований студент оформляет в виде протокола, образец которого приведен ниже:
дата. Протокол анализа неорганических лекарственных веществ и анионов органических кислот
Лабораторная работа №2 Введение Методические указания «Анализ органических лекарственных веществ по функциональным группам» предназначены для самостоятельной работы студентов III курса фармацевтического факультета. Чтобы подтвердить принадлежность лекарственного вещества к той или иной химической группе, необходимо умение обнаруживать присутствие в его молекуле определенной функциональной группы и подтверждать ее присутствие. Такой вид анализа называется функциональным.
Цель работы - приобретение практических умений и навыков в анализе органические лекарственные вещества по функциональным группам.
2.1. Целевые задачи: - освоение теоретических знаний по теме: «Анализ органических лекарственных веществ по функциональным группам»; - формирование умений самостоятельной работы при подтверждении наличия в молекуле лекарственного вещества той или иной функциональной группы.
2.2. В процессе выполнения задания студент должен знать: - общие закономерности качественного анализа органических лекарственных веществ по функциональным группам; - механизмы химических реакций, происходящих при идентификации функциональных групп в молекулах лекарственных веществ.
2.3. В процессе выполнения занятия студент должен уметь: - выполнять методики анализа органических лекарственных веществ по функциональным группам; - делать заключение о присутствии той или иной функциональной группы в молекуле лекарственного вещества; - писать уравнения химических реакций, происходящих при обнаружении или подтверждении наличия функциональных групп в молекулах органических лекарственных веществ.
3. Самостоятельная внеаудиторная работа студентов по подготовке к выполнению лабораторной работы 3.1. Задание для самоподготовки Студенту необходимо знать: - названия и строение функциональных групп; - механизмы реакций, с помощью которых можно подтвердить наличие той или иной функциональной группы в органическом лекарственном веществе; - особенности проведения реакций идентификации органических лекарственных веществ по функциональным группам. Литература 1. Беликов В.Г. Фармацевтическая химия. В 2 ч.: Ч.1. Общая фармацевтическая химия; Ч. 2. Специальная фармацевтическая химия: Учеб. для вузов. – Пятигорск, 2003.- 720 с. 2. Государственная фармакопея СССР: Общие методы анализа. – 11-е изд., доп. / МЗ СССР. – Вып. 1. – М.: Медицина, 1987. – 336 с. 3. Государственная фармакопея СССР. – 10-е изд. – М.: Медицина, 1968. – 1079 с. 4. Лабораторные работы по фармацевтической химии /Под ред. проф. В.Г.Беликова. – М.: Высш.шк., 1989. – 375 с. 5. Лабораторные работы по фармацевтической химии: Учебное пособие / Беликов В.Г., Вергейчик Е.Н., Компанцева Е.В., Куль И.Я., Лукьянчикова Г.И., Саушкина А.С., Тираспольская С.Г./ под ред. Е.Н.Вергейчика, Е.В.Компанцевой.- 2-е изд., перераб. и доп. – Пятигорск, 2003. – с.342. 6. Мелентьева Г.А., Цуркан А.А., Гулимова Т.Е. Анализ фармакопейных препаратов по функциональным группам (Методические разработки для самостоятельной подготовки студентов). – I – IV, Рязань, 1981. 7. Методы анализа лекарств /Максютина Н.П., Каган Ф.Е., Митченко Ф.А. – Киев: Здоров^я, 1984. – 224 с. 8. Руководство к лабораторным занятиям по фармацевтической химии / Под ред. П.С.Сенова. – М.: Медицина, 1978. – 360 с. 9. Руководство к лабораторным занятиям по фармацевтической химии: Учеб. пособие /Аксенова Э.Н., Андрианова О.П., Арзамасцев А.П. и др. / Под ред. А.П.Арзамасцева. – 3-е изд., перераб. и доп. – М.: Медицина, 2001. – 384 с. 10. Фармацевтический анализ по функциональным группам (Методические указания для студентов очного факультета). – Пермь, 1991. – 42 с.
Информационный блок
Органические лекарственные средства идентифицируются, как правило, по функциональным группам и структурным фрагментам молекул. Функциональные группы – это группы атомов, которые отличаются высокой реакционной способностью и легко взаимодействуют с различными реактивами со специфическим аналитическим эффектом (цвет, запах, осадок, выделение газа и т.д.). Структурный фрагмент – это часть молекулы лекарственного вещества, которая взаимодействует с реактивом с заметным аналитическим эффектом.
Функциональные группы
5.1.1. Содержащие кислород:
а) гидроксильная группа (спиртовый и фенольный гидроксилы):
б) альдегидная группа:
в) кетонная группа:
г) гидроксиацетильная группа (α-кетольная группа):
д) карбоксильная группа:
е) сложноэфирная группа и лактонная группа:
ж) простая эфирная группа:
5.1.2. Содержащие азот: а) первичная ароматическая и алифатическая аминогруппы:
б) вторичная аминогруппа:
в) третичная аминогруппа:
г) амидная группа:
д) азометиновая группа:
е) гидразидная группа:
ж) нитрогруппа:
5.1.3. Содержащие серу: а) тиольная группа (сульфгидрильная группа):
б) сульфамидная группа:
в) органически связанная сера:
5.1.4. Содержащие галоген: а) органически связанный галоген:
5.2. Структурные фрагменты: 5.2.1. Двойная связь:
5.2.2. Фенильный радикал:
Спирт Этилацетат Реакции окисления Спирты окисляются до альдегидов при добавлении окислителей (калия дихромата, калия гексацианоферрата (III), реактива Фреде, иода). Спирт этиловый окисляется иодом в щелочной среде при нагревании до трийодацетальдегида, который разрушается до йодоформа и соли кислоты муравьиной (первичные спирты):

Методика: 0,5 мл спирта этилового 95% смешивают с 5 мл раствора натрия гидроксида, прибавляют 2 мл 0,1 М раствора йода – постепенно выпадает желтый осадок йодоформа, который обнаруживают также по характерному запаху.
6.3. Реакции образования комплексных соединений (многоатомные спирты)
Многоатомные спирты (глицерин и др.) образуют с раствором меди сульфатом в щелочной среде комплексные соединения синего цвета:
Цвета Методика: к 5 мл 5% раствора меди сульфата прибавляют 1 – 2 мл раствора натрия гидроксида до образования осадка меди (II) гидроксида. Затем прибавляют раствор глицерина до растворения осадка. Раствор окрашивается в интенсивный синий цвет.
Сочетание с солями диазония
Фенолы в щелочной и аммиачной среде взаимодействуют с солями диазония с образованием азокрасителя (красное окрашивание):
Резорцин белый осадок
Желтое окрашивание Методика: К 1 мл раствора вещества (фенол, резорцин, тимол, хинозол) прибавляют по каплям бромную воду, Образуется белый осадок. При добавлении 1-2 мл кислоты азотной разведенной постепенно появляется желтое окрашивание.
Красный осадок Методика: К 1 мл раствора альдегида (раствор формальдегида, хлоралгидрат, гексаметилентетрамин, глюкоза), содержащего 0,01-0,02 г вещества, прибавляют 2 мл реактива Фелинга, нагревают до кипения. Выделяется кирпично-красный осадок оксида меди (I).
в ). реакция с реактивом Несслера:
Черный осадок Методика: К 2-3 каплям раствора альдегида (раствор формальдегида, 3% раствора гексаметилентетрамина, 10% раствора глюкозы) прибавляют 2-3 капли реактива Несслера и нагревают. Выделяется серовато-черный осадок металлической ртути.
Реакции конденсации а). Альдегиды в среде кислоты серной концентрированной конденсируются с фенолами (см. методику 5.5.3), образуются окрашенные хиноны. Ниже приводится уравнение химической реакции с хромотроповой кислотой (реактив на альдегиды). Появляется фиолетовое окрашивание:
б). Кроме фенолов с альдегидами конденсируются первичные ароматические амины (образуются основания Шиффа) и гидразины (в виде осадка или окрашенного продукта). Тип реакции – нуклеофильное замещение:
Методика: К 1 мл раствора альдегида прибавляют 1 мл щелочного раствора гидроксиламина гидрохлорида. Постепенно выпадает осадок оксима.
Идентификация кето-группы.

Методика: 0,1 г лекарственного вещества (камфора, бромкамфора, тестостерон) растворяют в 3 мл спирта этилового 95%, прибавляют 1 мл раствора 2,4-динитрофенилгидразина или щелочного раствора гидроксиламина. Наблюдается появление осадка или окрашенного раствора.
Кислота ацетилсалициловая
Кислота уксусная
Кислота салициловая (белый осадок)
Фиолетовое окрашивание Гидроксамовая проба Реакция основана на щелочном гидролизе сложного эфира. При гидролизе в щелочной среде в присутствии гидроксиламина гидрохлорида образуются гидроксамовые кислоты, которые с солями Fe (III) дают гидроксаматы железа красного или красно-фиолетового цвета. Гидроксаматы меди (II) – осадки зеленого цвета.
Гидроксиламина гидрохлорид
Гидроксамат железа (III)
Гидроксамат железа (III)
Методика: 0,02 г вещества (кислота ацетилсалициловая, новокаин, анестезин и др.) растворяют в 3 мл спирта этилового 95%, прибавляют 1 мл щелочного раствора гидроксиламина, встряхивают, нагревают на кипящей водяной бане в течение 5 минут. Затем добавляют 2 мл кислоты хлористоводородной разведенной, 0.5 мл 10 % раствора железа окисного хлорида в 0.1 моль/л растворе кислоты хлористоводородной. Появляется красное или красно-фиолетовое окрашивание.
Обнаружение лактонов
Методика: 0,02 г вещества (кислота ацетилсалициловая, новокаин, анестезин и др.) растворяют в 3 мл спирта этилового 95%, прибавляют 1 мл щелочного раствора гидроксиламина, встряхивают, нагревают на кипящей водяной бане в течение 5 минут. Затем добавляют 2 мл кислоты хлористоводородной разведенной, 0.5 мл 10 % раствора железа окисного хлорида в 0.1 моль/л растворе кислоты хлористоводородной. Появляется красное или красно-фиолетовое окрашивание
Димедрол Методика: На часовое стекло или фарфоровую чашку наносят 3-4- капли кислоты серной концентрированной и прибавляют 0,05 г лекарственного вещества (димедрола и др.), появляется желто-оранжевое окрашивание, постепенно переходящее в кирпично-красное. При добавлении воды окраска исчезает.
Реакции окисления Первичные ароматические амины легко окисляются даже кислородом воздуха, образуя окрашенные продукты окисления. В качестве окислителей используются также хлорная известь, хлорамин, перекись водорода, железа (III) хлорид, калия дихромат и др.:
Методика: 0,05-0,1 г вещества (стрептоцид, анестезин, новокаин и др) растворяют в 1 мл раствора натрия гидроксида. К полученному раствору добавляют 6-8 капель хлорамина и 6 капель 1% раствора фенола. По мере нагревания на кипящей водяной бане появляется окрашивание (синее, сине-зеленое, желто-зеленое, желтое, желто-оранжевое).
Нингидриновая проба Первичные алифатические амины окисляются нингидрином при нагревании:
Методика: 0,02 г вещества (кислота глутаминовая, кислота аминокапроновая, и др. аминокислоты и первичные алифатические амины) растворяют при нагревании в 1 мл воды, прибавляют 5 – 6 капель раствора нингидрина и нагревают, появляется фиолетовое окрашивание.
Щелочной гидролиз Лекарственные препараты, содержащие амидную группу R-CO-NH2 (никотинамид) и N-замещенную амидную группу R-CO-NH-R1 (парацетамол, фтивазид, фталазол, барбитураты, пуриновые алкалоиды, диэтиламид никотиновой кислоты и др.) при нагревании в щелочной среде гидролизуются с образованием аммиака или аминов и соли кислот:
Методика: 0,1 г вещества взбалтывают в воде, прибавляют 0,5 мл 1 М раствора натрия гидроксида и нагревают. Ощущается запах выделяющегося аммиака или амина.
19.2. Реакция образования комплексных солей с металлами Соединения, содержащие амидную группу, с солями тяжелых металлов (COCl2, CuSO4) образуют окрашенные в различные цвета осадки комплексных солей.
Методика: Около 0,1 г вещества (барбитурата, теофиллина, изониазида) взбалтывают в течение 1 минуты с 2 мл 0,1 М раствора натрия гидроксида, фильтруют, к фильтрату прибавляют 1 мл воды, жидкость делят на 2 части: к одной прибавляют 5 капель раствора кобальта хлорида, к другой – 5 капель раствора меди сульфата. Появляется окрашивание или окра
|
|||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-23; просмотров: 1019; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.21.231.245 (0.322 с.) |



 MgNH4PO4↓ + Na2SO4 + H2O
MgNH4PO4↓ + Na2SO4 + H2O



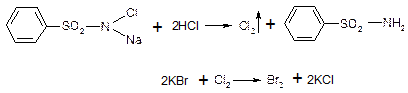




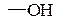












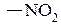



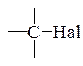














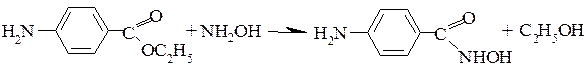
 Лактонная группа – это внутренний сложный эфир. Лактонную группу можно определить с помощью гидроксамовой пробы:
Лактонная группа – это внутренний сложный эфир. Лактонную группу можно определить с помощью гидроксамовой пробы:






