
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Гницевич В.А., Стиборовский С.Е.Стр 1 из 13Следующая ⇒
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ УКРАИНЫ ДОНЕЦКИЙ НАЦИОНАЛЬНЫЙ УНИВЕРСИТЕТ ЭКОНОМИКИ И ТОРГОВЛИ имени Михаила Туган-Барановского Кафедра технологии питания Гницевич В.А., Стиборовский С.Е. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ПИЩЕВЫХ ПРОИЗВОДСТВ Курс лекций для студентов специальности 6.091711 “Технология питания”
Донецк 2010 ЗМІСТ МОДУЛЮ
МОДУЛЬ 1. Змістовий модуль 1. Загальна характеристика харчових виробництв. Білки та жири в технологіях харчових виробництв Лекция 1 СИСТЕМАТИЗАЦИЯ СОСТАВНЫХ ЧАСТЕЙ ПРОДУКТОВ ПИТАНИЯ Питание является необходимой физиологической потребностью организма, так как обеспечивает организм энергией для построения тканей и клеток, является источником или основой образования ферментов, гормонов и других регуляторов метаболизма. Характер питания во многом обеспечивает состояние организма человека. Питание – достаточно сложный процесс потребления, переваривания и усваивания пищи. Но поскольку любому процессу потребления предшествует технологический процесс переработки продукта, то понятно, почему важно сделать его обоснованным.
Пища – это сложная смесь приготовленных к потреблению продуктов. Для того, чтоб узнать как усваивается пища, необходимо определить ее составные части и их роль в технологическом процессе. С точки зрения технологии в составе пищи выделяют пищевые и не пищевые (второстепенные) вещества. Пища главным образом состоит из продуктов животного и растительного происхождения, так как вода из-за ее широкого распространения, в понятие пищи не входит. Главную часть пищевых продуктов составляют так называемые питательные вещества: белки, жиры, углеводы, минеральные вещества, витамины и вода. Они играют ведущую роль в питании, хотя структурный состав продуктов питания более разнообразен и дополняется другой группой пищевых веществ – вкусовыми веществами (ароматические вещества, красители, пищевые волокна). Зачем они нужны? Если основные питательные вещества не имеют выраженных вкуса, запаха и цвета, то вкусовые вещества обеспечивают органолептические показатели продукта, что немаловажно, так как преимущество всегда отдается продуктам с приятным цветом, вкусом и запахом. Таким образом, основные питательные вещества и вкусовые вещества составляют в сумме пищевые вещества. Что касается их необходимости, то белки, некоторые жиры (вернее жирные кислоты), витамины, вода, минеральные вещества относятся к безусловно необходимым, т. к. в организме человека не синтезируются. Углеводы и некоторые жиры принадлежат к заменимым пищевым веществам. Кроме заменимых и незаменимых выделяют также посторонние вещества, которые возникают либо под влиянием технологического процесса или неоптимального хранения, либо появляются в продукте из окружающей среды или содержатся в пищевых продуктах как их составная часть. Каждая из представленных групп веществ должна быть объектом контроля различных служб. Можно сделать вывод, что любой технологический процесс должен усиливать действие полезных веществ и сводить к минимуму влияние веществ, имеющих неблагоприятный характер. Потому инженеру технологу необходимо так построить технологический процесс, чтоб эффективность питания была максимальной при влиянии негативных факторов. Для этого необходимо знать про роль отдельных составных частей продуктов и факторы, которые на них влияют. Но знать систематизацию веществ по составу недостаточно, так как они по-разному используются в организме. Необходимо знать и роль отдельных веществ в покрытии потребностей организма.
С этой точки зрения пищевые вещества делятся на 3 группы: ã вещества преимущественно энергетического направления (жиры, углеводы, некоторые белковые вещества, спирт, органические кислоты). ã вещества преимущественно для пластических нужд (белки, жиры, углеводы, кальций, фосфор, железо). ã вещества, используемые как катализаторы или материал для образования ферментов. Если провести детальный анализ всех пищевых веществ по степени их необходимости, то нужно отметить, что пищевой рацион человека должен включать порядка 46 соединений: ã 8 незаменимых аминокислот; ã 3 жирные аминокислоты; ã 16 жиро- и водорастворимых витаминов; ã 15 минералов и воду. В свете вышеизложенного становится очевидной роль инженера технолога: максимальное обеспечение организма человека незаменимыми нутриентами, что возможно только при глубоких знаниях сущности технологических процессов. Лекция 2 Лекция 3 ГИДРАТАЦИЯ, ДЕГИДРАТАЦИЯ, ДЕНАТУРАЦИЯ И ДЕСТРУКЦИЯ БЕЛКОВ ПИЩЕВЫХ ПРОДУКТОВ
Изменение белков пищевых продуктов при производстве полуфабрикатов и блюд, в значительной мере определяет выход изделий, структурно-механические свойства, органолептические показатели и т.д. Глубина и степень этих изменений зависит от природных свойств белков, характера внешнего воздействия, коллоидного состояния белков и т. д. Наиболее значительные изменения белков пищевых продуктов связаны с их гидратацией, дегидратацией, денатурацией и деструкцией.
На поверхности белковой молекулы имеются полярные группы, которые при контакте с водой адсорбируют ее вокруг полярных групп белка, эта вода прочно удерживается белком и называется адсорбционной. Адсорбционная вода удерживается белками достаточно прочно и не может служить растворителем для других веществ. При низком содержании белка в растворе, их молекулы полностью гидратированы (например, молоко, тесто, омлеты и др.). В концентрированных белковых растворах при дополнительном добавлении воды происходит гидратация белков (добавление воды к измельченному мясу в определенных количествах). В студнях молекулы белка удерживают много воды вследствие образованной гидратной сетки из белковых молекул и тяжей, но количество воды строго определенно для каждого вида белка. Чем длиннее и тоньше молекула белка, тем меньше концентрация его для образования студня, поэтому большинство студней обводнены больше, чем концентрированные растворы, это явление используется при варке студней из частей туш с максимальным содержанием соединительной ткани. При производстве полуфабрикатов во время смешивания компонентов процесс гидратации складывается из растворения и набухания. При этом мягкость изделий повышается, они лучше формуются, улучшается сочность, консистенция, вкус готового изделия (котлетная масса).
Сухие белки муки, крупы, бобовых, которые содержатся в них в виде высохшей цитоплазмы и алейроновых зерен, при контакте с водой набухают, образуя сплошной более или менее обводненный студень. Кроме того, нужно помнить, что в пищевых продуктах кроме адсорбционно-связанной белками воды, имеется вода осмотически и капиллярно связанная, которая также может оказать существенное влияние на качество кулинарной продукции. При гидратации белковых веществ различают ограниченное и неограниченное набухание. Неограниченное - приводит к образованию растворов (молекулы белка отрываются друг от друга и переходят в раствор). Ограниченное - не заканчивается растворением. Набухание белков в процессе гидратации имеет выборочный характер относительно растворителя (необходимо вспомнить классификацию белков относительно растворителя). Так как белки имеют полярные группы, то набухают они в полярных растворителях - вода, спирты. На степень и кинетику набухания белков в растворителях влияют: ã температура; ã давление; ã величина рН среды; ã наличие электролитов и их концентрация; ã степень измельчения; ã "возраст" полимера. Минимальное набухание наблюдается в изоэлектрической точке, так как заряд белковой молекулы минимален. При сдвиге рН среды в ту или иную сторону от изоэлектрической точки усиливается диссоциация основных или кислотных групп белка, увеличивается заряд белковой молекулы и усиливается гидратация белка. В технологической практике это используется для усиления их водосвязывающей способности (маринование мяса). Различают ионную и молекулярную адсорбцию, что связано с наличием в белке свободных и связанных полярных групп. Свободные полярные группы (аминогруппы, карбоксильные группы дикарбоновых кислот) диссоциируют в растворе, определяя величину суммарного заряда молекулы. Адсорбирование воды ионизированными свободными полярными группами белка называется ионной адсорбцией. Эта величина может быть изменена изменением рН среды. Связанные (пептидные группы полипептидных цепей, гидроксильные, сульфгидрильные и др.) присоединяют воду за счет молекулярной адсорбции, которая является постоянной величиной.
Растворимость - один из основных, самых важных показателей функциональности белков и технологических свойств белоксодержащих продуктов. Еще одним свойством является способность белка растворяться под воздействием технологических факторов. То есть возникают ситуации, когда способный к растворению белок находится в условиях плохой растворимости и наоборот. Таким образом, показатель растворимости может корригироваться параметрами технологического процесса. Нельзя объединять понятия растворимости и гидратации. Хотя направление обоих процессов одинаково, они по сути разные. Белковая система, состоящая из нерастворимых белков, вполне может быть гидратирована, то есть, перемешена с водой, которая будет удерживаться благодаря силам физической природы. Но при этом белки будут нерастворимы. Изменением рН или введением электролитов гидратированный белок можно перевести в растворимое состояние. Белки способны к набуханию с образованием высокогидратированных систем, а также образовывать истинные, высокомолекулярные и коллоидные растворы. Растворимость белковых систем зависит: ã от степени измельчения фазы (молекулярной массы белка); ã характера связи фазы с дисперсной средой; ã характера самой жидкой среды.
Дегидратация – это потеря белками воды. В технологической практике различают обратимую и необратимую дегидратацию. Обратимая дегидратация —наблюдается при сублимационной сушке. При последующем замачивании гидратная оболочка практически полностью восстанавливается. При сублимационной сушке улетучивается из продуктов капиллярно связанная, осмотическая и большая часть адсорбционно связанной белками воды. Адсорбционно связанная вода удаляется не полностью, поскольку мономолекулярный слой ее на поверхности белковой молекулы очень прочно связан с белком. Эта вода (гидратная) удаляется только при температуре +100°С и выше, что приводит к денатурации белка. Ее количество достигает 5% от массы сухих белков. Необратимая дегидратация (невозможно восстановить первоначальные свойства продукта) —происходит при размораживании мяса, рыбы и тепловой обработке продуктов. При быстром размораживании мяса происходит неполное восстановление белковых коллоидных систем, нарушенных в период замораживания. При замораживании и последующем хранении рыбы происходит денатурация белков, поэтому рыбу оттаивают быстро в воде, так как нативная структура ее белков не восстанавливается. При воздействии тепла происходит необратимая денатурация белков с выделением воды вместе с растворенными в ней веществами, что снижает массу изделий, изменяет ее пищевую ценность и органолептические показатели. Дегидратация — процесс, противоположный гидратации, то есть это процесс выделения влаги из продукта. Это очень важный технологический процесс, который обеспечивает органолептические показатели белоксодержащих изделий и функциональную активность белковых веществ.
Необратимая дегидратация, как правило, сопровождается денатурацией белков. Дегидратация может быть целенаправленной, согласно хода технологического процесса, а также результатом влияния различных неблагоприятных факторов, последствием которых является потеря функциональных свойств белков, например растворимости или влагоудерживающей способности. Так как причинами денатурации является действие тепла, химических веществ, механическое воздействие, течение времени, облучение, то эти же факторы являются и причинами дегидратации. В реальных технологических процессах невозможно точно установить причинно-следственную взаимосвязь денатурации, дегидратации и изменение коллоидного состояния, так как эти процессы идут одновременно и характеризуют технологический процесс с разных сторон. Одним из факторов дегидратации есть денатурация белков, в результате чего изменяется их агрегатное состояние. Поэтому главным признаком дегидратации есть переходы коллоидного состояния белковых веществ: золь – гель гель I рода – гель II рода раствор – флокулят Относительно технологии общественного питания эти переходы воспринимаются как изменение консистенции пищевых продуктов. Типичным примером целенаправленной дегидратации является получение творога из молока, когда повышение концентрации Н Причиной дегидратации могут быть денатурационные изменения под влиянием тепловой энергии. В технологии большинство процессов основано на эффекте тепловой денатурации белковых веществ и, как следствие, необратимой дегидратации. Одновременно процессы денатурации, коагуляции и агрегации приводят к дегидратации белковых систем. Например, приготовление прозрачных бульонов. Важная роль в дегидратации принадлежит реакции среды. Одни и те же белки при разных значениях рН имеют разную устойчивость к дегидратации. В изоэлектрической точке (ИЗТ) белки находятся в минимальной степени гидратации, способность их удерживать воду наименьшая. Поэтому факторы, вызывающие дегидратацию в ИЗТ действуют с максимальным эффектом. Это свойство широко используется при получении изолированных белков, белковых концентратов — изменяя рН, добиваются максимальной растворимости белков, переводят их в раствор, затем сепарируют, отделяя нерастворимые частицы, потом подтитровывают до значения ИЗТ, когда он выпадает в осадок, который отцеживают. Частичной дегидратацией белков объясняется и потеря мясного и рыбного сока замороженными продуктами в процессе размораживания. На методе дегидратации базируется производство консервированных продуктов и полуфабрикатов. Посол — приводит к обезвоживанию и повышению части связанной воды, а следовательно к уменьшению количества микроорганизмов. Дегидратация белков происходит при всех видах сушки, а также при биохимических, осмотических и ферментативных процессах — в период посмертного окоченения.
Денатурацией называется изменение нативной пространственной структуры белковой молекулы под влиянием внешних факторов Виды денатурации: ã тепловая; ã механическая (взбивание, встряхивание); ã кислотная или щелочная (при сушке и замораживании). Тепловая денатурация — разрушаются поперечные связи между боковыми цепями, поэтому изменяется конформация полипептидных цепей в белковой молекуле. У глобулярных белков развертываются глобулы и свертываются по новому образцу. Но прочные пептидные и дисульфидные (ковалентные) связи сохраняются. Фибрилярный белок коллаген при тепловой денатурации плавится, так как поперечные связи между полипептидными цепями исчезают и образуется стекловидная масса. Тепловая денатурация белка возможна при наличии воды, кристаллический белок даже при температуре 100°С устойчив к денатурации. Чем выше гидратация белка и ниже его концентрация, тем скорее он денатурирует. Денатурированный белок: 1) теряет биологическую активность; 2) теряет способность к гидратации (растворению и набуханию); 3) улучшается его атакуемость ферментами; 4) повышается реакционная способность; 5) изменяются физические свойства; Снижение гидратации объясняется конформацией глобулы и появлением на поверхности гидрофобных групп вместо гидрофильных. В нативном белке пептидные связи и многие функциональные группы экранированы гидратной оболочкой и находятся внутри глобулы, после тепловой денатурации улучшается гидролиз белка под воздействием протеолитических ферментов и также чувствительность к химическим реактивам. В мало концентрированных белковых растворах при тепловой денатурации молекулы образуют агрегаты за счет дисульфидных и водородных связей – получаются крупные частицы, которые при дальнейшей агрегации расслаивают коллоидную систему и образуются хлопья (бульоны, молоко). В более концентрированных белковых растворах при тепловой денатурации образуется сплошной гель, удерживающий всю воду (мясо, рыба, яйцо). Обводненные гели при денатурации уплотняются и происходит дегидратация (снижение объема, повышение прочности и так далее). Изменение белковых гелей в сильной степени зависит от рН среды, температура. Чаще всего создание кислой среды снижает дегидратацию белковых молекул и повышает сочность изделий, нежность. Более высокая температура и продолжительное нагревание усиливает денатурацию. Необходимо знать температурный верхний предел стабильности белков, чтобы не вызвать денатурации (при приготовлении яично-молочного льезона, горячий способ приготовления бисквита). Наиболее термостабильны белки молока и яиц, наименее – мяса и рыбы. Некоторые вещества повышают температуру денатурации белков (сахароза). Так, белок куриного яйца денатурирует при t = 55°С, меланж – при 70°С, а меланж с сахаром – при 80-83°С. Иногда при тепловой денатурации не наблюдается видимых изменений белкового раствора, чаще всего это у белков, содержащихся в связанном состоянии в продуктах. Пищевые продукты, доведенные таким образом до готовности, всегда содержат некоторое количество нативного белка.
Другие типы денатурации. При взбивании яичных белков для бисквита, взбивании сливок, происходит образование пены. Это поверхностная денатурация. Образующаяся пена состоит из пузырьков воздуха, окруженных тонкими белковыми пленками. Образование этих пленок сопровождается развертыванием полипептидных цепей белковых молекул. Таким образом, при взбивании происходит частичная или полная денатурация белка. В кулинарной практике мы встречаемся и с кислотной денатурацией, которая имеет место при мариновании мяса, скисании молока.
Многие белоксодержащие продукты при кулинарной обработке, нагревают еще некоторое время после того, как произойдет денатурация и свертывание. При продолжительном нагревании наблюдаются еще более глубокие постденатурационные изменения. Гели уплотняются еще более, происходят химические изменения основных молекул, в результате чего выделяются вещества: сероводород H Расщепляются пептидные связи. При этом происходит деполимеризация молекул с образованием водорастворимых азотистых веществ небелкового характера. Этот процесс называется деструкцией белков. Классическим примером деструкции белков является переход коллагена в глютин. Деструкция белков - нагревание денатурированного белка свыше 100°С в течение времени. Процесс деструкции происходит в несколько этапов. 1) отщепляются функциональные группы с образованием летучих веществ (аммиак, сероводород, углекислый газ, фосфористый водород и др.); 2) накапливаясь в продукте, эти вещества участвуют в образовании вкуса и аромата пищи; 3) при длительном гидротермическом воздействии белки гидролизуются с расщеплением пептидных связей (переход коллагена в глютин, разрушение внутримолекулярных связей протеолитическими ферментами в тесте, изменение ферментных препаратов для размягчения жесткого мяса, белковых гидролизатов).
Удерживая большое количество воды, гидрофильные белки набухают и образуют так называемые студни и гели. В пищевых продуктах белки находятся в состоянии золей или гелей. Концентрация белка в золях различных продуктов может колебаться от десятых долей процента до 10-15%. Значительное колебание концентрации наблюдается и в белковых гелях. Следствием тепловой денатурации белков является изменение их коллоидного состояния, которое называется свертыванием. Свертывание – общий термин, иначе – уплотнение. Денатурация и свертывание не одно и то же. Можно вызвать денатурацию, не добившись свертывания. Например: 1) Нагреем яичный белок, при этом он свертывается. 2) Если белок немного подсушить и нагреть, он денатурирует, но не свертывается, а при нейтрализации среды выпадает осадок. Происходит так потому, что это не истинный раствор, а взвеси в воде нерастворимого в жидкой среде вещества (денатурированного белка). Существует три типа свертывания: 1) Нативный белок в состоянии разбавленного золя в результате тепловой денатурации коагулирует с образованием хлопьев (при варке мяса образуется пена на поверхности бульона). 2) Нативный белок в состоянии концентрированного золя в растворе в результате тепловой денатурации коагулирует и превращается в гель. При нагревании неразбавленного яйца масса уплотняется, сохраняет форму. При длительном нагревании гель уплотняется, скорость постденатурационной коагуляции золя зависит от величины их pH. Нативный белок в состоянии геля в результате тепловой денатурации свертывается, т.е. уплотняется, выпрессовывая часть содержащейся в белках жидкости. ã при производстве творога; ã при варке мяса. В практике предприятий общественного питания имеем дело не с чистыми белками, а со смесями их с различными веществами. Коагуляция тормозится концентрированными растворами солей щелочных металлов, жирных кислот, растворами сахаров. Добавки эти являются гидрофильными веществами, их гидрофильные группы реагируют с гидрофильными группами белков, образуя комплексы и повышая температуру свертывания. Лекция 4
Альбумин Иммуноглобулин Протеозо-пептоны. Эти фракции отличаются молекулярной массой, изоэлектрической точкой, соотношением аминокислот, особенностями состава и строения. Сывороточные белки простые (протеины), казеин – сложный белок, в его состав входит фосфорная кислота. Белки молока – это глобулярные белки, имеющие большую молекулярную массу. Основной белок – казеин. На его долю приходится 4/5 всех белковых веществ молока. Выделенный и очищенный казеин – это амфотерный порошок, который не растворяется в воде, растворяется в слабых растворах щелочей, кислот, не имеет вкуса, запаха, имеет белый цвет. В молекуле казеина карбоксильные группы доминируют над аминными, поэтому он имеет кислую реакцию. Карбоксильные группы казеина могут реагировать с альдегидными группами лактозы и ионами металлов, образуя казеинаты. Стойкость казеиновых мицелл в молоке обусловлена наличием гидратной оболочки вокруг нее. Казеин в молоке находится в виде кальций-фосфат-казеинового каомплекса, где главная роль принадлежит Са, который образует кальциевые мостики между казеинатами кальция. Мицеллы казеина стойкие к нагреванию и механической обработке, стабильность их зависит от содержания растворенных солей кальция, химического состава казеина, активной кислотности. В свежем молоке при рН 6.6 казеин имеет отрицательный заряд. В изоэлектрической точке рН 4,6…4,7 казеин электронейтральный, имеет наименьшую растворимость и коагулирует. На этом базируется приготовление всех видов кисломолочной продукции. Комплекс белков, который остается в сыворотке после выделения казеина, называют сывороточными. β – лактоглобулин в процессе нагревания молока до 85…100Свесь коагулирует, с солями кальция образует молочный камень. В нагретом молоке вместе с к-казеином образует комплексы и выпадает в осадок. α – лактоальбумин сильно гидратированный, не коагулирует ни в изоэлектрической точке, ни под действием сычужного фермента. Тепловая денатурация сывороточных белков молока проявляется в снижении их растворимости, освобождении активных сульфгидрильных групп аминокислот. Казеин, в отличие от сывороточных белков, имеет значительно большую термостойкость, выдерживает нагрев до 150…160С без явных признаков коагуляции. С повышением кислотности казеиновый комплекс коагулирует при более низких температурах. Молоко с кислотностью 55…60Тсворачивается при комнатной температуре. К функциональным свойствам молока необходимо отнести их способность эмульгировать жир, стабилизировать жировую эмульсию, повышать водосвязывающую и водопоглощающую способность, образовывать мелко-пористые пены.
В курином белке содержится 11…12% белков, в желтке – 15…16%. В основном это сложный комплекс различных белковых веществ. Белки полноценны, соотношение аминокислот близко к оптимальному. В белке яйца содержится: Овоальбумины – 60…70% Овомукоид - 10…14% Кональбумин - 10…15% Авидин - 0,05…1% Лизоцим – 3% Овоглобулин и др. В желтке яйца содержатся в основном фосфопротеиды: Вителлин Ливетин Фосвитин
Белки яиц представляют собой концентрированные золи, котрые при тепловой обработке коагулируют, превращаясь в гели, удерживающие всю воду. Процесс загустевания белка протекает следующим образом: 45…50оС – изменений не наблюдается 50…55оС – появляются местные помутнения 55…60оС – помутнения распространяются на весь белок 60…65оС – белок заметно густеет 65…70оС – образуется студнеобразная нежная масса 75…85оС – образуется студень, сохраняющий воду 85…95оС – студень постепенно уплотняется Желток свертывается при температуре 70оС, что позволяет сварить яйца в «мешочек», яичницу глазунью. В смеси с молоком образуется менее плотный студень – омлеты, яичные кашки. Но при этом жидкости не должно быть более 50…60%. Поваренная соль снижает температуру денатурации белков, поэтому при попадании соли на желток в процессе жарки на яичницы образуются белые пятна свернувшегося белка. Рекомендуется солить или белок, или жир. Авидин и овомукоид в нативном состоянии отрицательно влияют на процесс пищеварения. Авидин в кишечнике связывает биотин (витамин Н), который участвует в регуляции нервной системы. Овомукоид угнетает действие трипсина, поэтому белки сырого яйца не только плохо перевариваются, но и частично всасываются в непереваренном виде, что может вызвать аллергию, при этом ухудшается усвоение соединений кальция. Поэтому рекомендуется употреблять термообработанные яйца, когда овомукоид денатурирует и потеряет свои свойства. В яйцах содержится 1,6% холестерина, а так же высокоактивная арахидоновая кислота, нормализующая жировой и холестериновый обмен. Липиды яиц содержат олеиновую, арахидоновую, линолевую и другие кислоты, до 9% фосфатидов. Снижения усвояемости яиц после тепловой обработки не отмечается.
Мука, вырабатываемая мукомольной промышленностью, характеризуется определенными свойствами и химическим составом, поскольку в процессе ее выработки в конечный продукт поступают различные анатомические части зерна в неодинаковом соотношении. В клетках паренхимной ткани семядолей бобовых и эндосперма семян хлебных и крупяных культур белковые вещества располагаются между крахмальными зернами в виде мельчайших частиц высохшей протоплазмы и алейроновых зерен. Белковые вещества зернобобовых можно разделить на четыре группы: Альбумины – растворимые в воде глобулины - растворимые в солевых растворах глиадин – растворим в спирте определенной концентрации глютенин – растворим в щелочах
Глиадин и глютенин называют клейковинными белками, так как они составляют основную часть отмытой клейковины теста. Пшеничная мука 1 сорта содердит в среднем 10…12% белковых веществ, при этом глиадин и глютенин составляют не менее 80% общего количества белков муки. В бобовых, крупах и муке белки находятся в состоянии сухих бесструктурных гелей. Набухание зерновых продуктов при замачивании, так же как и образование эластичного теста при замесе муки, обуславливается набуханием содержащихся в них белков, которые превращаются в более или менее обводненные гели. Вода, поглощаемая белками при набухании, связывается или адсорбируется осмотически и составляет около 200% их количества. Количество альбуминов и глобулинов составляет 15…20% общего содержания белков пшеницы. Отличаются от клейковинных белков более высоким содержанием лизина. В свободном состоянии в муке содержатся все аминокислоты, обнаруженные в пшенице и ржи, хотя количество их незначительно. МОДУЛЬ 2. УГЛЕВОДЫ В ТЕХНОЛОГИЧЕСКОМ ПРОЦЕССЕ ПРОИЗВОДСТВА ПРОДУКЦИИ ОБЩЕСТВЕННОГО ПИТАНИЯ
Лекция 5 ИЗМЕНЕНИЕ СВОЙСТВ САХАРА И САХАРИСТЫХ ВЕЩЕСТВ ПОД ВЛИЯНИЕМ ТЕХНОЛОГИЧЕСКИХ ФАКТОРОВ
Одним из важнейших компонентов питания человека являются углеводы. Их употребляется гораздо больше, чем жиров и белков, они составляют 60% суточной калорийности рациона, содержатся в основном в продуктах растительного происхождения. В основном в состав углеводов входят: углерод, водород, кислород и некоторые включения. Источником углеводов в нашем питании являются главным образом полисахариды (крахмал), дисахариды (сахароза, лактоза) и моносахариды (глюкоза и фруктоза). Сахара являются одной из важнейших составных частей плодов и овощей, где они находятся в растворённом состоянии в клеточном соке. Плоды и ягоды содержат от 3 до 15% сахаров: в винограде 14-23%, в бананах – до 18%. В яблоках и грушах преобладает в основном фруктоза, сахарозы содержится не более 1/4 общего количества сахаров, абрикосы и персики содержат до 4/5 сахарозы, в вишнях сахарозы не более 1%, а в кизиле она совсем отсутствует. Употребляемый сахар-рафинад является почти чистой сахарозой (99,9%). В овощах сахаров мало – 2-3%. Исключение составляет свекла – 7,1%, морковь – 6,4%. В фасоли сахаров содержится до 5%, они представлены сахарозой и тетрасахаридом – стахиозой. Стахиоза содержится также в чечевице и сое. В пшеничной муке содержание сахара зависит от сорта, чем выше сорт – тем меньше сахара, в среднем до 1%, в молоке содержится лактоза 4,6-4,8%, в мясе и яичном белке содержится немного глюкозы. Углеводы являются одним из основных источников энергии, составной частью ряда важнейших соединений живой клетки (нуклеиновых кислот и др.), а для растительных клеток ещё и главным строительным материалом. Оболочки этих клеток состоят преимущественно из углеводов. Классификация углеводов из-за их широкого распространения достаточно затруднена. По структуре углеводы делятся на простые (моносахара) и сложные (полисахариды). Сложные углеводы, которые при полном гидролизе способны образовывать моносахариды, в зависимости от молекулярной массы делятся на олигосахариды («oligos» –несколько) и высшие сахара. Моно- и олигосахариды в большинстве растворимы в воде и имеют сладкий вкус. Высшие сахара – мало или полностью нерастворимы и не имеют сладкого вкуса.
Основные группы углеводов представлены следующим образом:
Моносахариды: ã арабиноза; ã ксилоза; ã рибоза; ã дезоксирибоза; ã глюкоза; ã фруктоза; ã манноза; ã галактоза; ã сорбоза; ã рамноза.
Полисахариды: ã крахмал; ã гликоген; ã инулин; ã клетчатка; ã гемицеллюлоза; ã пектиновые вещества; ã слизи; ã агар-агар; Олигосахариды: ã сахароза; ã мелибиоза; ã мальтоза; ã лактоза; ã -трегалоза; ã -гентиобиоза; ã целлобиоза; ã рафиноза; ã стахиоза.
Моносахариды – это простые сахара, молекулы которых представляют собой одну неразветвлённую углеродную цепь, имеющую от трёх до шести атомов углерода. В зависимости от числа атомов углерода моносахариды называют триозами, тетрозами, пентозами, гексозами или гептозами. Один из атомов углерода в молекуле моносахаридов всегда представлен карбонильной группой С=0. При термической обработке растительных про-
|
||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 568; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.166.7 (0.164 с.) |
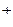 приводит к потере казеином агрегативной устойчивости, при этом происходит интенсивный процесс синерезиса, система расслаивается с образованием сырного сгустка. Причина — изменение агрегативной стойкости белков под влиянием химических веществ.
приводит к потере казеином агрегативной устойчивости, при этом происходит интенсивный процесс синерезиса, система расслаивается с образованием сырного сгустка. Причина — изменение агрегативной стойкости белков под влиянием химических веществ. S, аммиак NH
S, аммиак NH  , углекислый газ CO
, углекислый газ CO 



