
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Эритрон. Регуляция эритропоэза
Понятие «эритрон» введено английским терапевтом Каслом для обозначения массы эритроцитов, находящихся в циркулирующей крови, в кровяных депо и костном мозге. Принципиальная разница между эритроном и другими тканями организма заключается в том, что разрушение эритроцитов осуществляется преимущественно макрофагами за счет процесса, получившего наименование «эритрофагоцитоз». Образующиеся при этом продукты разрушения и в первую очередь железо используются на построение новых клеток. Таким образом, эритрон является замкнутой системой, в которой в условиях нормы количество разрушающихся эритроцитов соответствует числу вновь образовавшихся. Развитие эритроцитов происходит в замкнутых капиллярах красного костного мозга. Как только эритроцит достигает стадии ретикулоцита, он растягивает стенку капилляра, благодаря чему сосуд раскрывается и ретикулоцит вымывается в кровоток, где и превращается за 35—45 ч в молодой эритроцит — нормоцит. В норме в крови содержится не более 1— 2% ретикулоцитов. В кровотоке эритроциты живут 80—120 дней. Продолжительность жизни эритроцитов у мужчин несколько больше, чем у женщин. Для нормального эритропоэза необходимо железо. Последнее поступает в костный мозг при разрушении эритроцитов, из депо, а также с пищей и водой. Взрослому человеку для нормального эритропоэза требуется в суточном рационе 12—15 мг железа. Железо откладывается в различных органах и тканях, главным образом в печени и селезенке. Если железа в организм поступает недостаточно, то развивается железодефицитная анемия. Всасыванию железа в кишечнике способствует аскорбиновая кислота, переводящая Fe3+ в Fe2+, который сохраняет растворимость при нейтральных и щелочных значениях рН. На участке слизистой оболочки тонкой кишки имеются рецепторы, облегчающие переход железа в энтероцит, а оттуда в плазму. В слизистой оболочке тонкой кишки находится белок-переносчик железа — трансферрин. Он доставляет железо в ткани, имеющие трансферриновые рецепторы. В клетке комплекс трансферрина и железа распадается, и железо вступает в связь с другим белком-переносчиком — ферритином. Клетки-предшественники зрелых эритроцитов накапливают железо в ферритине. В дальнейшем оно используется, когда клетка начинает образовывать большое количество гемоглобина.
Важным компонентом эритропоэза является медь, которая усваивается непосредственно в костном мозге и принимает участие в синтезе гемоглобина. Если медь отсутствует, то эритроциты созревают лишь до стадии ретикулоцита. Медь катализирует образование гемоглобина, способствуя включению железа в структуру гема. Недостаток меди приводит к анемии. Для нормального эритропоэза необходимы витамины и в первую очередь витамин B12 и фолиевая кислота. Эти витамины оказывают сходное взаимодополняющее действие на эритропоэз. Витамин B12 (внешний фактор кроветворения) синтезируется микроорганизмами, лучистыми грибками и некоторыми водорослями. Для его образования необходим кобальт. В организм человека витамин B12 поступает с пищей — особенно его много в печени, мясе, яичном желтке. Для всасывания витамина В12 требуется внутренний фактор кроветворения, который носит наименование «гастромукопротеин». Это вещество является комплексным соединением, образующимся в желудке. Фолиевая кислота, или витамин В7, является водорастворимым витамином, содержащимся во многих растительных продуктах, а также в печени, почках, яйцах. Витамин В12 и фолиевая кислота принимают участие в синтезе глобина. Они обусловливают образование в эритробластах нуклеиновых кислот, являющихся одним из основных строительных материалов клетки. Немаловажную роль в регуляции эритропоэза играют другие витамины группы В, а также железы Все гормоны, регулирующие обмен белков (соматотропный гормон гипофиза, гормон щитовидной железы — тироксин и др.) и кальция (паратгормон, тиреокальцитонин), необходимы для нормального эритропоэза. Мужские половые гормоны (андрогены) стимулируют эритропоэз, тогда как женские (эстрогены) — тормозят его, что обусловливает меньшее число эритроцитов у женщин по сравнению с мужчинами. Особо важную роль в регуляции эритропоэза играют специфические вещества, получившие наименование «эритропоэтины». Еще в 1906 г. показано, что сыворотка крови кроликов, перенесших кровопотерю, стимулирует электропоэз. В дальнейшем было установлено, что эритропоэтины присутствуют в крови животных и людей, испытывающих гипоксию — недостаточное поступление к тканям кислорода, что наблюдается при анемиях, подъеме на высоту, мышечной работе, снижении парциального давления кислорода в барокамере, заболеваниях сердца и легких. В небольшой концентрации эритропоэтины обнаружены в крови здоровых людей, что позволяет считать их физиологическими регуляторами эритропоэза. Вместе с тем при анемиях, сопровождающих заболевания почек, эритропоэтины отсутствуют или их концентрация значительно снижается. Эти данные позволили предположить, что местом синтеза эритропоэтинов являются почки. Эритропоэтины образуются также в печени, селезенке, костном мозге. Получены факты, свидетельствующие о том, что мощной эритропоэтической активностью обладают полипептиды эритроцитов, молекулярная масса которых не превышает 10 000.
Роль нервной системы в регуляции системы крови. Участие НС в перераспределительных реакциях подтверждается опытами, в которых анестезия предотвращает такие реакции, как возникновение местного лейкоцитоза при болевом раздражении, раздражении брюшины, механическом раздражении слизистой желудка, поверхности печени и т.п.. Четкие изменения состава периферической крови отмечаются и при введении медиаторов НС (адреналина и ацетилхолина). Так, инъекция адреналина приводит к возникновению кратковременного лейкоцитоза. Значительно сложнее вопрос о влиянии нервной системы непосредственно на кроветворение. Многочисленные клинические наблюдения над изменениями состава крови при различных поражениях ЦНС явились основой для представления о существовании центральной регуляции кроветворения. При раздражении гипоталамуса стимуляция ядер симпатической НС приводит к ретикулоцитозу и эритропении, а разрушение этих ядер тормозит регенерацию крови после кровопотери. Гипоталамус участвует в регуляции образования гемопоэтинов. Кора больших полушарий также оказывает свое влияние на состав крови и кроветворения. При удалении одного или обеих полушарий у животных развивается анемия и умеренно выраженный нейтрофильный лейкоцитоз. Одновременно тормозится регенерация крови в ответ на постгеморрагическую или гемолитическую анемию. При неврозах в клинике и в эксперименте могут развиваться анемии. Возможна выработка условных рефлексов в системе крови (условно-рефлекторный пищевой лейкоцитоз). Все эти исследования, хотя и свидетельствуют о возможном влиянии ЦНС на систему крови, но не раскрывают путей реализации этих воздействий. Можно полагать, что они осуществляются посредством изменения функционального состояния межуточного мозга, что приводит к изменениям деятельности эндокринных желез, обмена веществ, сосудистого тонуса и т.п.. Несомненное влияние на систему крови оказывают и нижележащие отделы НС. Это доказано многочисленными экспериментами с перерезкой спинного мозга на различных уровнях. При перерезке шейного и грудного отделов наблюдается развитие анемии, ретикулоцитопении и нейтрофильного лейкоцитоза. В костном мозге в этих случаях снижается количество эритробластов. Нервные волокна, регулирующие кроветворение, выходят из спинного мозга на уровне D3-L3 сегментов. Симпатическая иннервация стимулирует кроветворение, парасимпатическая тормозит. Однако, при определенных условиях эти эффекты модифицируются и оба отдела ВНС могут оказывать на кроветворение одинаковое действие. Можно считать доказанным, что парасимпатикус влияет более на лейкопоэз, чем на эритропоэз.
Следует отметить, что в особой зависимости от нормального функционального состояния НС находится эритрон. Выключение определенных рефлексогенных зон (синокаротидная, аортальная), денервация внутренних органов (печень, селезенка, почки), перерезка некоторых периферических нервов (седалищный, бедренный) закономерно вызывают анемию у экспериментальных животных. Существует два пути регулирующего влияния НС на систему крови - прямой и косвенный с участием гуморальных посредников. Подтверждением наличия прямого пути является наличие иннервации костного мозга, причем костный мозг является и источником афферентной импульсации, т.е. связь двусторонняя. Вместе с тем велика и роль гуморальных посредников между НС и системой крови (опыты на парабионтах). Эти гуморальные стимуляторы кроветворения получили наименование гемопоэтины. Под гемопоэтинами подразумевают вещества, которые вырабатываются в организме и обладают способностью стимулировать кроветворение. В зависимости от точки приложения их действия различают эритропоэтины, лейкопоэтины и тромбопоэтины. Эритропоэтин. Наиболее изученным среди факторов, стимулирующих кроветворение, является эритропоэтин. Учение об эритропоэтинах возникло на основе опытов Карно и Дефландера, которые обнаружили в 1906 г., что сыворотка кроликов с анемией обладает способностью стимулировать эритропоэз при введении ее интактным животным. Эритропоэтины образуются не только после острой кровопотери, но и при массивном разрушении эритроцитов при фенилгидразиновом отравлении, при снижении содержания кислорода в воздухе, при любой гипоксии. Использование чувствительных методов обнаружения эритропоэтина показало наличие его в плазме здоровых людей. Это позволяет считать его физиологическим стимулятором эритропоэза. При патологических условиях наблюдается лишь усиление интенсивности его образования. Исключение составляют лишь анемии у больных с заболеваниями почек. Это обусловлено той особой ролью, которая приписывается почкам в формировании эритропоэтина. При двусторонней нефрэктомии выработка эритропоэтина прекращается. Эксплантация собственной почки больному животному восстанавливает синтез эритропоэтина. Это связано с тем, что эритропоэтин синтезируется особыми клетками в т.н. юкста -гломерулярном аппарате почки. Действуя на костный мозг. эритропоэтин стимулирует в нем дифференциацию основных стволовых клеток с сторону эритробластического ряда. Возможно его стимулирующее действие и на скорость созревания эритробластов и нормобластов. По своей химической природе эритропоэтин относится к гликопротеидам. Он имеет специфическую антигенную структуру, термостабилен и не связан с крупнодисперсными белками.
Эритропоэтины оказывают действие непосредственно на клетки-предшественники эритроидного ряда (КОЕ-Э – колониеобразующая единица эритроцитарная). Функции эритропоэтинов сводятся к следующему: 1) ускорение и усиление перехода стволовых клеток костного мозга в эритробласты; 2) увеличение числа митозов клеток эритроидного ряда; 3) исключение одного или нескольких циклов митотических делений; 4) ускорение созревания неделящихся клеток — нормобластов, ретикулоцитов. Ряд гемопоэтических факторов образуется стромой костного мозга и костномозговыми фибробластами. «Микроокружение» костного мозга является важнейшей частью кроветворного механизма. Эритроидные предшественники, размещенные на ячеистой сети костномозговых фибробластов, быстро развиваются и втискиваются между ними. Это объясняется тем, что для дифференцировки эритроидных клеток требуется их плотное прикрепление (адгезия) к окружающим структурам. Кроме того, фибробласты и эндотелиальные клетки являются источником ростковых факторов кроветворения. На эритропоэз действуют соединения, синтезируемые моноцитами, макрофагами, лимфоцитами и другими клетками, получившие название «интерлейкины». Согласно международной классификации, они обозначаются арабскими цифрами (ИЛ-1, ИЛ-2 и т. д.). На полипотентную стволовую клетку (ПСК) непосредственно влияют и способствуют ее дифференцировке ИЛ-3, ИЛ-6, ИЛ-11 и ИЛ-12. В частности, активированные макрофаги выделяют ИЛ-1, а также фактор некроза опухолей (ФНО). ИЛ-1 и ФНО стимулируют фибробласты и эндотелиальные клетки, благодаря чему они усиленно продуцируют так называемый белковый фактор Стала, оказывающий влияние непосредственно на ПСК и способствующий ее дифференцировке. Кроме того, фибробласты, эндотелиальные клетки и активированные Т-лимфоциты способны выделять ИЛ-6, ИЛ-11 и гранулоцитарно-макрофагальный колониестимулирующий фактор (ГМ-КСФ). Фактор Стала, ИЛ-3, ИЛ-6, ИЛ-11, ИЛ-1 и ГМ-КСФ относятся к раннедействующим гемопоэтическим ростовым факторам. По мере того как родоначальники нескольких линий кроветворных клеток дифференцируются в родоначальники одной линии, в реакцию вступают позднедействующие гемопоэтические ростовые факторы и эритропоэтин.
Рис. 5. Регуляция эритропоэза (по Захарову). Важная роль в эритропоэзе принадлежит ядерным факторам — ГАТА-1 (внутриядерный регулятор транскрипции в эритроне) и НФЕ-2. Отсутствие ГАТА-1 предотвращает образование эритроцитов, недостаток НФЕ-2 нарушает всасывание железа в кишечнике и синтез глобина. 6-4. Гемоглобин: свойства, соединения гемоглобина, количество Нв, методы его определения. Цветовой показатель: понятие, формула расчета, значение для клиники. Кривая диссоциации оксигемоглобина и факторы, на нее влияющие. Понятие о кислородной емкости крови. Метаболизм гемоглобина. Практически весь объём эритроцита заполняет дыхательный белок — гемоглобин (Hb). Гемоглобин. В химическом отношении гемоглобин относится к классу белков хромопротеидов. Его молекула состоит из двух a- и двух b-цепей, представляющих полипептиды. Гемоглобиновая молекула образована из 600 аминокислот, ее молекулярный вес равен 66000. Белковая молекула - глобин соединен с четырьмя простетическими группами - гемом. Молекулярный вес каждой из субъединиц – 16000. В центре гема расположен Fe2+. Благодаря особенностям межатомных связей О2 присоединяется к гему (Fe2+) обратимо, при этом атом железа не окисляется, т.е. не переходит в форму Fe3+. Чтобы отличить этот процесс от окисления, присоединение О2 к гемоглобину называют оксигенацией, а молекулу условно записывают в форме HbO2 или HHbO2. Обратный Рис. 1. Структура молекулы гемоглобина и гема. Гем легко вступает в химическую связь с СО – монооксидом углерода или угарным газом. Эта связь достаточно прочна, поэтому диссоциация комплекса СО с гемом происходит очень медленно. При этом связывание гема с СО препятствует связыванию гема с О2. При окислении Fe2+ в Fe3+ гемоглобин превращается в метгемоглобин, при этом также теряется способность к переносу кислорода. Содержание гемоглобина в крови человека неодинаково на протяжении жизни. У новорожденных оно составляет около 200 г/л, в течение первого года жизни снижается до 120 г/л, а затем постепенно возрастает. В норме у мужчин содержание гемоглобина составляет около 158 г/л, у женщин – 140 г/л. Определение концентрации гемоглобина в крови имеет важное медицинское значение. При длительном пребывании в высокогорье содержание гемоглобина возрастает, что является адаптационным приспособлением и направлено на нормализацию снабжения тканей кислородом при понижении его содержания в атмосферном воздухе. Уменьшение содержания гемоглобина в крови называется анемией. Концентрация.. Методы изучения концентрации Нв - колориметрия и спектрофотометрия при 540 нм. В настоящее время в качестве унифицированного признан цианметгемоглобиновый (гемиглобинцианидный) метод определения Hb крови. Данный метод основан на том, что после взаимодействия с железосинеродистым калием (красная кровяная соль) Hb окисляется в метгемоглобин (гемиглобин), который под влиянием CN-ионов образует окрашенный в красный цвет комплекс — цианметгемоглобин (гемиглобинцианид). Концентрацию цианметгемоглобина измеряют на фотоэлектрокалориметре и расчёт концентрации Hb производят по калибровочному графику. По Сали - просто, но недостаточно точно. В норме у мужчин в крови содержится 140-160 г/л, у женщин - 130-150 г/л Нв. Для определения степени насыщения эритроцитов Нв Гайем в 1905 году предложил вычислять т.н. цветовой показатель (ЦП), т.е. соотношение выраженных в процентах к норме Нв и эритроцитов в крови. Таким образом, ЦП = (Нв 4 х 100/Нв 4n): (Эр 4 х 100/Эр 4n), где Нв 4х 0 и Эр 4х 0 - показатели больного, а Нв 4n 0и Эр 4n 0 - нормальные значения концентрации Нв и эритроцитов. У здорового человека ЦП должен быть близким к 1. Кроме цветного (цветового) показателя в клинике для определения степени насыщения эритроцитов Нв вычисляют среднее содержание Нв в эритроците (Нв /л: Эр /л), которое в норме составляет 33 мкмкг, и среднюю концентрацию Нв в эритроците. - для ее вычисления концентрацию Нв в крови делят на показатель гематокрита и умножают на 100. В норме этот показатель равен 30-35%. Эти два показателя имеют разное значение. Среднее содержание Нв в эритроците зависит как от объема эритроцита, так и от насыщения его Нв. Между тем, концентрация Нв в эритроците определяется только процессом гемоглобинообразования. Поэтому первый показатель может возрастать при увеличении размера эритроцита, уменьшаться при микроцитозе и нарушениях процесса синтеза Нв. Второй - в норме близок к максимуму; всякое снижение концентрации Нв в эритроците указывает на нарушение гемоглобинообразования. О содержании в эритроцитах гемоглобина судят по так называемому цветовому показателю, или фарб-индексу (Fi, от farb — цвет, index — показатель) — относительной величине, характеризующей насыщение в среднем одного эритроцита гемоглобином. Fi — процентное соотношение гемоглобина и эритроцитов, при этом за 100% (или единиц) гемоглобина условно принимают величину, равную 166,7 г/л, а за 100% эритроцитов — 5*10 /л. Если у человека содержание гемоглобина и эритроцитов равно 100%, то цветовой показатель равен 1. В норме Fi колеблется в пределах 0,75—1,0 и очень редко может достигать 1,1. В этом случае эритроциты называются нормохромными. Если Fi менее 0,7, то такие эритроциты недонасыщены гемоглобином и называются гипохромными. При Fi более 1,1 эритроциты именуются гиперхромными. В этом случае» объем эритроцита значительно увеличивается, что позволяет ему содержать большую концентрацию гемоглобина. В результате создается ложное впечатление, будто эритроциты перенасыщены гемоглобином. Гипо- и гиперхромия встречаются лишь при анемиях. Определение цветового показателя важно для клинической практики, так как позволяет провести дифференциальный диагноз при анемиях различной этиологии. Существует несколько типов Hb, образующихся на разных сроках развития организма, различающихся строением глобиновых цепей и сродством к кислороду. Эмбриональные Hb (z‑ и e‑цепи) появляются у 19‑дневного эмбриона, присутствуют в эритроидных клетках в первые 3–6 мес беременности. Фетальный Hb (HbF — a2g2) появляется на 8–36 неделе беременности и составляет 90–95% всего Hb плода. Гемоглобин F имеет большее сродство к О2, чем гемоглобин А, что позволяет тканям плода не испытывать гипоксии, несмотря на относительно низкое напряжение О2 в его крови. Эта приспособительная реакция объясняется тем, что гемоглобин F труднее вступает в связь с 2,3-дифосфоглицернновой кислотой, которая уменьшает способность гемоглобина переходить в оксигемоглобин, а следовательно, и обеспечивать легкую отдачу О2 тканям. После рождения его количество постепенно снижается и к 8 мес составляет 1%. Дефинитивные Hb — основные Hb эритроцитов взрослого человека (96–98% — HbA (A1,) — a2b2, 1,5–3% — HbA2 — a2d2). Известно более 1000 мутаций разных глобинов, значительно изменяющих свойства Hb, в первую очередь — способность транспортировать O2. Фетальный Нв составляет 70-80% Нв новорожденного. НвF имеет меньшее сродство к кислороду и легко отдает его тканям. Только к концу первого года жизни НвF полностью замещается взрослым - НвА. Оказалось, что и у взрослых Нв гетерогенен. Большую часть (90%) составляет НвА-1, НвА-2 составляет 3-3%, и НвА-3 - 4-12%. При патологии появляются различные аномальные виды Нв. Различия заключаются в необычной последовательности аминокислот в глобине, приводящей к изменениям в физико-химических свойствах и форме молекулы. Виды Нв, его соединения и их значение. Основными соединениями Нв, имеющими физиологическое значение, являются: 1. Нв Н - восстановленный гемоглобин, не связанный ни с какими газами. 2. НвО2 - оксигемоглобин - соединение с кислородом, непрочное, легко диссоциирует на Нв и кислород, особенно в кислой среде и в присутствии углекислого газа. Кислород присоединен ковалентными связями к молекуле железа. В лёгких при повышенном pO2 Hb связывает (ассоциирует) O2, образуя оксигемоглобин (HbO2), в этой форме HbO2 переносит O2 от лёгких к тканям, где O2 легко освобождается (диссоциирует), а HbO2 становится дезоксигенированным Hb (обозначают как HbH). Для ассоциации и диссоциации O2 необходимо, чтобы атом железа гема был в восстановленном состоянии (Fe2+). При включении в гем трёхвалентного железа (Fe3+) образуется метгемоглобин — очень плохой переносчик O2. 3. НвСО2 - карбогемоглобин - соединение с углекислым газом, нестойкое, легко отдает углекислоту при изменении концентрации кислорода в крови. Углекислота присоединена к карбоксильным группам глобина. 4. НвСО - карбоксигемоглобин - прочное соединение гемоглобина с угарным газом, котором СО соединяется с железом валентными связями и трудно разрушается. Плохой переносчик кислорода. Hb легче (примерно в 200 раз), чем с O2, связывается с монооксидом углерода СО (угарный газ), образуя карбоксигемоглобин (O2 замещён CO). 5. МеtНв - метгемоглобин - прочное соединение Нв с кислородом, в котором железо трехвалентно и присоединяет кислород к основной валентности. В норме постоянно в небольших количествах образуется в крови и разрушается ферментом метгемоглобин-редуктазой эритроцитов.Hb, содержащий Fe гема в трёхвалентной форме (Fe3+); не переносит О2; прочно связывает O2, так что диссоциация последнего затруднена. Это приводит к метгемоглобинемии и неизбежным нарушениям газообмена. Образование MetHb может быть наследственным или приобретённым. В последнем случае это результат воздействия на эритроциты сильных окислителей. К ним относят нитраты и неорганические нитриты, сульфаниламиды и местные анестетики (например, лидокаин).
Патологические виды гемоглобина: HbM — группа аномальных Hb, у которых замещение одной аминокислоты способствует образованию MetHb (хотя активность метгемоглобинредуктазы нормальна), гетерозиготы имеют врождённую метгемоглобинемию, гомозиготы погибают в ходе внутриутробного развития. HbS — аномальный Hb (мутация в 6‑м положении b‑цепи), у гетерозигот имеются серповидно-клеточные эритроциты (HbS от 20 до 45%, остальное — HbA, анемии нет), у гомозигот развивается серповидно-клеточная анемия (HbS — 75‑100%, остальное — HbF или HbA2). Барта Hb [Bart — фамилия пациента, у которого впервые обнаружен этот Hb] — гомотетрамер, встречающийся у раннего эмбриона и при a‑талассемии, не эффективен как переносчик O2. Гликозилированный Hb (HbА1с) — HbА (A1), модифицированный ковалентным присоединением к нему глюкозы (норма HbA1C 5,8–6,2%). К одним из первых признаков сахарного диабета относят увеличение в 2–3 раза количества HbA1C. Этот Hb имеет худшее сродство к кислороду, чем обычный Hb. Катаболизм Нв. Разрушение молекулы Нв может происходить в любой клетке человеческого тела, но преимущественно осуществляется ретикулоэндотелиальной системой. Вследствие аутокаталитического окисления железо переходит в трехвалентную форму, гем - в оксипорфирин. Железо отщепляется от порфириновой молекулы. Гидролитическое расщепление порфиринового кольца приводит к образованию в печени билирубина, в моче уробилина и в кале - стеркобилина. Количество желчных пигментов, образующихся за сутки, используется как мерило разрушения Нв. Ранее был широко распространён метод определения Hb с помощью гемометра Сали, представляющего собой небольшой штатив, в гнездах которого расположены градуированная пробирка и две запаянные пробирки со стандартным окрашенным раствором. Градуированной пипеткой насасывают выступающую из прокола кожи кровь до отметки 0,02 (20 мкл) и осторожно выдувают в градуированную пробирку гемометра с 0,1 н раствором соляной кислоты, перемешивают стеклянной палочкой и вставляют пробирку в гнездо гемометра между пробирками со стандартным раствором. В пробирку с испытуемым раствором добавляют дистиллированную воду по каплям до тех пор, пока цвет испытуемого и стандартного растворов не совпадёт. По шкале пробирки определяют уровень жидкости, который соответствует концентрации Hb. Транспорт кислорода. Кровь ежедневно переносит из лёгких в ткани около 600 л О2. Основной объём О2 транспортирует HbO2 (O2 обратимо ассоциирован с Fe2+ гема, это так называемый химически связанный O2 [неверный по существу, но — к сожалению — устоявшийся термин]). Незначительная часть O2 растворена в крови (физически растворённый O2). Содержание O2 в крови в зависимости от парциального давления O2 (Po2) представлено на рис. 1. Кривая диссоциации О2 для гемоглобина имеет сигмоидную форму (S-образную). Это указывает на то, что субъединицы Hb работают кооперативно: чем больше О2 связывают (отдают) субъединицы, тем легче идёт ассоциация (диссоциация) последующих молекул О2. Из графика на рис. 1 также видно, что Hb (в отличие от миоглобина) имеет значительно более низкое сродство к О2; полунасыщение гемоглобина О2 наступает при более высоком давлении О2 (около 26 мм рт.ст.). В капиллярах покоящихся мышц, где давление О2 составляет около 40 мм рт.ст., большая часть кислорода возвращается в составе оксигемоглобина обратно в лёгкие. При физической работе Po2 в мышечных капиллярах падает до 10–20 мм рт.ст. Именно в этой области (от 10 до 40 мм рт.ст.) располагается «крутая часть» S-образной кривой, где в наибольшей степени проявляется свойство кооперативной работы субъединиц. Характер насыщения гемоглобина кислородом таков, что кривая существенно уплощается при Po2 около 70 мм рт.ст. Так, при Po2 ниже 60 рт.ст. кислород хорошо связывается с Hb, но уже при Po2 60 мм рт.ст. насыщение составляет 90%, и дальнейшее увеличение Po2 относительно слабо сказывается на насыщении (увеличение Po2 от 60 до 100 мм рт.ст. увеличивает насыщение всего на 7%). Другими словами, в этом диапазоне Po2 насыщение O2 благоприятно для обеспечения его транспорта. Совершенно иная картина складывается при значениях Po2 ниже 60 мм рт.ст., т.е. при небольших изменениях Po2 из Hb освобождается существенные количества O2, что облегчает его диффузию из крови в ткани.
Рис. 2. Диссоциация оксигемоглобина в крови в зависимости от Po2 [4]. В зависимости от изменений (указаны стрелками) температуры, pH, Pco2 крови и концентрации 2,3-бифосфоглицерата в эритроцитах кривая насыщения гемоглобина O2 сдвигается вправо (что означает меньшее насыщение кислородом) или влево (что означает большее насыщение кислородом). На кривой кружочком отмечена позиция, соответствующая половинному насыщению (S0,5). 2,3-Бифосфоглицерат (БФГ) — промежуточный продукт гликолиза — содержится в эритроцитах примерно в той же молярной концентрации, что и Hb. БФГ связывается с Hb (в основном за счёт взаимодействия с b‑субъединицей, т.е. с дефинитивными Hb, но не с фетальным Hb, в составе которого нет b‑субъединицы). Связывание БФГ с Hb сдвигает кривую диссоциации Hb вправо, что способствует диссоциации О2 при умеренных значениях Po2 (например, в тканевых капиллярах), но практически не влияет на кривую диссоциации при высоких значениях Po2 (в капиллярах лёгкого). Существенно, что при усилении гликолиза (анаэробного окисления) концентрация БФГ в эритроцитах увеличивается, что является механизмом приспособления организма к гипоксии, наблюдающейся при заболеваниях лёгких, анемиях, подъёме на высоту. Так, в период адаптации к высокогорью (более 4 км над уровнем моря) концентрация БФГ уже через 2 дня возрастает почти в 2 раза (от 4,5 до 7,0 мМ). Понятно, что это снижает сродство Hb к О2 и увеличивает количество О2, освобождаемого из капилляров в ткани. · Кислородная ёмкость крови — максимальное возможное количество связанного с Hb О2 — теоретически составляет 0,062 ммоль О2 (1,39 мл О2) на 1 г Hb (реальное значение несколько меньше — 1,34 мл О2 на 1 г Hb). Измеренные же значения составляют для мужчин 9,4 ммоль/л (210 мл О2/л), для женщин — 8,7 ммоль/л (195 мл О2/л). МЕТАБОЛИЗМ ГЕМОГЛОБИНА Удаление эритроцитов из кровотока происходит тремя путями: 1) путём фагоцитоза, 2) в результате гемолиза и 3) при тромбообразовании. Фагоцитоз. Закончившие жизненный цикл и повреждённые эритроциты фагоцитируются макрофагами селезёнки, печени и костного мозга. Поскольку в эритроцитах нет синтезирующего белок аппарата и синтез белка de novo невозможен, со временем в них происходит деградация белков, снижается обмен веществ, нарушается их форма, а на поверхности клетки появляются новые Аг (например, «Аг старения» — деградировавший белок полосы 3). Такие стареющие, а также повреждённые клетки распознаются макрофагами и фагоцитируются. Нормально за 1 сутки из кровотока удаляется 0,5–1,5% общей массы эритроцитов (40 000–50 000 клеток/мкл, или около 4,2´1010/л). Гемолиз — разрушение эритроцитов вследствие как внутренних дефектов клетки (например, при наследственном сфероцитозе), так и под влиянием разных факторов микроокружения [при пирексии — значительном повышении температуры тела, под влиянием меди, мышьяка, бактериальных эндотоксинов; в результате механического повреждения клетки (например, при прохождении через мелкие сосуды), в результате взаимодействия Аг эритроцита с присутствующими в плазме АТ, а также под влиянием компонентов комплемента]. При этом содержимое клетки выходит в плазму, а клеточные обломки фагоцитируются макрофагами. Массовый гемолиз эритроцитов может привести к снижению общего количества циркулирующих эритроцитов (гемолитическая анемия). Тромбообразование сопровождпется частичным разрушением эритроцитов. Распад гемоглобина. При любом варианте разрушения эритроцитов Hb распадается на гем и глобины (рис. 24–15). Глобины, как и другие белки, расщепляются до аминокислот, а при разрушении гема
Рис. 3. Обмен гемоглобина и билирубина [16] Метаболизм билирубина. На рис. 3 рассмотрены этапы метаболизма билирубина. В организме билирубин образуется не только из гема Hb, но и при распаде гема, входящего в состав миоглобина и цитохромов. Билирубин — жёлчный пигмент красного цвета, находящийся в жёлчи в виде натриевой (растворимой в жёлчи) или кальциевой (нерастворимой в жёлчи) соли — продукт восстановления биливердина, образуется преимущественно в результате нормального и патологического разрушения эритроцитов. В клинической практике различают прямой (конъюгированный, связанный) и непрямой (неконъюгированный, свободный) билирубин. Непрямой билирубин — фракция сывороточного билирубина, не соединившаяся в клетках печени с глюкуроновой кислотой (назван так потому, что реагирует с диазореактивом Эрлиха только после добавления этилового спирта). Прямой билирубин — фракция сывороточного билирубина, соединившаяся в гепатоцитах с глюкуроновой кислотой с образованием диглюкуронида билирубина (назван так потому, что напрямую реагирует с диазореактивом Эрлиха). Рис. 4. Этапы метаболизма билирубина В гепатоцитах происходит конъюгация билирубина с глюкуроновой кислотой и секреция его в жёлчь с помощью механизма активного транспорта. Под влиянием микрофлоры Гипербилирубинемия и желтуха. При увеличении содержания в крови билирубина (гипербилирубинемия) он диффундирует в ткани, окрашивая их в жёлтый цвет. Такое состояние называется желтухой. В зависимости от того, какой тип билирубина присутствует в плазме, гипербилирубинемию можно разделить на неконъюгированную или конъюгированную. Первый вариант наблюдается при усиленном гемолизе (надпечёночная желтуха) или заболеваниях печени (печёночная желтуха): как приобретённых (действие токсических веществ, отравления грибами, гепатиты, цирроз), так и при наследственных ферментопатиях (например, при синдромах Криглера–Найара и Жильбера). Конъюгированная гипербилирубинемия может быть обусловлена обтурацией печёночных или общего жёлчного протоков (подпечёночная желтуха), например камнем или опухолью, а также при некоторых наследственных заболеваниях (например, синдром Дабина–Джонсона), проявляющихся нарушением секреции в жёлчь билирубина и ряда других конъюгированных соединений (например эстрогенов). Конъюгированный билирубин растворим в воде, поэтому он обнаруживается в моче больных конъюгированной гипербилирубинемией. Присутствие в моче билирубина и отсутствие уробилиногена свидетельствует о наличии обтурационной желтухи. При надпечёночной желтухе в моче в больших количествах выявляется уробилиноген, но билирубин, как правило, отсутствует. Анемия — любое состояние, при котором количество эритроцитов, содержание Hb и Ht снижены относительно нормы (содержание Hb <100 г/л, количество эритроцитов <4,0´1012/л, содержание железа сыворотки крови <14,3 мкмоль/л). Термин «анемия» без детализации не определяет конкретного заболевания, а лишь указывает на изменения в анализах крови, т.е. анемию следует считать всего лишь одним из симптомов патологических состояний.
|
|||||||||
|
Последнее изменение этой страницы: 2016-04-18; просмотров: 1771; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.17.45 (0.05 с.) |
 внутренней секреции.
внутренней секреции.
 процесс соответственно носит название дезоксигенации, а запись молекулы – Hb или HHb.
процесс соответственно носит название дезоксигенации, а запись молекулы – Hb или HHb.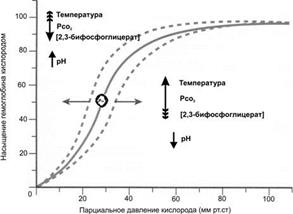
 освобождаются ионы железа, оксид углерода (СО) и протопорфирин (вердоглобин, из которого образуется биливердин, восстанавливающийся в билирубин). Билирубин в комплексе с альбумином транспортируется в печень, откуда в составе жёлчи поступает в кишечник, где происходит его превращение в уробилиногены. Превращение гема в билирубин можно наблюдать в гематоме: обусловленный гемом пурпурный цвет медленно переходит через зелёные цвета вердоглобина в жёлтый цвет билирубина.
освобождаются ионы железа, оксид углерода (СО) и протопорфирин (вердоглобин, из которого образуется биливердин, восстанавливающийся в билирубин). Билирубин в комплексе с альбумином транспортируется в печень, откуда в составе жёлчи поступает в кишечник, где происходит его превращение в уробилиногены. Превращение гема в билирубин можно наблюдать в гематоме: обусловленный гемом пурпурный цвет медленно переходит через зелёные цвета вердоглобина в жёлтый цвет билирубина. кишечника образуются бесцветные уробилиногены, небольшая часть их всасывается в кишечнике и вновь попадает в печень, а основная часть под действием кишечной микрофлоры окисляется в окрашенные уробилины и удаляется с фекалиями. При патологических состояниях (например, при увеличении количества жёлчных пигментов или заболеваниях печени) уробилиноген может выделяться с мочой.
кишечника образуются бесцветные уробилиногены, небольшая часть их всасывается в кишечнике и вновь попадает в печень, а основная часть под действием кишечной микрофлоры окисляется в окрашенные уробилины и удаляется с фекалиями. При патологических состояниях (например, при увеличении количества жёлчных пигментов или заболеваниях печени) уробилиноген может выделяться с мочой.


