
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Расчет температуры и давления взрыва для горючей смеси стехиометрического состава
Задание 1. Составить уравнение реакции горения смеси исходного газа (или паров жидкости) с воздухом. 2. Рассчитать температуру и давление при взрыве паров горючего с воздухом, если концентрация паров горючего стехиометрическая, начальная температура смеси t0 ,оС, начальное давление р0, МПа. 3. Изучите методику расчета температуры и давления взрыва. 4. Недостающие для расчетов данные примите по таблице 26 – 27, приложения 3
Общие положения
При горении газовых смесей в замкнутом объеме продукты горения не совершают работу, поэтому энергия взрыва расходуется на нагрев продуктов взрыва. В этом случае энергия определяется как сумма внутренней энергии взрывчатой паровоздушной смеси Qвн.эн.см. и теплоты горения данного вещества Qгор.. Величина Qвн.эн.см. равна сумме произведений теплоемкости компонентов горючей взрывчатой смеси при постоянном объеме на начальную температуру (в К):
Где СVi – мольная теплоемкость i-го компонента взрывчатой горючей смеси, кДж/(моль*К); Т – начальная температура смеси,К; N – число компонентов смеси.
Значения внутренней энергии негорючих газов находим по табл.27, приложения 3[3].
Пример 1. Рассчитать температуру взрыва паров этилового спирта (этанола) при начальной температуре 27оС и давлении 0,1 МПа. Концентрация стехиометрическая.
Решение. 1.Составим термодинамическое уравнение горения этилового спирта в воздухе
С2Н5ОН + 3(О2 + 3,76N2) → 2СО2 + 3Н2О + 11,28N2 – 1410,03 кДж/моль.
Величину Qгор = 1410,03 кДж/моль находим по таблице 26, прил. 3[3].
2. Определяем внутреннюю энергию паровоздушной смеси по формуле (1), где n1 – число молей этанола, равное 1; n2 – число молей кислорода, равное 3, n3 – число молей азота, равное 11,28. Мольные теплоемкости каждого компонента смеси при постоянном объеме могут быть вычислены по формуле
СVi = СРi – R, (2)
где СРi - мольная теплоемкость при постоянном давлении, справочное значение находим по таблице 26, прил. 3[3].
R – газовая постоянная, 8,31 Дж/(моль*К). По таблице находим значения СРi, Дж/(моль*К).
СР(этанола) = 71,1; СР(N2)= 29,12; СР(О2) = 29,37.
Рассчитываем мольные теплоемкости каждого компонента по (2):
СV(этанола) = 71,1 – 8,31 = 62,79 Дж/(моль*К), СV(кислорода) = 29,37 – 8,31 = 21,06 Дж/(моль*К), СV(азота) = 29,12 – 8,31 = 20,81 Дж/(моль*К).
По (1) рассчитываем внутреннюю энергию паровоздушной смеси при 300К:
Qвн.эн.см = 62,79 * 300 + 3 * 21,06 * 300 + 11,28 * 20,81 * 300 = 108212 Дж.
3. Определяем теплоту взрыва смеси по формулам:
Qвн.эн.см = (Qвзр – Qг.в.nг.в.), (3)
отсюда Qвзр = Qг.в.nг.в. + Qвн.эн.см.,
где nг.в. – число молей горючего вещества, равное 1; Qг.в. – теплота горения этилового спирта, находим по таблице 26, прил. 3[3]. Qвзр = 14010030 + 108212 = 1518242 Дж.
4.Определяем среднюю внутреннюю энергию продуктов взрыва по формуле
Сi Твзр = Qвзр / Σni, (4)
где Σni – общее число молей продуктов взрыва;
nСО2 = 2 моль, nН2О = 3 моль, nN2 = 11,28 моль.
Σni = 2 + 3 + 11,28 = 16,28 моль.
Сi Твзр = 1518242 / 16,28 = 93258,1 Дж/моль.
По табл. 27, прил. 3[3] определяем приблизительную температуру взрыва по продуктам горения: для СО2 – 2200К, для воды – 2600К, для азота - 3600К. Определяем среднее значение температуры:
Тср = (2200 + 2600 + 3600)/3 = 2800К; Твзр = 2800К.
5.Вычисляем внутреннюю энергию Qт продуктов взрыва при температуре 2800К.
Q2800 = 2 * 127300 + 3 *100967 + 11,28 * 70865 = 1356858,2 Дж;
Q2800 < Qвзр, следовательно, Твзр > 2800К. Принимаем Твзр = 3000К.
Q3000 = 2 * 138177 + 3 * 109769 + 11,28 * 76605,5 = 1469765,4 Дж;
Q3000 < Qвзр, следовательно, температура взрыва больше 3000К. Принимаем Твзр = 3200К.
Q3200 = 2 * 149025 + 3 * 118850,7 + 11,28 * 82316,7 = 1583134,48 Дж.
6.Интерполяцией определяем температуру взрыва:
Твзр = 2800 + (Qвзр – Q2800)(3200 – 2800)/ (Q3200 - Q2800) =
2800 + (1518242 – 1356858,2)*400 / (1583134,48 – 1356858,2) = 3085,3К. По температуре взрыва находят давление взрыва. Давление при взрыве газовоздушной смеси в закрытом объеме зависит от температуры взрыва и отношения числа молекул продуктов горения к числу молекул взрывчатой смеси. При взрыве газовоздушных смесей давление обычно не превышает
1,0 МПа, если первоначальное давление смеси было нормальным. При замене воздуха во взрывчатой смеси кислородом резко увеличивается давление взрыва, поскольку увеличивается температура горения. При взрыве даже стехиометрической газовоздушной смеси значительное количество теплоты затрачивается на нагревание азота, находящегося в смеси, поэтому температура взрыва таких смесей намного ниже температуры взрыва смесей с кислородом. Так, давление взрыва стехиометрических смесей метана, этилена, ацетона и метилового эфира с кислородом составляет 1,5 – 1,9 МПа. Максимальное давление взрыва используют при расчетах взрывоустойчивости аппаратуры, а также в расчетах предохранительных клапанов, разрывных мембран и оболочек взрывонепроницаемого электрооборудования. Давление взрыва (в МПа) газовоздушных смесей рассчитывают по следующей формуле:
где р0 – начальное давление взрывчатой смеси, МПа, Т0 и Твзр – начальная температура взрывчатой смеси и температура взрыва К, Σni – число молекул газов продуктов сгорания после взрыва, Σnсм – число молекул газов смеси до взрыва.
Пример 2.
Вычислить давление при взрыве смеси паров этилового спирта и воздуха по формуле (5), если Твзр = 3085К, Т0 = 300К, р0 = 0,1МПа. Σni = 2 + 3 + 11,28 = 16,28 моль (по уравнению горения), Σnсм = 1 + 3 + 11,28 = 15,28 моль (по уравнению горения).
Рвзр = (0,1* 3085 * 16,28) / (300 * 15,28) = 1,096 МПа.
Ответ. Температура взрыва 3085К, давление при взрыве паров этилового спирта в воздухе равно 1,096 МПа.
Содержание отчета
Отчет должен отвечать требованиям общих методических указаний по выполнению работ, содержать обоснованные выводы по результатам расчетов. В отчете приведите результаты расчетов и ответы на контрольные вопросы.
Контрольные вопросы
1.Дайте определение теплового взрыва. 2.Назовите пределы взрываемости паровоздушной смеси. От чего они зависят? 3.Как рассчитать температуру взрыва, давление взрыва? 4.Рассчитайте и сравните температуру и давление при взрыве взрывчатой смеси с кислородом.
Исходные данные:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-04-05; просмотров: 221; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.220.106.241 (0.018 с.) |
 Qвн.эн.см.=
Qвн.эн.см.= 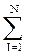 СViТ, (1)
СViТ, (1)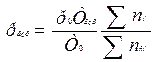 , (5)
, (5)


