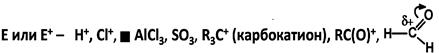Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Пространственное строение циклических соединений
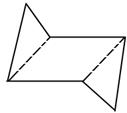
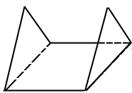
При замыкании колец в органических соединениях можно наблюдать возникновение углового напряжения. Угловое напряжение – увеличение энергии молекулы, вызванное отклонением угла между связями от идеальной величины (109º28´) − напряжение Байера. Это напряжение необходимо отличать от торсионного напряжения. Торсионное напряжение – увеличение энергии молекулы, вызванное заслоненным положением заместителей – обычно по σ-связям. Циклогексановое кольцо встречается во многих биологически активных соединениях. Все шесть углеродных атомов находятся в состоянии sp3-гибридизации, следовательно, их химические связи не лежат в одной плоскости. Если бы циклогексановое кольцо было плоским, то все его заместители находились бы в невыгодной заслоненной конформации, что приводило бы к возникновению торсионного напряжения. На деле кольцо это очень прочно, так как существует в виде двух конформаций: кресла или ванны (лодки):
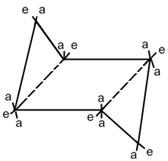
конформация кресла конформация ванны (лодки) Наиболее выгодной является конформация «кресла», так как в ней полностью отсутствует угловое напряжение. Каждый атом углерода в циклогексановом кольце может иметь два заместителя: в аксиальном (а) и экваториальном (е) положениях. Аксиальные заместители (а) располагаются вверх и вниз параллельно оси симметрии. Экваториальные заместители (е) расположены под углом 109º28´ к оси симметрии в направлении к периферии от молекулы.
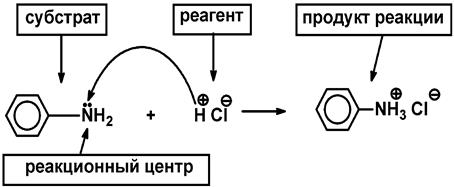
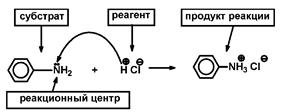
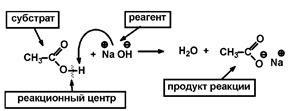
Наиболее энергетически выгодным является экваториальное расположение заместителей в циклогексановом кольце, так как при этом отсутствует торсионное напряжение. При аксиальном расположении заместителей возникают 1,3 диаксиальные взаимодействия, что ведет к возникновению торсионного напряжения и образованию термодинамически менее устойчивых соединений. 1.8. Классификация реагентов и органических реакций. Реакционная способность – способность вещества вступать в ту или иную химическую реакцию и реагировать с большей или меньшей скоростью. Реакционный центр – атом или группа атомов в молекуле, непосредственно участвующие в химической реакции. Субстрат – вещество, подвергающееся изменениям в результате химической реакции.
Реагент – партнер субстрата и более простое вещество.
Типы реагентов и характер изменения связей Кислотные реагенты (кислоты) – доноры протона по отношению к реакционному партнеру: частично или нацело ионизированные в водных растворах нейтральные молекулы (HCl, CH3COOH) или положительно заряженные частицы (NH4+, H3O+). Основные реагенты (основания) – акцепторы протона по отношению к реакционному партнеру. Отрывают протон от кислотного центра: отрицательно заряженные частицы B(ASE)- HO-, CH3O- или нейтральные молекулы B: – NH3 , H2O. Нуклеофильные реагенты (нуклеофилы) – частицы, образующие новую ковалентную связь за счет своей электронной пары. Свойства: - обладают повышенной электронной плотностью, взаимодействуют с любым атомом (кроме водорода), несущим частичный или полный положительный заряд; - нуклеофил заряжен отрицательно (Nu-, Cl-, HO-, CH3O-, R3C- - карбоанион) или имеет неподеленную пару электронов (Nu, NH3 , H2O) или π-связь CH2= CH2, C6H6. Электрофильные реагенты (электрофилы) – частицы, образующие новую ковалентную связь за счет пары электронов партнера. Свойства: - взаимодействуют с реакционным центром партнера с повышенной электронной плотностью; - имеют атом, несущий частичный или полный положительный заряд или обладают вакантной орбиталью.
Радикальные реагенты (радикалы) – свободные атомы или частицы с неспаренным электроном (парамагнитные частицы). R• – Cl•, Br•, HOO•, R•, •O–O• (бирадикал)
|
|||||||||
|
Последнее изменение этой страницы: 2021-04-04; просмотров: 73; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.216.121.55 (0.005 с.) |