Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Химические связи атома углерода
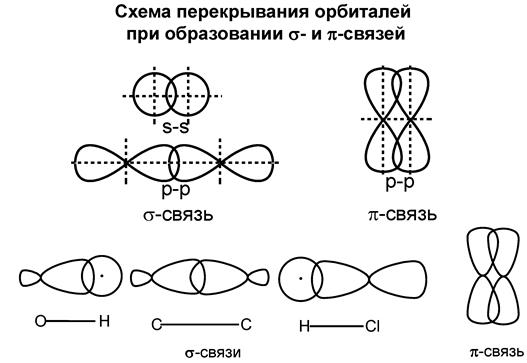
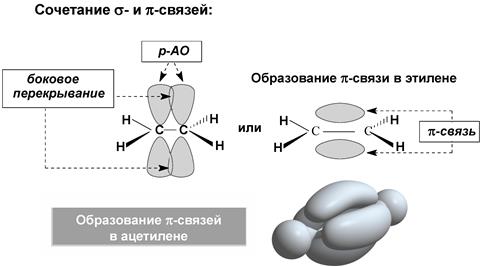
Ковалентная связь – это химическая связь, образованная в результате обобществления электронов связываемых атомов. σ-связь – ковалентная одинарная связь, которая образуется при перекрывании гибридных и негибридных АО с максимальным перекрыванием по прямой, соединяющей ядра атомов. π-связь − ковалентная связь, которая образуется за счет бокового перекрывания негибридных p-атомных орбиталей с максимумом перекрытия по обе стороны от прямой, соединяющей ядра атомов.
Схема перекрывания орбиталей при образовании σ-связей с участием атома углерода
Кратные связи
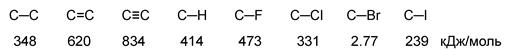
Характеристики ковалентной связи (длина, энергия, полярность, поляризуемость)
Длина связи – это расстояние между центрами связанных атомов. Энергия связи – это энергия, которая выделяется при образовании связи или необходимая для разъединения двух атомов.
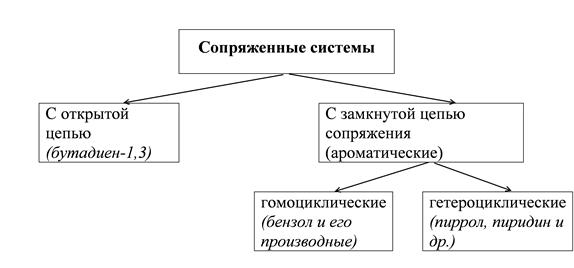
Сопряжение Молекулы с чередующимися двойными π и простыми σ связями называют сопряженными системами.
Сопряжение – это перераспределение электронной плотности в системе π – связей, приводящее к стабилизации молекулы. Энергия сопряжения – это уменьшение энергии молекулы благодаря сопряжению. Открытые системы сопряжения Бутадиен-1,3, каждый из четырех углеродов в состоянии sp2-гибридизации, у каждого углерода – по одной свободной p-орбитали. В результате бокового перекрывания орбиталей происходит сопряжение двух локализованных двойных связей с образованием делокализованной четырехцентровой молекулярной орбитали. Этот вид сопряжения называют π-π-сопряжение. Есопряж. = 250 кДж/моль – 235 кДж/моль = 15 кДж/моль. Наблюдается выравненность электронных плотностей в результате делокализации электронов, создание единого электронного облака. Делокализация электронов в циклических соединениях приводит к возникновению ароматических систем.
Правила ароматичности. 1. Наличие плоского цикла (кольца), состоящего из sp2-гибридизованных атомов, образующих σ-скелет (молекула копланарна). 2. Делокализация электронов, приводящая к образованию единого электронного облака (π-секстет).
3. Подчинение правилу Э. Хюккеля, т.е. электронное облако должно насчитывать (4n+2) π-электронов, где n=1,2,3,4… 4. Высокая степень термодинамической устойчивости (энергия сопряжения). Гомоциклические ароматические системы.
|
|||||||||||||||
|
Последнее изменение этой страницы: 2021-04-04; просмотров: 118; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.138.105.31 (0.004 с.) |
||||||||||||||||
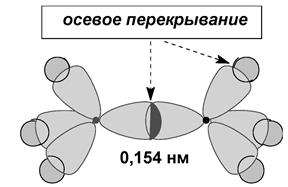
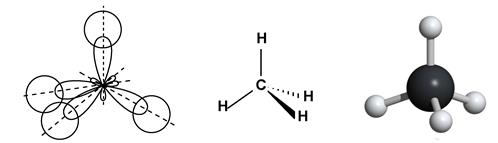 метан CH4 – тетраэдрическая молекула
метан CH4 – тетраэдрическая молекула
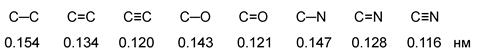
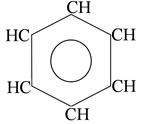 бензол
n=1
6ē делокализовано в
π- секстет
бензол
n=1
6ē делокализовано в
π- секстет
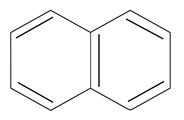 нафталин
n=2
10ē делокализовано
нафталин
n=2
10ē делокализовано