Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Основы биоорганической химииСтр 1 из 10Следующая ⇒
ОСНОВЫ БИООРГАНИЧЕСКОЙ ХИМИИ
Раздел 1. Основы строения и факторы, определяющие реакционную способность органических соединений 1.1. Введение в биоорганическую химию. Биоорганическая химия изучает строение и свойства веществ, участвующих в процессах жизнедеятельности, в непосредственной связи с познанием их биологических функций.
Некоторые понятия и термины Метаболизм (обмен веществ) – совокупность химических реакций, протекающих в организме; дает энергию и вещества, необходимые для функционирования организма. Катаболизм – реакции распада (выделение энергии, окисление [O]). Анаболизм – реакции биосинтеза (затрата энергии, восстановление [H]). Биосинтез – химические реакции, приводящие в условиях организма к получению конкретного класса соединений. Для обозначения химического процесса, протекающего вне организма используется латинское название – in vitro, внутри организма – in vivo.
Приставки и окончания, применяемые для обозначения некоторых групп в биологически важных соединениях
Приставки | Окончания | ||||||||||
|
| –COOH | карбокси- | - овая кислота | |||||||||
 -C=O
H -C=O
H
| оксо- | -аль | ||||||||||

 C=O C=O
| -он | |||||||||||
| –OH | гидрокси- | -ол | ||||||||||
| –SH | меркапто- (тио-) | -тиол | ||||||||||
| –NH2 | амино- | -амин | ||||||||||
| –O–CH3 |
этокси- | алкокси | – | |||||||||
| –O–C2H5 | – | |||||||||||
 
  C=C C=C
| – | -ен | ||||||||||
| Галогены | бромо-, йодо-, фторо-, хлоро- | – | ||||||||||
| Радикалы: –CH3 | 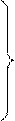 метил- метил-
| алкилы | – | |||||||||
| –C2H5 | этил- | – | ||||||||||
| –C3H7 | пропил- | – | ||||||||||
| –СH(CH3)2 | изопропил- | – | ||||||||||
При построении названия соединения:
v определить тип характеристической группы (или групп);
v если характеристических групп несколько, необходимо выделить старшую;
v ограничить родоначальную структуру, в которую должна входить старшая характеристическая группа и провести нумерацию атомов углерода родоначальной структуры;
|
|
v старшая характеристическая группа отражается суффиксом, младшие группы – префиксом;
v заместители обозначаются префиксами, перечисляются в алфавитном порядке с указанием их числа и места у пронумерованного атома углерода родоначальной структуры;
Ациклические углеводороды
Алканы – ациклические углеводороды, содержащие максимальное количество атомов водорода. Первые четыре представителя имеют полусистематические названия – метан, этан, пропан, бутан. Остальные алканы называют с помощью корня соответствующего греческого числительного с добавлением суффикса – ан:
| n | CnH2n+2 | n | CnH2n+2 |
| 1 | CH4 - метан | 12 | C12H26 - додекан |
| 2 | C2H6 - этан | 15 | C15H32 - пентадекан |
| 3 | C3H8 - пропан | 18 | C18H38 - октадекан |
| 4 | C4H10 - бутан | 20 | C20H42 - эйкозан |
| 5 | C5H12 - пентан | 21 | C21H44 - генэйкозан |
| 6 | C6H14 - гексан | 28 | C28H58 - октакозан |
| 7 | C7H16 - гептан | 30 | C30H62 - триаконтан |
| 8 | C8H18 - октан | ||
| 9 | C9H20 - нонан | ||
| 10 | C10H22 - декан |
Одновалентные радикалы, производимые от насыщенных ациклических углеводородов, называют путем замены окончания –ан на –ил:
CH3 – метил-
C2H5 – этил-
CH3–CH2–CH2 – пропил-
H3 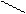 C
C
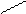 CH– изопропил-
CH– изопропил-
H3C
CH3–CH2–CH–CH3 – втор-бутил-
|
H3 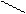 C
C
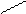 CH– CH2– изобутил- и т.д.
CH– CH2– изобутил- и т.д.
H3C
Наиболее длинная С-цепь (родоначальная структура) нумеруется так, чтобы номера были наименьшими:
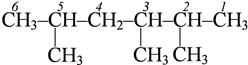 2,3,5 – триметилпентан
2,3,5 – триметилпентан
| 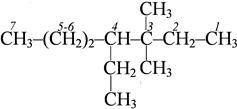 3,3 – диметил – 4 – этилгептан
3,3 – диметил – 4 – этилгептан
|
Непредельные ациклические углеводороды содержат кратные связи, наличие которых обозначают путем замены суффикса - ан на - ен (при двойной связи С=С), на - ин (при тройной связи С≡С).
Соединения, имеющие как двойные, так и тройные связи, получают названия путем замены суффикса –ан в названии соответствующего алкана на - енин, - адиенин, - атриенин, - ендин и т.п. Кратным связям должны соответствовать низкие цифровые обозначения, а двойным связям присваивают наименование номера:
|
| ||
|
Одновалентные радикалы непредельных ациклических углеводородов:
|
|
CH2=CH– винил-
CH2=CH–CH2– аллил-
HC≡C– этенил
Циклопропан
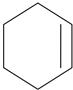 циклогексен
циклогексен
|
Одновалентные радикалы, образованные из циклоалканов, называют, заменяя суффикс – ан на – ил. Атом углерода, несущий свободную валентность, обозначают номером 1.
 циклопропил- циклобутил- циклопентил-
циклопропил- циклобутил- циклопентил-
|
Моноциклические и полициклические ароматические углеводороды (арены) имеют тривиальные названия, использование которых разрешено правилами ИЮПАК:
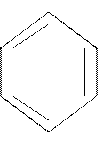 бензол
бензол
| CH3
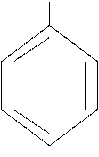 толуол
толуол
| 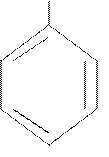 CH3
ксилол CH3
ксилол
| 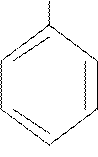 CH=CH2
стирол CH=CH2
стирол
|
Прочие моноциклические ароматические углеводороды называют как производные бензола. Положения заместителей указывают цифрами, за исключением случаев, когда при наличии двух заместителей вместо
1,2-; 1,3- и 1,4- могут быть использованы обозначения о- (орто-); м- (мета-); п- (пара-) соответственно:
CH3
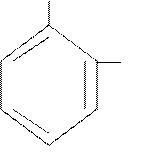 CH3
1,2 – диметилбензол
(о-ксилол)
CH3
1,2 – диметилбензол
(о-ксилол)
| 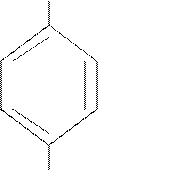 CH=CH2
CH2–CH3
4-этилстирол
(п-этилстирол) CH=CH2
CH2–CH3
4-этилстирол
(п-этилстирол)
|
Одновалентные радикалы моноциклических ароматических углеводородов:
|
| ||
|
| ||
| и т.д. |
Спирты и фенолы
При назывании спиртов по заместительной номенклатуре группа –OH рассматривается как главная и обозначается суффиксом – ол (- диол, - триол, -т етраол и т.д.), нумерация осуществляется с таким расчетом, чтобы группа –OH получила меньший номер:
|
|
|
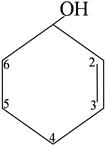 циклогексен-2-ол-1
циклогексен-2-ол-1
|
Для некоторых спиртов сохранены тривиальные названия:
CH2=CH–CH2OH - аллиловый спирт
C6H5–CH2OH - бензиловый спирт
 OH
CH2OH - салициловый спирт OH
CH2OH - салициловый спирт
|
CH2 (OH)–CH2OH - этиленгликоль
CH2 (OH) – CH (OH)–CH2OH - глицерин
Для простых фенолов сохранены тривиальные названия:
OH
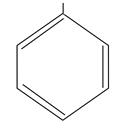 фенол
фенол
| OH
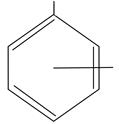 CH3
о-,м-, н-крезолы
CH3
о-,м-, н-крезолы
| CH3
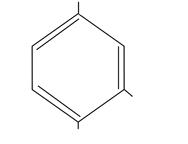 OH
OH
 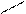 CH
CH3 CH3
тимол CH
CH3 CH3
тимол
|
OH
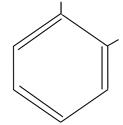 OH
пирокатехин
OH
пирокатехин
| OH
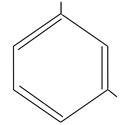 OH
резорцин
OH
резорцин
| OH
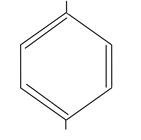 OH
гидрохинон
OH
гидрохинон
|
OH
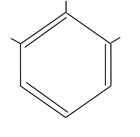 HO OH
пирогаллол
HO OH
пирогаллол
| OH
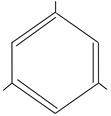 HO OH
флороглюцин
HO OH
флороглюцин
|
Карбоновые кислоты
Карбоксильная группа в молекулах алифатических кислот должна получать наименьший номер и обозначается она суффиксом – овая кислота:
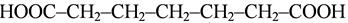 гептандиовая кислота
гептандиовая кислота
|
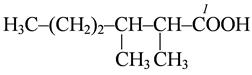 2,3-диметилгексановая кислота
2,3-диметилгексановая кислота
|
Если группа –COOH рассматривается как заместитель (и не входит в родоначальную структуру), то она получает название – карбоновая кислота:
|
|
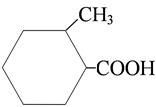 2-метилциклогексанкарбоновая кислота
2-метилциклогексанкарбоновая кислота
|
Карбоксигруппу обозначают приставкой карбокси - если в соединении присутствует другая группа, имеющая преимущество в перечислении:
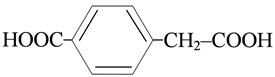 п-карбоксифенилуксусная кислота
п-карбоксифенилуксусная кислота
|
1.3. Электронное строение органических соединений
В составе органических соединений чаще всего находят следующие элементы: C, O, H, N, S, P, которые получили название элементов – органогенов.
Электронное состояние углерода (невозбужденное) – 1S2 2S2 2P2, при переходе в возбужденное состояние - 1S2 2S1 2P3.
Интерес представляют S и P орбитали, поскольку валентные электроны углерода и элементов-органогенов находятся на них.
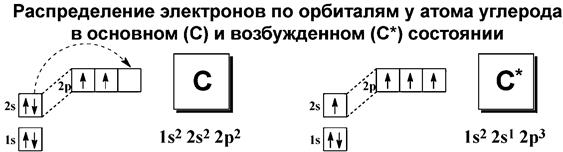
Гибридизация орбиталей – смешение нескольких атомных орбиталей различной формы и близкой энергии с образованием такого же числа новых гибридных орбиталей, расположение которых в пространстве соответствует геометрии молекулы. Гибридные орбитали за счет более эффективного перекрывания образуют более прочные связи по сравнению с негибридными.
В органических соединениях углерод может находиться в одном из трех валентных состояний:
I валентное состояние – sp3-гибридизация, при которой происходит смешивание I S и 3 p-орбиталей, с возникновением 4-х гибридизованных орбиталей, расположенных в пространстве под углом 109º28´ по отношению друг к другу. Углерод в таком состоянии получил название тетрагонального атома углерода и встречается в предельных органических соединениях.
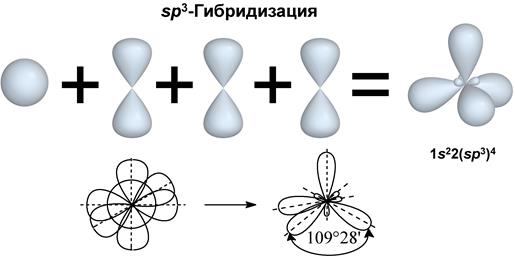
sp3-гибридные орбитали направлены в пространстве к вершинам тетраэдра (тетраэдрическая конфигурация).
II валентное состояние – sp2-гибридизация, при которой происходит смешивание I S и 2 p-орбиталей, с возникновением 3-х гибридизованных орбиталей, расположенных в одной плоскости под углом 120º по отношению друг к другу. Негибридизованная p-орбиталь расположена перпендикулярно плоскости гибридизованных орбиталей. Углерод в таком состоянии называют тригональным и встречается он в соединениях с двойными связями (атом C в алкенах, карбонильной и карбоксильной группах).
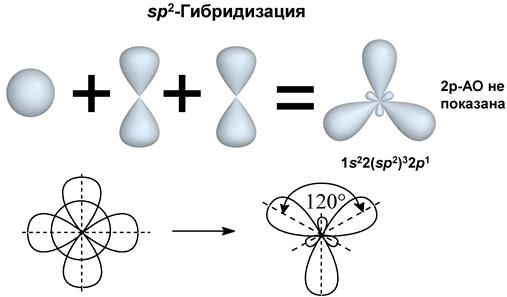
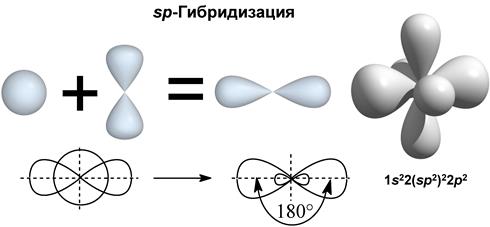
III валентное состояние – sp-гибридизация, при которой происходит смешивание I S и 1p-орбитали с возникновением 2-х гибридизованых орбиталей, расположенных в пространстве под углом 180º (линейно), а две негибридизованые p-орбитали расположены взаимно перпендикулярно друг другу. Sp-гибридизация характерна для углерода, связанного тройной связью или двумя двойными связями.
|
|
Если углерод образует одну углерод-углеродную связь, то его называют первичным, если две углерод-углеродные связи − то вторичным; если три углерод-углеродные связи – то третичным; если четыре углерод-углеродные связи – то четвертичным.
Например:
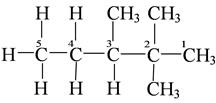
|
1-й и 5-й углероды – первичные; 4-й – вторичный; 3-й – третичный;
2-ой – четвертичный.
Кратные связи
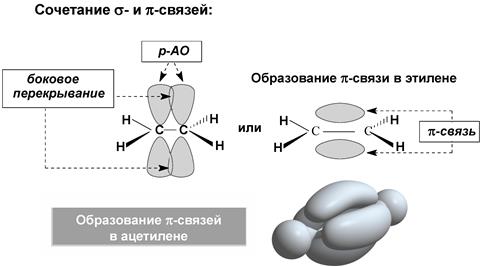
Сопряжение
Молекулы с чередующимися двойными π и простыми σ связями называют сопряженными системами.
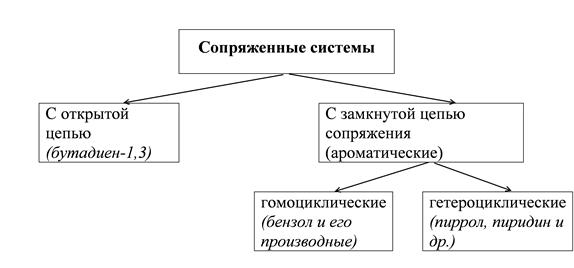
Сопряжение – это перераспределение электронной плотности в системе π – связей, приводящее к стабилизации молекулы.
Энергия сопряжения – это уменьшение энергии молекулы благодаря сопряжению.
Открытые системы сопряжения
Бутадиен-1,3, каждый из четырех углеродов в состоянии sp2-гибридизации, у каждого углерода – по одной свободной p-орбитали. В результате бокового перекрывания орбиталей происходит сопряжение двух локализованных двойных связей с образованием делокализованной четырехцентровой молекулярной орбитали. Этот вид сопряжения называют π-π-сопряжение. Есопряж. = 250 кДж/моль – 235 кДж/моль = 15 кДж/моль. Наблюдается выравненность электронных плотностей в результате делокализации электронов, создание единого электронного облака.
Делокализация электронов в циклических соединениях приводит к возникновению ароматических систем.
Правила ароматичности.
1. Наличие плоского цикла (кольца), состоящего из sp2-гибридизованных атомов, образующих σ-скелет (молекула копланарна).
2. Делокализация электронов, приводящая к образованию единого электронного облака (π-секстет).
3. Подчинение правилу Э. Хюккеля, т.е. электронное облако должно насчитывать (4n+2) π-электронов, где n=1,2,3,4…
4. Высокая степень термодинамической устойчивости (энергия сопряжения).
Гомоциклические ароматические системы.
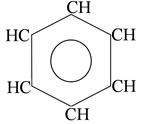 бензол
n=1
6ē делокализовано в
π- секстет
бензол
n=1
6ē делокализовано в
π- секстет
| 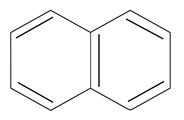 нафталин
n=2
10ē делокализовано
нафталин
n=2
10ē делокализовано
| |
|
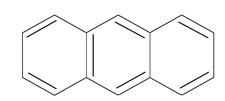
антрацен
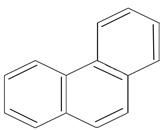
фенантрен n=3 14ē делокализовано | ||
Виды изомерии
| структурная | пространственная | |
| · цепи (скелета) · положения заместителей или кратных связей · взаимного расположения заместителей в кольце · межклассовая | · геометрическая · оптическая (стереоизомерия) · поворотная |
Пространственная изомерия
· геометрическая – обусловлена различным расположением заместителей вокруг двойных связей или относительно плоскости циклов).
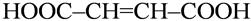
  бутен -2- диовая кислота бутен -2- диовая кислота
|
|
|
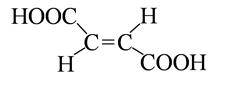 транс-форма
(фумаровая кислота)
транс-форма
(фумаровая кислота)
|
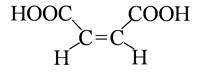 цис-форма
(малеиновая кислота)
цис-форма
(малеиновая кислота)
|
Это конфигурационные изомеры, которые не могут быть превращены друг в друга без разрыва ковалентных связей.
· Оптическая изомерия
Стереоизомерия связана с различным расположением в пространстве атомов и атомных групп вокруг асимметрического углеродного атома.
Асимметрический атом углерода – это углерод, все четыре валентности которого замещены различными заместителями.
Хиральность – свойство предмета быть неидентичным своему зеркальному отображению (от греч. cheir – рука). Молекулы тоже могут быть хиральными и ахиральными.
Простейший случай хиральности – наличие в молекуле центра хиральности, которым является асимметрический атом углерода.
Вследствие хиральности некоторые молекулы существуют в виде пары стереоизомеров – энантиомеров.
Энантиомеры – это стереоизомеры, относящиеся друг к другу как предмет и его зеркальное отражение, различные по абсолютной и относительной конфигурации, биологическим свойствам, но обладающие одинаковыми физическими и химическими свойствами.
Гомолиз связи
v Образующиеся промежуточные частицы – свободные радикалы
Гетеролитический (ионный)

Гетеролиз связи
v Образующиеся органические промежуточные частицы
- карбокатионы (с положительным зарядом на атоме углерода) или
- карбоанионы (с отрицательным зарядом на атоме углерода)
Классификация реакций
1. По характеру изменения связей в субстрате и реагенте
(а) Гомолитические реакции
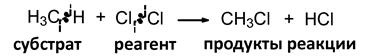
(б) Гетеролитические реакции
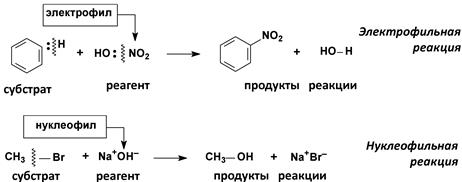
2. По направлению (конечному результату)
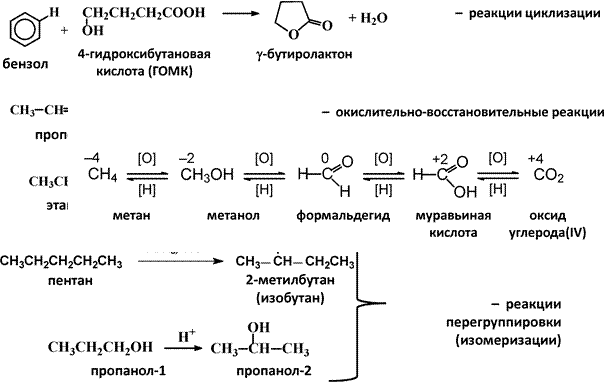 |
v Изменение степени окисления углерода, выступающего в роли
реакционного центра
3. По числу молекул (частиц), участвующих в стадии, определяющей общую скорость реакции
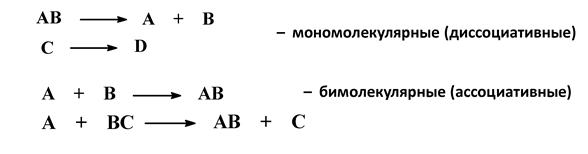
Методики выполнения общих качественных реакций
на функциональные группы
Бромирование бромной водой
В пробирку поместите 2 капли бромной воды, добавьте 2–3 капли исследуемого раствора, встряхните пробирку.
Внешние признаки:
Наблюдается обесцвечивание желтого раствора бромной воды.
2. Реакция гидроксилирования (реакция Вагнера)
В пробирку поместите 2 капли 0,1н KMnO4, добавьте 2–3 капли исследуемого раствора, встряхните пробирку.
Внешние признаки:
Наблюдается обесцвечивание розового раствора KMnO4 и выпадение бурого осадка MnO2.
ОСНОВЫ БИООРГАНИЧЕСКОЙ ХИМИИ
 Объекты биоорганической химии
Объекты биоорганической химии Убывание старшинства группы
Убывание старшинства группы метокси-
метокси-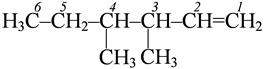 3,4 – диметилгексен -1
3,4 – диметилгексен -1
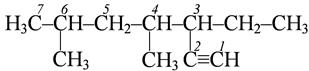 4,6- диметил -3- этилгептин -1
4,6- диметил -3- этилгептин -1
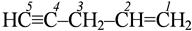 пентен -1- ин -4
пентен -1- ин -4
 фенил-
фенил-
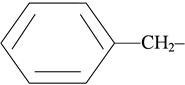 бензил-
бензил-
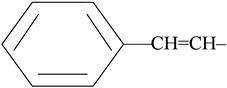 стирил-
стирил-
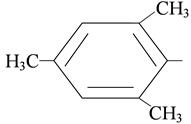 мезитил-
мезитил-
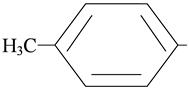 n- толил-
n- толил-
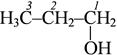 пропанол-1
пропанол-1
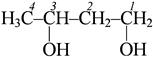 бутандиол-1,3
бутандиол-1,3
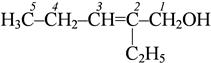 2-этилпентен-2-ол-1
2-этилпентен-2-ол-1