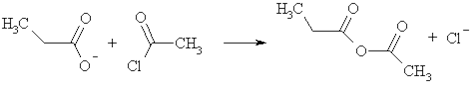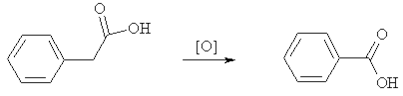Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Замещение водорода в карбоксиле: кислотность и реакции по кислороду ⇐ ПредыдущаяСтр 3 из 3
На степень диссоциации кислот большое влияние оказывает полярность растворителя. Максимальная степень диссоциации наблюдается в воде: рКа муравьиной кислоты составляет 3.75, уксусной - 4.8 Для замещенных жирных карбоновых кислот степень диссоциации сильно зависит от электронного эффекта заместителя при a-углеродном атоме, электронокцепторные заместители повышают кислотность.
Карбоновые кислоты образуют соли, реагируя с металлами, их оксидами и гидроксидами, аммиаком и аминами, вытесняют более слабые кислоты из солей.
Карбоновые кислоты реагируют с карбонатами металлов (почти все они сильнее, чем H2CO3), реактивами Гриньяра, ацетиленидами и гидридами металлов. В результате всех этих обменных реакций образуются соли кислот, имеющие общее название карбоксилаты и собственные названия, соответствующие названию аниона кислоты: формиаты, пропионаты, бутираты, бензоаты. Натриевые и калиевые соли высших жирных кислот называются мылами, т.к. являются поверхностно-активными веществами. Анионы карбоновых кислот участвуют в реакциях нуклеофильного замещения, выступая в качестве нуклеофилов. Так, с галогеналканами они образуют сложные эфиры.
Низшие кислоты, обладающие сравнительно высокой кислотностью, превращаются при действии на них диазометаном в метиловые эфиры. В этом превращении протон кислоты сначала переходит к атому углерода молекулы диазометана, т.е. последний реагирует как основание. Образующийся неустойчивый катион метилдиазония распадается с выделением N2, вследствие чего возникает метилениевый ион, который и соединяется с анионом кислоты.
Взаимодействие солей карбоновых кислот с ацилгалогенидами приводит к образованию ангидридов кислот. Таким способом могут быть получены смешанные ангидриды.
Основность
Замещение гидроксила В молекулах карбоновых кислот возможно замещение гидроксильной группы, что используется для получения различных функциональных производных. Превращение протекает при действии нуклеофилов. Однако, большинство сильных нуклеофилов являются основаниями, поэтому они в первую очередь депротонируют карбоксильную группу, т.е. превращают кислоту в анион. В карбоксилат-ионе атом углерода не обладает необходимым дефицитом электронной плотности, и реакция останавливается. Применение более слабых нуклеофилов также не приводит к положительным результатам, так как электрофильность карбоксильного углерода кислоты меньше, чем в оксосоединениях, т.к. она погашается +М-эффектом гидросильного кислорода. К примеру, слабый нуклеофил - гидросульфит натрия - к карбоксильной группе не присоединяется.
Поэтому для нуклеофильного замещения гидроксильной группы (реакции ацилирования) подбирают специальные условия. Так, реакцию кислот со спиртами для получения сложных эфиров (этерификация кислот) проводят в присутствии серной кислоты или газообразного хлороводорода, которые выполняют роль катализаторов. Катализ заключается в протонировании карбонильного атома кислорода на первой стадии, что повышает эффективный положительный заряд на углероде и облегчает атаку нуклеофила. На одной из последующих стадий происходит протонирование уже гидроксила и превращение его в хорошую уходящую группу - молекулу H2O.
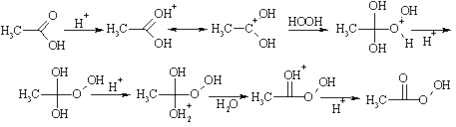
Все стадии реакции этерификации обратимы, поэтому для получения сложного эфира с хорошим выходом необходимо удалять выделяющуюся воду. В классическом варианте синтеза для связывания воды используется та же серная кислота; в других случаях применяют избыток нуклеофила (спирта). Очевидно, что реакция, если рассматривать ее с другой стороны, протекает как замещение в молекуле спирта атома водорода на ацил, поэтому превращение называют ацилированием спирта. Оно относится к большому классу реакций, которые объединены общим названием "реакции ацилирования". По аналогичному механизму протекает взаимодействие карбоновых кислот с пероксидом водорода в кислой среде. В результате этой реакции получаются так называемые надкислоты, имеющие важное значение для органического синтеза: они используются в качестве источников свободных радикалов и окислителей.
В рассмотренных примерах гидроксил путем протонирования превращается в хорошую уходящую группу - молекулу воды, а на первой стадии имеет место активация электрофильного центра кислотой. Аналогично, ацилирование катализируется кислотами Льюиса. Так, при действии на кислоты пентахлорида фосфора или тионилхлорида происходит замещение гидроксильной группы хлором и образуются хлорангидриды кислот. В ходе превращения протон замещается на сильный акцептор электронов, превращающий гидроксил в хорошую уходящую группу.
Однако нужно иметь в виду, что атомы кислорода в этих реакциях меняются местами, т.е. фактически замещается не гидроксильный, а карбонильный, т.к. именно к нему присоединяется кислота Льюиса на первой стадии. Аналогично, превращение кислот в ангидриды при действии пентаоксидом фосфора идет через стадию замещены карбонила на хорошую уходящую группу.
Гидроксил не удается заместить аминогруппой при действии аммиака или аминов на кислоту в мягких условиях. Указанные реагенты являются более сильными основаниями, чем карбонильная группа. Поэтому катализ кислотами, как в реакции этерификации, или замена протона сильным электроноакцептором, как при образовании ацилгалогенидов и ангидридов, в этом случае невозможны. Аммиак и амины образуют соли с карбоновыми кислотами, а карбоксилат-ион электрофилом не является. Тем не менее, при высокой температуре карбоксилаты аммония превращаются в амиды. Это объясняется тем, что соль диссоциирует при нагревании на кислоту и аммиак (амин), который как нуклеофил атакует карбоксильный атом углерода, но процесс этот требует жестких условий.
Можно сказать, что данная реакция идет благодаря термодинамическому фактору: возрастание энтальпии за счет образования стабильного амида и возрастание энтропии за счет образования газообразной в этих условиях воды. Восстановление
Восстановление карбоксильной группы осуществляется действием натрия в спирте (реакция Буно-Блава) или алюмогидридом лития. В обоих случаях восстановление завершается образованием спиртовой молекулы.
Нужно иметь в виду, что восстановление кислот всегда протекает труднее, чем их производных, поэтому на практике превращение группы COOH в CH2OH чаще всего проводят через стадию хлорангидрида или сложного эфира.
Окисление
Карбоновые кислоты вообще устойчивы к действию окислителей. Лишь муравьиная кислота, которую можно рассматривать как кислоту и альдегид одновременно, легко окисляется, и ее соли иногда используют в качестве восстановителей, например, для превращения нитрилов в альдегиды.
Другим исключением являются арилзамещенные алифатические кислоты, типа фенилуксусной, которые окисляются до бензойных с разрывом С-С связи.
Декарбоксилирование
Термическое декарбоксилирование кислот используется для получения алканов - происходит замена карбоксила на водород. В то же время, разложение солей карбоновых кислот в зависимости от условий проведения реакции приводит к образованию продуктов различного строения - могут быть получены как алканы, так и кетоны (из кальциевых солей). Наконец, электролитическое восстановление (реакция Кольбе), тоже сопровождающееся выделением CO2, приводит к алканам димерного строения.
|
||||||||||||||||
|
Последнее изменение этой страницы: 2020-03-13; просмотров: 232; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.149.251.155 (0.012 с.) |