
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Матеріальний розрахунок безсатураторного методу отримання сульфату амонію
Вихідні дані: Склад прямого коксового газу: Водяні пари 30,0 г/м3 Бензольні вуглеводні 36,0 г/м3 Аміак 7,0 г/м3 Сірководень 16,0 г/м3 Піридинові основи 0,4 г/м3 Склад сухого коксового газу: H2 – 60,0 % CO – 7,0 % CO2 – 2,7 % CnHm – 2,3 % N2 – 4,0 % O2 – 1,0 % CH4 – 22,0 % Вміст аміаку у очищеному коксовому газі – 0,03 г/м3 Проектна потужність заводу по газу – 52000 м3/год Перераховую кількість компонентів, які містяться у 52000 м3/год коксового газу за формулою:
Gкомп.=
де Vк.г.- кількість коксового газу - 52000 м3/год gкомп.- кількість компоненту г, у 1 м3 Gв.п.= 52000×30/1000=1560 кг/год. Gб.в.= 52000×36/1000=1872 кг/год. Gам.= 52000×7/1000=365 кг/год. Gс=52000×16/1000=832 кг/год. Gп.о.= 52000×0,4/1000=20,8 кг/год. Об’єм складових коксового газу розраховую за формулою: Vi=Gi×22,4/M (5.2) де Gi - кількість компонента Mi - молекулярна масса компонента Vв= Gв×22,4/Мв=1560×22,4/18=1941,3 м3/год Vб= Gб×22,4/Мб=1872×22,4/83=505,2 м3/год Vс= Gс×22,4/Мс= 832×22,4/34=548,1 м3/год Vа= Gа×22,4/Ма=365×22,4/17=480,9 м3/год Vп= Gп×22,4/Мп=20,8×22,4/80=6 м3/год Об’єм сухого коксового газу розраховую за формулою:
де Vк.г.- об’єм коксового газу, м3/год,
Vс.г.= 52000-(1941,3+505,2+548,1+480,9+6)=48518,5 м3/год. Gс.г.= ρс.г×Vс.г. (5.4) де ρс.г. – густина сухого коксового газу кг/м3, ρс.г=0,401 кг/м3[1] Vс.г. – об’єм сухого коксового газу м3/год. Gс.г.=0,401×48518,5=19456 кг/год У абсорбер надходить наступна кількість коксового газу з нагнітача (табл.5.1).
Таблиця 5.1 Склад коксового газу, що входить до абсорбера
Кількість сірчаної кислоти, яка необхідна для нейтралізації 365 кг/год аміаку розраховуємо за рівнянням хімічної реакції, на основі закону еквівалентів:
2NН3 + Н2SO4 = (NН4)2SO4 (5.5)
За умовою νNH3=mNH3/MNH3=365000/17=21470,6 моль/год де mNH3 - маса аміаку, що поступає в абсорбер з газом 365 кг/год=365000 г/год; MNH3-молекулярна масса аміаку 17 г/моль Відповідно до рівняння реакції 1 моль Н2SO4 реагує з 2 моль NН3, а з 21470,6 моль/год NН3 реагують 10735,3 моль Н2SO4 або 10735,3×98=1052059,4 г/год=1052,1 кг/год Кількість 92,5 %-ої кислоти: GH2SO4=1052,1 /0,925=1137,4 кг/год.
Кількість поглинутого аміаку на першому ступеню абсорберу можна визначити виходячи з умови рівняння поверхні контакту чи об’ємів обох ступенів абсорберів та коефіцієнтів абсорбції, що приводить до рівняння:
де а1, а2,та а3 – вміст аміаку у газі до першої,до другої та після другої ступені абсорберу. Величина а1 дорівнює 7 г/м3 Величину a3 приймаю згідно ПТЕ 0,03 г/м3. [2] Тоді
Таким чином, на першому ступені абсорберу поглинається аміаку
Залишається аміаку в коксовому газі:
Надходить аміаку на другу ступінь 365-340 =25 кг/год та поглинається аміаку на другій ступені 25-1,6=23,4 кг/год. Для поглинання 340 кг/год аміаку на першому ступеню абсорберу необхідно витратити сірчаної кислоти у моногідраті [6]:
де
При цьому утворюється сульфату амонію 340+980=1320 кг/год. На другому ступеню поглинається аміаку 23,4 кг/год, витрачається сірчаної кислоти:
та утворюється сульфату амонію 23,6+68=91,6 кг/год. Таким чином, накопичується сульфату амонію у матковому розчині на другому ступені абсорберу 91,6 кг/год. Загальна кількість сульфату амонію, яка утворюється 1320+91,6=1411,6 кг/год, а з вологістю 2%
|
|||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2020-03-02; просмотров: 127; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.142.197.212 (0.008 с.) |
 , (5.1)
, (5.1) (5.3)
(5.3) - сума кількості компонентів коксового газу.
- сума кількості компонентів коксового газу. (5.6)
(5.6)
 =
= 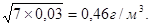


 (5.7)
(5.7) - кількість аміаку, яка поглинається на першому ступеню абсорберу
- кількість аміаку, яка поглинається на першому ступеню абсорберу - молекулярна маса сірчаної кислоти
- молекулярна маса сірчаної кислоти - молекулярна маса аміаку.
- молекулярна маса аміаку.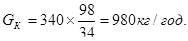

 .
.


