Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Двухмембранные органоиды. Строение митохондрий. Ферменты внутренней мембраны митохондрий. Происхождение и функции митохондрий
К двумембранным органоидам относятся митохондрии и пластиды. Митохондрии – это двумембранные органоиды, главная функция которых – аэробное дыхание. Строение митохондрий
Митохондрии, или хондриосомы (от греч. mitos — нить, chondrion — зернышко, soma — тельце), представляют собой гранулярные или нитевидные органеллы, присутствующие в цитоплазме простейших, растений и животных (рис. 198). Митохондрии можно наблюдать в живых клетках, так как они обладают достаточно высокой плотностью. В живых клетках митохондрии могут двигаться, перемещаться, сливаться друг с другом. Особенно хорошо митохондрии выявляются на препаратах, окрашенных различными способами после осмиевой фиксации, которая хорошо стабилизирует липиды. Наиболее широко распространен метод окраски по Альтману, который описал эти клеточные органеллы в конце позапрошлого века, называя их «биобластами».
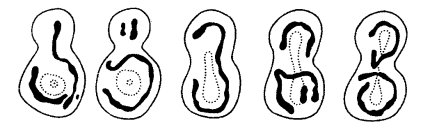
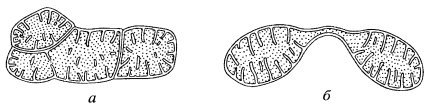
Размеры митохондрий, как и их форма, очень непостоянны у разных видов (рис. 199). Все же у большинства клеток толщина этих структур относительно постоянна (около 0,5 мкм), а длина колеблется, достигая у нитчатых форм до 7—60 мкм. Надо сказать, что изучение величины митохондрий — не простое дело. В световом микроскопе на окрашенных препаратах не всегда можно проследить за реальными размерами митохондрий (рис. 200 и 201, а). Изучая митохондрии с помощью электронного микроскопа на ультратонких срезах, трудно решить вопрос об истинной длине митохондрий, так как на срез попадает только незначительный объем данной митохондрии. Более того, на срезе одна извитая митохондрия может быть представлена несколькими сечениями (3—5), и только пространственная трехмерная реконструкция, построенная на изучении серийных срезов, может решить вопрос, имеем ли мы дело с 3—6 отдельными митохондриями или же с одной изогнутой или разветвленной. Выделенные митохондрии обычно повреждаются и фрагментируются, что также ограничивает использование этого метода для решения вопроса о величине и числе митохондрий.
В последнее время вопрос о величине и числе митохондрий занимает многих исследователей в связи с тем, что на ряде объектов показано: размеры и число митохондрий, которые видны на ультратонких срезах, не соответствуют реальности. Так, в клетках дрожжей на срезах выявляется 5-7 сечений митохондрий; можно высчитать, что это число соответствует нескольким десяткам митохондрий. Однако при использовании высоковольтной электронной микроскопии, позволяющей исследовать объекты толщиной до нескольких микрон, было обнаружено, что в клетках дрожжей есть всего лишь несколько (1—3) сильно разветвленных митохондрий (рис. 202). Есть данные, что число митохондрий и для других клеток завышено из-за сложности структуры разветвленных митохондрий. Более того, появились представления о том, что в одноклеточных организмах есть всего одна митохондрия, но сильно разветвленная. Например, у трипаносом в клетке присутствует одна гигантская митохондрия, имеющая сложную разветвленную форму.
Гигантские одиночные митохондрии были описаны для одноклеточных зеленых водорослей (Polytomella, Euglena, Chlorella) (рис. 203). Длинные ветвящиеся митохондрии описаны в клетках культуры ткани млекопитающих, в клетках многих растений как в нормальных, так и в анаэробных условиях. В последнее время стал широко применяться для изучения свойств митохондрий флуорохром родамин. Этот краситель обладает способностью люминесцировать в фиолетовом свете, если он связывается с мембранами активных митохондрий. При этом в люминесцентном микроскопе видна единая митохондриальная система — митохондриальный ретикулум (см. рис. 200 и 201, а).
Обычные подсчеты показывают, что на печеночную клетку приходится около 200 митохондрий. Это составляет более 20% от общего объема цитоплазмы и около 30-35% от общего количества белка в клетке. Площадь поверхности всех митохондрий печеночной клетки в 4—5 раз больше поверхности ее плазматической мембраны. Больше всего митохондрий в ооцитах (около 300 000) и у гигантской амебы Chaos chaos (до 500 000).
В клетках зеленых растений число митохондрий меньше, чем в клетках животных, так как часть их функций могут выполнять хлоропласты. В спермиях часто присутствуют гигантские митохондрии, спирально закрученные вокруг осевой части жгутика. Отсутствуют митохондрии у кишечных энтамеб, живущих в условиях анаэробиоза, и у некоторых других паразитических простейших. Локализация митохондрии в клетках может быть различной. Часто их расположение обусловлено топографией цитоплазматических структур и включений. Так, в дифференцированных клетках растений митохондрии большей частью расположены в периферических участках цитоплазмы, отодвинутых к плазматической мембране центральной вакуолью. В мало дифференцированных клетках меристемы растений митохондрии располагаются более или менее равномерно. В клетках эпителия почечных канальцев митохондрии ориентированы вдоль продольной оси клетки. Это связано с тем, что они располагаются между глубокими впячиваниями плазматической мембраны в базальной области клеток (рис. 204).
Обычно митохондрии скапливаются вблизи тех участков цитоплазмы, где возникает потребность в АТФ, образующейся в митохондриях. Например, в скелетных мышцах митохондрии находятся вблизи миофибрилл. В сперматозоидах митохондрии образуют спиральный футляр вокруг оси жгутика; вероятно, это связано с необходимостью использования АТФ для движения хвоста сперматозоида. Аналогичным образом у простейших и в других клетках, снабженных ресничками, митохондрии локализуются непосредственно под клеточной мембраной у основания ресничек, для работы которых необходим АТФ. В аксонах нервных клеток митохондрии располагаются около синапсов, где происходит процесс передачи нервного импульса. В секреторных клетках, которые синтезируют большие количества белков, митохондрии тесно связаны с зонами эргастоплазмы; вероятно, они поставляют АТФ для активации аминокислот и синтеза белка на рибосомах.
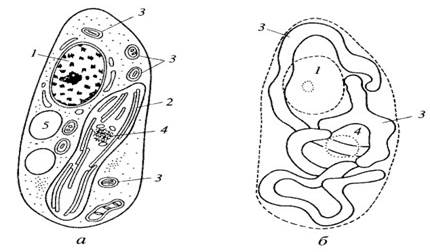
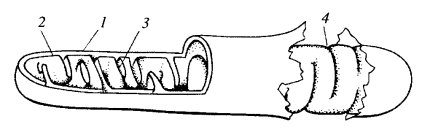
Ультраструктура митохондрий Митохондрии независимо от их величины или формы имеют универсальное строение, их ультраструктура однообразна. Митохондрии ограничены двумя мембранами (рис. 205). Наружняя митохондриальная мембрана отделяет ее от гиалоплазмы. Обычно она имеет ровные контуры, не образует впячиваний или складок. На нее приходится около 7% от площади всех клеточных мембран. Толщина этой мембраны около 7 нм, она не бывает связана ни с какими другими мембранами цитоплазмы и замкнута сама на себя, так что представляет собой мембранный мешок. Наружную мембрану от внутренней отделяет межмембранное пространство шириной около 10—20 нм. Внутренняя мембрана (толщиной около 7 нм) ограничивает собственно внутреннее содержимое митохондрии, ее матрикс, или митоплазму. Характерной чертой внутренних мембран митохондрий является их способность образовывать многочисленные впячивания внутрь митохондрий. Такие впячивания чаще всего имеют вид плоских гребней, или крист (рис. 206 и 207, а).
Общая поверхность внутренней мембраны митохондрии в печеночной клетке составляет примерно треть поверхности всех клеточных мембран. Митохондрии клеток сердечной мышцы содержат втрое больше крист, чем печеночные митохондрии. Это может отражать различия в функциональных нагрузках митохондрий разных клеток. Расстояние между мембранами в кристе составляет около 10-20 нм. На срезах связь мембраны крист с внутренней мембраной прослеживается очень отчетливо, но мест таких мембранных переходов немного. Это объясняется тем, что связь между мембранами осуществляется через узкую шейку, или стебелек. Митохондриальные кристы, отходящие от внутренней мембраны и простирающиеся в сторону матрикса, обычно не полностью перегораживают полость митохондрии, не нарушают непрерывности заполняющего ее матрикса. Ориентация крист по отношению к длинной оси митохондрии различна для разных клеток. Так, может быть перпендикулярная ориентация (клетки печени, почек) крист; в некоторых клетках (сердечная мышца) наблюдается продольное расположение крист. Часто кристы могут ветвиться или образовывать пальцевидные отростки, изгибаться и не иметь выраженной ориентации (рис. 208). У простейших, одноклеточных водорослей, в некоторых клетках высших растений и животных выросты внутренней мембраны имеют вид трубок (трубчатые кристы).
Матрикс митохондрий имеет тонкозернистое гомогенное строение, в нем иногда выявляются тонкие собранные в клубок нити (около 2—3 нм) и гранулы около 15—20 нм. Известно, что нити матрикса митохондрий представляют собой молекулы ДНК в составе митохондриального нуклеоида, а мелкие гранулы — митохондриальные рибосомы. Кроме того, в матриксе встречаются крупные (20—40 нм) плотные гранулы, это — места отложения солей магния и кальция. Функции митохондрий Митохондрии осуществляют синтез АТФ, происходящий в результате процессов окисления органических субстратов и фосфорилирования АДФ. В клетках окисление и выделение энергии, освобождающейся в результате этого процесса, проходят в несколько взаимосвязанных этапов. При этом в качестве начальных субстратов используются различные углеводы, жирные кислоты, аминокислоты. Первые этапы окисления приводят кроме образования АТФ к появлению промежуточных продуктов, конечное окисление которых в митохондриях дает возможность клетке использовать этот процесс для синтеза основного количества АТФ. Начальные этапы окисления углеводов происходят в гиалоплазме и не требуют участия кислорода. Поэтому они называются анаэробным окислением, или гликолизом. Главным субстратом окисления при анаэробном получении энергии служат гексозы и в первую очередь глюкоза; некоторые бактерии обладают свойством извлекать энергию, окисляяя пентозы, жирные кислоты или аминокислоты. В глюкозе количество потенциальной энергии, заключенной в связях между атомами С, Н и О, составляет около 680 ккал на 1 моль (т.е. на 180 г глюкозы); эта энергия освобождается при полном окислении глюкозы согласно следующей реакции: С6Н12О6 + 6О2 → 6Н2О + 6СО2 + 680 ккал. В живой клетке это огромное количество энергии не освобождается одновременно, как при горении в пламени. Освобождение энергии идет в виде ступенчатого процесса, управляемого целым рядом окислительных ферментов, и не связано с переходом энергии химической связи в тепло, как при горении, а с переходом ее в макроэнергетическую связь в молекуле АТФ, которая синтезируется при использовании освобождающейся энергии из АДФ и фосфата. В процессе гликолиза происходит неполное окисление субстрата. В результате гликолиза глюкоза распадается до триоз, при этом тратятся 2 молекулы АТФ и синтезируются 4 молекулы АТФ. Так что в конечном результате клетка «зарабатывает» всего 2 молекулы АТФ. В энергетическом отношении этот процесс малоэффективен, поэтому из 680 ккал, заключающихся в связях 1 моля глюкозы, освобождается менее 10% энергии. Несмотря на низкий энергетический выход, анаэробное окисление — гликолиз, широко используется в живой природе. Он является основным поставляющим энергию процессом для многих микроорганизмов, некоторых кишечных паразитических анаэробных простейших, для клеток высших организмов на ранних стадиях эмбрионального развития, для многих опухолевых клеток, для клеток культуры ткани и др. Эритроциты млекопитающих, например, получают всю необходимую им энергию за счет гликолиза, так как у них нет митохондрий. Образовавшиеся в результате гликолиза триозы, в первую очередь пировиноградная кислота, вовлекаются в дальнейшее окисление, осуществляющееся уже в самих митохондриях. При этом происходит использование энергии расщепления всех химических связей, что приводит к выделению СО2, к потреблению кислорода и синтезу большого количества АТФ. Эти процессы связаны с окислительным циклом трикарбоновых кислот и с дыхательной цепью переноса электронов, где совершаются фосфорилирование АДФ и синтез клеточного «топлива» — молекул АТФ (рис. 209).
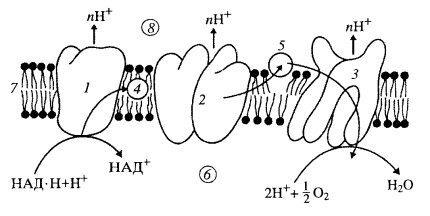
В цикле трикарбоновых кислот (цикл Кребса, или цикл лимонной кислоты) образовавшийся в результате гликолиза пируват сначала теряет молекулу СО2 и, окисляясь до ацетата (двууглеродное соединение), соединяется с коферментом А. Затем ацетилкоэнзим А, соединяясь с оксалацетатом (четырехуглеродное соединение), образует шестиуглеродный цитрат (лимоную кислоту). Далее происходит цикл окисления этого шестиуглеродного соединения до четырехуглеродного оксалацетата, который снова связывается с ацетилкоэнзимом А; затем цикл повторяется. При этом окислении выделяются две молекулы СО2, а электроны, освободившиеся при окислении, переносятся на акцепторные молекулы коферментов (НАД — никотинамидадениндинуклеотид), которые вовлекают их далее в цепь переноса электронов. Следовательно, в цикле трикарбоновых кислот нет самого синтеза АТФ, а идет окисление молекул, перенос электронов на акцепторы и выделение СО2. Все описанные выше события внутри митохондрий происходят в их матриксе. Выделенные митохондрии могут окислять пируват до СО2 и способны к синтезу АТФ. Если взвесь митохондрий подвергнуть воздействию ультразвука, то после разрыва митохондриальных мембран компоненты матрикса освобождаются и переходят в среду выделения. После такого разрушения можно осадить мембраны митохондрий и анализировать их функциональные активности. Во фракции, свободной от мембран, представляющей собой компоненты матрикса, обнаруживаются ферменты, участвующие в цикле трикарбоновых кислот. Следовательно, в матриксе локализованы ферменты этого цикла, которые находятся в свободном состоянии: они не связаны с митохондриальными мембранами, за исключением сукцинатдегидрогеназы. Кроме того, в состав матрикса входят ферменты окисления жирных кислот; основной продукт окисления жирных кислот — ацетилкоэнзим А (ацетил-КоА) — тоже в матриксе поступает в цикл трикарбоновых кислот, в котором он подвергается дальнейшему окислению до СО2 и Н2О. В матриксе митохондрий происходит также окисление некоторых аминокислот, поступающих в цикл трикарбоновых кислот. В остальных событиях, связанных с дальнейшим переносом электронов и синтезом АТФ, участвует внутренняя митохондриальная мембрана с кристами митохондрий. Освободившиеся в процессе окисления в цикле трикарбоновых кислот электроны, акцептированные на коферментах, переносятся затем в дыхательную цепь (цепь переноса электронов), где они соединяются с молекулярным кислородом, образуя молекулы воды. Дыхательная цепь представляет собой ряд белковых комплексов, встроенных во внутреннюю митохондриальную мембрану (рис. 210). Существуют три главных ферментных комплекса. Первый, НАД·Н-дегидрогеназный комплекс принимает электроны от НАД·Н и переносит их во второй комплекс — комплекс Ь—с1 который в свою очередь переносит их на цитохромоксидазный комплекс, а он их передает на кислород, в результате чего образуется вода. На этом окисление заканчивается.
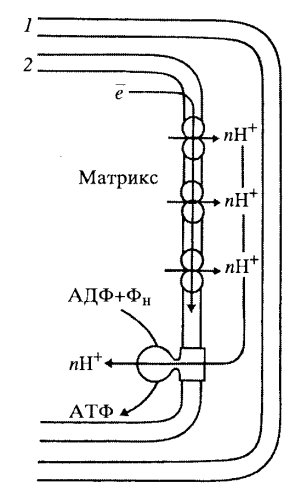
Как и полагается, окисление исходного субстрата привело к выделению СО2 и воды, но при этом не выделилась тепловая энергия, как при горении, а образовались молекулы АТФ. Они были синтезированы другой группой белков, не связанных прямо с окислением. Было найдено, что во внутренних митохондриальных мембранах, на поверхности мембран, смотрящих в матрикс, располагаются крупные белковые комплексы, ферменты, АТФ-синтетазы. В электронном микроскопе во фракции внутренних митохондриальных частиц видны так называемые грибовидные тельца, сплошь выстилающие поверхность мембран, смотрящую в матрикс. Эти тельца имеют как бы ножку и головку диаметром 8—9 нм. Эти тельца представляют собой белковый комплекс, состоящий из 9 субъединиц, — АТФ-синтетазу. Следовательно, во внутренних мембранах митохондрий локализованы ферменты как окислительной цепи, так и синтеза АТФ (см. рис. 201, 6). Дыхательная цепь — это главная система превращения энергии в митохондриях. В ней последовательно окисляются и восстановливаются элементы дыхательной цепи, в результате чего высвобождается небольшими порциями энергия. За счет этой энергии в трех точках этой цепи из АДФ и фосфата образуется АТФ. Поэтому говорят, что окисление (перенос электронов) сопряжено с фосфорилированием (АДФ + Фн → АТФ), т.е. происходит процесс окислительного фосфорилирования. В результате многократной оборачиваемости субстратов в цикле Кребса полностью окисляются поступившие продукты первичного гликолитического окисления. Затем в цепи окислительного фосфорилирования энергия, освободившаяся при окислении, максимально используется для синтеза АТФ. Было высказано предположение, что выделяющаяся при транспорте электронов энергия запасается в виде градиента протонов на мембране. При этом на внешней поверхности внутренней мембраны митохондрий возникает повышенная концентрация положительно заряженных ионов водорода. Возникший при этом протонный градиент является движущей силой в синтезе АТФ (рис. 211).
Это предположение стало затем теорией, хемиосмотической теорией сопряжения окисления субстратов с синтезом АТФ. Как оказалось, при переносе электронов в митохондриальной мембране каждый комплекс дыхательной цепи направляет свободную энергию окисления на перемещение протонов (положительных зарядов) через мембрану из матрикса в межмембранное пространство, что приводит к образованию разности потенциалов на мембране; положительные заряды преобладают в межмембранном пространстве, а отрицательные — со стороны матрикса митохондрий. При достижении определенной разности потенциалов (220 мВ) белковый комплекс АТФ-синтетазы начинает транспортировать протоны обратно в матрикс, при этом превращает одну форму энергии в другую; образует АТФ из АДФ и неорганического фосфата. Так происходит сопряжение окислительных процессов с синтетическим, с фосфорилированием АДФ. Пока совершается окисление субстратов, пока осуществляется перекачка протонов через внутреннюю митохондриальную мембрану, идет сопряженный с этим синтез АТФ, т.е. происходит окислительное фосфорилирование. Эти два процесса можно разобщить. Для этого достаточно снять разность потенциалов на митохондриальной мембране, сделав в ней диффузионные каналы, или ее механическим нарушением, или с помощью химических соединений (например, динитрофенола). При этом перенос электронов и окисление субстрата будут продолжаться, но синтеза АТФ уже не будет. В этом случае энергия, освобождающаяся при окислении, перейдет в тепловую энергию. Окислительное фосфорилирование у бактерий У прокариотических клеток, способных к окислительному фосфорилированию, элементы цикла трикарбоновых кислот локализованы прямо в цитоплазме, а ферменты дыхательной цепи и фосфорилирования связаны с клеточной, плазматической мембраной. Вначале это было показано цитохимическими методами. Так, фермент сукцинатдегидрогеназа связан с плазматической мембраной и с ее выпячиваниями, выступающими внутрь цитоплазмы, с так называемыми мезосомами (рис. 212). Необходимо отметить, что такие бактериальные мезосомы могут быть связаны не только с процессами аэробного дыхания, но у некоторых видов участвуют в делении клеток, в процессе распределения ДНК по новым клеткам, в образовании клеточной стенки и т.д. На плазматической мембране в мезосомах некоторых бактерий локализуются также факторы сопряжения окисления и синтеза АТФ. С помощью электронного микроскопа во фракциях плазматических мембран бактерий обнаружены сферические частицы, аналогичные тем, которые были найдены в митохондриях эукариотических клеток. Таким образом, у бактериальных клеток, способных к окислительному фосфорилированию, плазматическая мембрана выполняет роль, аналогичную внутренней мембране митохондрий эукариотических клеток.
Увеличение числа митохондрий Как и другие органеллы цитоплазмы, митохондрии могут увеличиваться в числе, что особенно заметно при делении клеток или при увеличении функциональной нагрузки клетки. Более того, митохондрии постоянно обновляются. Так, в печени средняя продолжительность жизни митохондрий составляет около 10 дней. Поэтому закономерно возникает вопрос: каким образом происходит это увеличение числа митохондрий, за счет каких процессов и каких структур образуются новые митохондрии? Основная масса экспериментальных данных говорит о том, что увеличение числа митохондрий происходит путем роста и деления предшествующих митохондрий. Это предположение было впервые высказано Альтманом (1893), описавшим митохондрии под термином «биобласты». Позднее с помощью цейтраферной киносъемки удалось наблюдать прижизненное деление, фрагментацию длинных митохондрий на более короткие. Особенно отчетливо виден этот процесс при делении клеток некоторых одноклеточных водорослей и низших грибов, у которых деление митохондрий скоординировано с клеточным делением. С помощью электронного микроскопа часто во многих клетках можно видеть деление митохондрий путем образования перетяжки (рис. 213), например в клетках печени (хотя без доказательств динамичности этого процесса такие наблюдения мало убедительны). Внешне все эти картины очень напоминают бинарный способ деления бактерий.
Реапьность увеличения числа митохондрий путем деления была доказана при изучении поведения митохондрий в живых клетках культуры ткани. Обнаружено, что в течение клеточного цикла митохондрии могут вырастать до нескольких микрометров, а затем фрагментироваться, делиться на более мелкие тельца. Кроме того, митохондрии могут сливаться друг с другом. Так, в культуре клеток эндотелия сердца головастика ксенопуса выявляли до 40 случаев слияния и деления митохондрий за 1 ч. В клетках культуры почек эмбрионов наблюдали рост и ветвление митохондрий в S-периоде клеточного цикла. Однако уже в G2-периоде преобладали в числе мелкие митохондрии, образовавшиеся за счет деления при фрагментации длинных митохондрий. Таким образом, размножение митохондрий идет по принципу: omnis mitochondrion e mitochondrion. Интересны наблюдения за судьбой митохондрий в дрожжевых клетках. В аэробных условиях дрожжевые клетки имеют типичные митохондрии с четко выраженными кристами. При переносе клеток в анаэробные условия (например, при их пересеве или при перемещении в атмосферу азота) типичные митохондрии в их цитоплазме не обнаруживаются, и вместо них видны мелкие мембранные пузырьки. Оказалось, что в анаэробных условиях дрожжевые клетки не содержат полную дыхательную цепь (отсутствуют цитохромы b и а). При аэрации культуры обнаруживается быстрая индукция биосинтеза дыхательных ферментов, резкое повышение потребления кислорода, а в цитоплазме появляются нормальные митохондрии. Эти наблюдения привели к представлению о том, что у дрожжей в анаэробных условиях в цитоплазме существуют промитохондриальные структуры с редуцированной системой окисления. Такие промитохондрии при переносе клеток в условия аэробной среды начинают перестраиваться, происходит включение в их мембраны элементов полной цепи окисления и фосфорилирования, что сопровождается изменением их морфологии. Так, из примитивных, неактивных промитохондрии путем их достройки и роста образуются обычные функционирующие митохондрии. Вероятно, сходные процессы протекают и при делении митохондрий: увеличивается масса митохондриальных мембран со всеми специфическими компонентами за счет синтеза и включения в них отдельных белков - ферментов и липидов, нарастает масса белков матрикса, а затем происходит деление как бы удвоившейся или многократно увеличившейся структуры. Эти представления получают поддержку со стороны фактов, касающихся организации и состава митохондриального матрикса или митоплазмы, в которой обнаружены ДНК, разные типы РНК и рибосомы. Авторепродукция митохондрий Исследования последних лет привели к удивительным открытиям: двумембранные органеллы обладают полной системой авторепродукции. Эта система полная в том смысле, что в митохондриях и пластидах открыта ДНК, на которой синтезируются информационные, трансферные и рибосомные РНК и рибосомы, осуществляющие синтез митохондриальных и пластидных белков. Однако, как оказалось, эти системы, хотя и автономны, очень ограничены по своим возможностям. ДНК в митохондриях представлена циклическими молекулами, не образующими связь с гистонами, в этом отношении они напоминают бактериальные хромосомы. Размер их невелик, около 7 мкм; в одну циклическую молекулу митохондрий животных входит 16—19 т.п.н. ДНК. У человека митохондриальная ДНК содержит 16,5 т.п.н., она полностью расшифрована. Митохондральная ДНК различных объектов очень однородна, отличие их заключается лишь в величине интронов и нетранскрибируемых участков. Все митохондриальные ДНК представлены множественными копиями, собранными в группы, - кластеры. Так, в одной митохондрии печени крысы может содержаться от 1 до 50 циклических молекул ДНК. Общее же количество митохондриальной ДНК на клетку составляет около 1%. Синтез митохондриальных ДНК не связан с синтезом ДНК в ядре. Как и у бактерий, митохондральная ДНК собрана в отдельную зону - нуклеоид, его размер составляет около 0,4 мкм в диаметре. В длинных митохондриях может быть от 1 до 10 нуклеоидов. При делении длинной митохондрии от нее отделяется участок, содержащий нуклеоид (сходство с бинарным делением бактерий). Количество ДНК в отдельных нуклеоидах митохондрий может колебаться в 10 раз в зависимости от типа клеток. Прижизненно нуклеоиды митохондрий могут окрашиваться специальными флуорохромами. Оказалось, что в некоторых культурах в клетках от 6 до 60% митохондрий не имеют нуклеоида, что может объясняться тем, что деление этих органелл скорее связано с фрагментацией, а не с распределением нуклеоидов. Как уже говорилось, митохондрии могут как делиться, так и сливаться друг с другом. В обычной культуре клеток человека HeLa все митохондрии содержат нуклеоиды. Однако одна из мутантных линий этой культуры содержала митохондрии, в которых нуклеоиды с помощью флуорохромов не выявлялись. Но если эти мутантные клетки слить с цитопластами клеток исходного типа, то во всех митохондриях обнаруживались нуклеоиды. Это говорит о том, что при слиянии митохондрий друг с другом может происходить обмен их внутренними компонентами. Важно подчеркнуть, что рРНК и рибосомы митохондрий резко отличны от таковых в цитоплазме. Если в цитоплазме выявляются 80S рибосомы, то рибосомы митохондрий растительных клеток принадлежат к 70S рибосомам (состоят из 30S и 50S субъединиц, содержат 16S и 23S РНК, характерные для прокариотических клеток), а в митохондриях клеток животных обнаружены более мелкие рибосомы (около 50S). Рибосомные РНК митохондрий синтезируются на митохондриальных ДНК. В митоплазме на рибосомах идет синтез белков. Он прекращается, в отличие от синтеза на цитоплазматических рибосомах, при действии антибиотика хлорамфеникола, подавляющего синтез белка у бактерий. На митохондриальном геноме синтезируются и транспортные РНК, всего синтезируется 22 тРНК. Триплетный код митохондриальной синтетической системы отличен от такового, используемого в гиалоплазме. Несмотря на наличие казалось бы всех компонентов, необходимых для синтеза белков, небольшие молекулы митохондриальной ДНК не могут кодировать все митохондриальные белки, а лишь их небольшую часть. Так, ДНК размером 15 т.п.н. может кодировать белки с суммарной молекулярной массой около 6·105. В то же время суммарная молекулярная масса белков частицы полного дыхательного ансамбля митохондрии достигает величины около 2·106. Если учесть, что кроме белков окислительного фосфорилирования в митохондрии входят ферменты цикла трикарбоновых кислот, ферменты синтеза ДНК и РНК, ферменты активации аминокислот и другие белки, то видно, что для кодирования этих многочисленных белков и рРНК и тРНК количества генетической информации в короткой молекуле митохондриальной ДНК явно не хватает. Расшифровка нуклеотидной последовательности митохондриальной ДНК человека показала, что она кодирует всего лишь 2 рибосомные РНК, 22 трансферные РНК и всего 13 различных полипептидных цепей.
|
|||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2019-05-20; просмотров: 756; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.226.96.61 (0.059 с.) |