Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Синдром перекреста бронхиальной астмы и ХОБЛ
Дифференциальный диагноз у больных с респираторными симптомами зависит от возраста. У детей и молодых взрослых, если исключены инфекционное заболевание и нереспираторные патологии (например, врожденный порок сердца, дисфункция голосовых связок), наиболее вероятным хроническим заболеванием дыхательных путей является бронхиальная астма. У взрослых (обычно в возрасте после 40 лет) чаще наблюдается ХОБЛ, и отличить бронхиальную астму с хроническим ограничением скорости воздушного потока от ХОБЛ становится проблематичным. У значительной доли пациентов с симптомами хронического заболевания дыхательных путей выявляются признаки, как бронхиальная астма, так и ХОБЛ. Для описания таких пациентов применялись несколько диагностических формулировок, большинство которых включало слово «перекрест», и эта тема широко обсуждалась. Показано, что пациенты с признаками бронхиальной астмы, так и ХОБЛ испытывают частые обострения, и низкое качество жизни, более быстрое снижение функции легких и высокую смертность. В этих сообщениях доля пациентов с признаками, как бронхиальной астмы, так и ХОБЛ изменялась от 15 до 55% в зависимости от использованных критериев включения в следование. Документ о диагностике пациентов с хроническим заболеванием дыхательных путей был разработан Научными комитетами GINA и GOLD на основе подробного обзора имеющейся литературы и консенсуса экспертов. В нем предложен термин «синдром перекреста» бронхиальной астмы и ХОБЛ (СПБАХ)». Таким образом, выделена категория пациентов, у которых присутствуют оба заболевания одномоментно, что требует индивидуализации лечения данной группы больных. БРОНХИАЛЬНАЯ АСТМА (БА). ОПРЕДЕЛЕНИЕ БА. Cовpеменная тpактовка бронхиальной астмы (БА), как заболевания, основана на воcпалительной теоpии и предполагает пеpcиcтиpующий xаpактеp воcпаления. БА – хроническое заболевание дыхательных путей. В воcпалительном пpоцеccе учаcтвуют эозинофилы, тучные клетки, лимфоциты, макpофаги, нейтpофилы, эпителиальные клетки; на поздниx cтадияx воcпаления пpоиcxодят большие изменения в cтpуктуpе легкиx, для котоpыx xаpактеpна потеpя эпителиального покpова, фибpоз базальной мембpаны, выpаженный ангиогенез, гипеpтpофия cеpозныx и бокаловидныx клеток. Эти воcпалительные изменения опиcываютcя теpмином "pемоудилинг".
Патофизиологичеcкую xаpактеpиcтику БА cвязывают с наличием гипеppеактивноcти дыxательныx путей (один из фенотипичеcкиx пpизнаков болезни), о котоpой cудят по pезультатам дневной и вечеpней пикфлоуметpии. Еcли pазница в показателях, характеризующих бронхиальную проходимость, cоcтавляет более 20%, то эти изменения называют гипеppеактивноcтью и они более xаpактеpны для заболевания – БА, чем для ХОБЛ. Этот теcт также иcпользуют для монитоpиpования и оценки эффективноcти пpоводимой антиаcтматичеcкой теpапии. Атопичеcкая (экзогенная) фоpма БА отноcитcя к чиcлу аллеpгичеcкиx заболеваний, фенотипичеcким пpизнаком котоpыx являетcя увеличение иммуноглобулина класcа "Е". Т.о., следующие положения являются ключевыми в определении БА: 1. БА – хроническое персистирующее заболевание дыхательных путей. 2. Воспалительный процесс приводит к гиперреактивности бронхов, обструкции и появлению респираторных симптомов. 3. Обструкция дыхательных путей бывает четырех форм: – острая бронхоконстрикция в результате спазма гладких мышц, – подострая – вследствие отека слизистой дыхательных путей, – склеротическая – склероз стенки бронха при длительном и тяжелом течении заболевания 4. Атопия, генетическая предрасположенность к продукции иммуноглобулинов класса Е.
Эпидемиология БА Общее число больных БА в мире превышает 150 млн. В России, согласно данным эпидемиологических исследований, ею страдают около 7 млн. человек (9 % детей и 5 % взрослых), из них около 1 млн. – тяжелыми формами. Однако истинная распространенность бронхиальной астмы может быть в несколько раз выше, поскольку официально она регистрируется лишь у одного из 4 – 5 больных. БА наиболее распространенное заболевание детского возраста, частота которого в развитых странах составляет 4 – 12 %. Чаще болеют мальчики, чем девочки, однако с наступлением пубертатного периода частота заболевания становится одинаковой у обоих полов. БА чаще наблюдают у городских жителей, чем у сельских. Заболевание тяжелее протекает у людей с низким социальным статусом. В проведённом экспертами ВОЗ исследовании (The Global Burden of Asthma) показано существенное нарастание распространенности и экономического ущерба, связанного с этим заболеванием во многих регионах мира (Африка, Азия, Латинская Америка), прежде всего, в странах с низким социальным уровнем и плохими экологическими характеристиками. При этом отмечается высокий уровень запоздалой диагностики заболевания, увеличение частоты госпитализаций по поводу обострений (особенно у детей), а также летальности. Ежегодно около 250000 летальных исходов связано с БА. Причем, летальность значительно выше в странах с низким социальным уровнем, где имеют место несвоевременная диагностика заболевания и неадекватная лечебная тактика в стабильном периоде.
ФАКТОРЫ РИСКА БА Точное установление причины предрасположенности к развитию воспаления дыхательных путей у больных БА на современном этапе возможно не всегда; тем не менее, круг факторов риска этого заболевания очерчен достаточно полно. Факторы риска БА можно разделить на обуславливающие ее развитие и/или провоцирующие обострения. Выделяют так называемые факторы макроорганизма (внутренние факторы): 1. Генетические факторы: 1.1. гены, предрасполагающие к атопии; 1.2. гены, предрасполагающие к бронхиальной гиперреактивности; 1.3. ожирение; 1.4. пол (мужской в детском возрасте, женский – у взрослых); 2. Факторы окружающей среды (внешние факторы): 2.1. аллергены: помещений (домашние клещи), 2.2. шерсть домашних животных (собак, кошек, мышей), 2.3. аллергены тараканов, 2.4. грибы (плесневые, дрожжевые); 2.5. наружные аллергены (пыльца, грибы – плесневые дрожжевые); 2.6. инфекции (преимущественно вирусные); 2.7. профессиональные сенсибилизаторы; 2.8. курение (активное и пассивное); 2.9. загрязнение воздуха внутри и снаружи помещений; 2.10. особенности питания. Классификация астмы по этиологическому принципу предусматривает градацию причинных факторов как "индукторов" (вызывающих воспаление и связанное с ним сужение дыхательных путей) и "триггеров" (приводящих к развитию бронхоконстрикции). В настоящее время наиболее мощным из установленных факторов риска является атопия — наследственная семейная предрасположенность к аллергическим реакциям за счет наличия определенных HLA-антигенов, являющихся интегральными маркерами особого реагирования органов дыхания на воздействие окружающей среды (включая инфекционные факторы). К факторам риска, приводящим к развитию БА, относятся бытовые аллергены (клещи домашней пыли, аллергены животных, тараканов), внешние аллергены (пыльца и плесневые грибы). Воздействие пассивного курения, особенно на детей, является мощным фактором риска. Химические или воздушные профессиональные поллютанты также могут сенсибилизировать дыхательные пути, приводя к возникновению БА. Развитию заболевания могут способствовать респираторные вирусные инфекции, небольшой рост и низкая масса тела ребенка при рождении и пищевые стереотипы. Считается, что инфекция (бактерии, вирусы) оказывает сенсибилизирующее воздействие – как продуктами жизнедеятельности микроорганизмов, так и антигенным материалом, образующимся при инфекционном воспалении в тканях бронхов. Под влиянием инфекционных факторов резко снижается порог чувствительности органов дыхания к аллергенам неинфекционного происхождения.
Факторы риска (домашний клещ, пыльца, плесневые грибы, шерсть домашних животных, воздушные ирританты, табачный дым, респираторные инфекции) могут вызывать обострения БА и выступать в роли " триггеров " – факторов, поддерживающих обострение БА. К "триггерам" относятся также дым от открытого огня или печи, интенсивная физическая нагрузка, чрезмерные эмоциональные "всплески", холодный воздух или изменения погодных условий, пищевые добавки, ацетилсалициловая кислота. Больные БА могут реагировать на один или несколько "триггеров": у каждого индивидуума на конкретном этапе жизни "триггерами" могут являться разные факторы. Идентификация "триггеров" у каждого больного БА с их последующей элиминацией (если это возможно) позволяет снизить риск раздражения дыхательных путей. Подобный результат достигается также использованием средств противовоспалительного ряда. Таким образом, большинство обострений (или приступов) БА можно предупредить, исключая "триггеры", а также благодаря приему противовоспалительных препаратов. ИММУНОПАТОГЕНЕЗ БА Цепь событий, следующая за воздействием этиологического агента – фактора риска у наследственно предрасположенного к БА человека, такова. После сенсибилизации организма аллергеном у больного с генетической предрасположенностью в результате несовершенства контроля Т-лимфоцитов за синтезом реагинов возрастает концентрация IgE с фиксацией антител этого класса на рецепторах мембран тучных клеток. Последнее после контакта с "триггером" ведет к экзоцитозу гистамина, медленно реагирующей субстанции анафилаксии (МРСА), хемотаксического фактора эозинофилов и т.д. Итогом каскада последовательных иммунологических реакций (1 типа - анафилактический, атопический, реагиновый, гиперчувствительность немедленного типа - ГНТ) является приступ удушья вследствие бронхоспазма, гиперсекреции слизи и воспалительного отека слизистой бронхов. Таким образом, при БА аллергическая реакция и воспаление в бронхах неразрывно взаимосвязаны (иммунопатологический "вариант воспаления"). В патогенезе БА важную роль играют и другие типы иммунопатологических реакций: тип 3 – иммунокомплексный (феномен Артюса), при котором главным фактором, вызывающим бронхоспазм, являются лизосомальные ферменты; тип 4–клеточный (гиперчувствительность замедленного типа – ГЗТ).
На определенных этапах течения БА, наряду с иммунопатологическими механизмами, определенное значение могут приобретать вторичные нарушения, среди которых важное место занимают нервно – рефлекторные реакции. Патофизиология БА Несмотря на разнообразие клинических проявлений БА и особенностей патофизиологических механизмов, хроническое воспаление дыхательных путей является фундаментальной характеристикой заболевания. При этом воспалительный процесс в дыхательных путях персистирует даже в ситуациях, когда симптомы заболевания эпизодические, а связь между тяжестью астмы и интенсивностью воспаления далеко не всегда отчетливая. Воспалительные процессы наблюдаются во всех отделах респираторного тракта, включая верхние дыхательные пути, нос, но более выражены в бронхах среднего калибра. Выделяют следующие причины обструктивных расстройств вентиляции при бронхиальной астме: 1. Спазм бронхов небольшого диаметра и бронхиол. 2. Отек слизистой оболочки дыхательных путей. 3. Рост секреции клетками слизистой оболочки. 4. Эозинофильная и лимфоцитарная инфильтрация бронхиальной стенки. 5. Повреждения и десквамация эпителия дыхательных путей. У больных БА выявляют гиперреактивность дыхательных путей, то есть усиленную способность бронхов небольшого диаметра и бронхиол отвечать констрикцией и спазмом на действия различных стимулов. Гиперреактивность находится в прямой связи с выраженностью воспаления бронхиальной стенки. Причины гиперреактивности остаются не вполне ясными. Гиперреактивность может быть связана с повреждениями эпителия (Таблица № 9). В результате повреждений и десквамации эпителия снижается секреция эпителиального релаксирующего фактора и простагландина Е2, ослабляющих действие медиаторов бронхоконстрикции. Нейтральные эндопептидазы, метаболизирующие медиаторы бронхоконстрикции (субстанцию Р и др.), также образуются и высвобождаются эпителиоцитами. Повреждение эпителия снижает секрецию нейтральных эндопептидаз, и приводит к росту концентрации бронхоконстрикторов в бронхиальной стенке. Таблица №9 Место структурных клеток дыхательных путей в патогенезе БА
Свою роль в развитии гиперреактивности может играть утолщение стенок бронхов вследствие отека и клеточной пролиферации, связанных с хроническим воспалением (Таблица №10). Если раньше гиперреактивность считали основной составляющей патогенеза обструктивных расстройств вентиляции при БА, то теперь ясно, что астма — это, прежде всего, хронический эозинофильный десквамативный бронхит. При астме любой степени тяжести всегда есть инфильтрация дыхательных путей эозинофилами, нейтрофилами и тучными клетками, которая развивается параллельно с повреждениями и десквамацией эпителия. Тучные клетки играют особую роль в индукции бронхоконстрикции при анафилаксии. Содержание зозинофилов в крови и интенсивность секреции находятся в прямой связи с выраженностью гиперреактнвности. Многие из медиаторов воспаления, которые при астме содержит секрет дыхательных путей, своими действиями вызывают бронхоконстрикцию, усиливают секрецию, а также повышают проницаемость стенок микрососудов дыхательных путей. В результате роста проницаемости возникает отек подслизистого слоя. Отек увеличивает сопротивление дыхательных путей, являясь фактором гиперреактивности.
Таблица №10 Функциональная характеристика воспалительных клеток
Воспалительные медиаторы образуются и высвобождаются вследствие реакций повышенной чувствительности в легких (Таблица №11). К ним относят гистамин, а также продукты метаболизма арахидоновой кислоты, лейкотриены и тромбоксан. Цистеиниловые лейкотриены LTC4 и LTD4 — это наиболее сильные эндогенные бронхоконстрикторы. Фактор активации тромбоцитов как бронхоконстриктор не играет важной роли в патогенезе астмы. Активация Т—клеток в ходе реакции повышенной чувствительности первого типа — это ключевой момент патогенеза воспаления, которое лежит в основе БА. Эффекты про—аллергических цитокинов Т—клеток CD4T (хелперов) своими действиями вызывают воспаление бронхиальной стенки как основной типический патологический процесс при бронхиальной астме. Свою роль в патогенезе БА как хемоаттрактант эозинофилов играет ннтерлейкин—5. Аналогичными свойствами обладает гранулоцитарно—макрофагальный колониестимулирующий фактор. Не исключено, что холинергическая бронхоконстрикция играет свою роль в патогенезе астмы. Более значимую роль в патогенезе астмы играют аксон—рефлексы с участием окончаний сенсорных нервов (быстро адаптирующиеся рецепторы, С-волокна). В ответ на действие внешней среды (резкое изменение температуры, силы ветра и др.) и примесей в воздухе, окончания сенсорных нервов сенситизируются и начинают высвобождать нейропептиды: субстанцию Р, нейрокинин А, а также пептид, связанный с геном кальцитонина. Эффекты нейропептндов повышают проницаемость стенок микрососудов, усиливают секрецию клетками эпителия и вызывают бронхоконстрикцию и бронходилатацию. Таблица №11 Ключевые медиаторы в патогенезе БА
Таким образом, при БА наблюдается воспаление, характерное для аллергических заболеваний, с наличием активированных тучных клеток, увеличенным количеством активированных эозинофилов, повышенным количеством неизмененных естественных Т-киллеров и Th-2 лимфоцитов, которые продуцируют медиаторы, обусловливающие развитие клинических проявлений заболевания. Структурные клетки дыхательных путей также продуцируют воспалительные медиаторы, что способствует персистенции воспаления. Финальным этапом описанных патофизиологических процессов является констрикция дыхательных путей, что ведет к клиническим проявлениям и физиологическим изменениям при астме. К патоморфологическим изменениям, обнаруживаемых у пациентов относят: · субэпителиальный фиброз вследствие депозиции коллагеновых фибрилл и протеогликанов под базальной мембраной; · увеличение толщины гладких мышц дыхательных путей за счет их гипертрофии; · пролиферацию кровеносных сосудов в стенке дыхательных путей под влиянием сосудистого эндотелиального фактора роста; · гиперсекрецию слизи в результате увеличения числа бокаловидных клеток в эпителии дыхательных путей и увеличением размера подслизистых желез. ДИАГНОСТИКА БА Одним из ключевых аспектов рекомендаций GINA 2014 является подчеркивание роли строгой верификации диагноза БА до назначения медикаментозной терапии. БА – это гетерогенное (многоликое) заболевание, характеризующееся хроническим воспалением дыхательных путей. Однако, у БА есть два ключевых признака: · Наличие в анамнезе респираторных симптомов, таких как свистящие хрипы, одышка, ощущение заложенности в груди и кашель, выраженность которых меняется со временем; · Вариабельное ограничение скорости воздушного потока. Учитывая вышесказанное, последовательность установления диагноза БА будет следующей: 1. Определить, являются ли респираторные симптомы, выявленные у пациента, типичными для БА? (Таблица №12) 2. Подробно собрать анамнез, подтверждающий возможность БА у пациента; 3. Выполнить спирометрию или определение пиковой скорости выдоха (ПСВ) с тестом на обратимость бронхиальной обструкции. Таблица №12. Признаки, используемые для установления диагноза бронхиальная астма (GINA, 2014).
СИМПТОМЫ И ФИЗИКАЛЬНЫЕ ДАННЫЕ ПРИ БА Типичные для БА жалобы включают: эпизоды одышки, свистящего дыхания, кашля (с мокротой или без таковой) и ощущение стеснения грудной клетки. Эти симптомы не являются специфическими для БА и могут наблюдаться при различных острых и хронических заболеваниях дыхательных путей. Рассматриваемые симптомы также могут наблюдаться у части больных с ХОБЛ, при этом дифференциальная диагностика между БА и ХОБЛ нередко вызывает затруднения. Некоторым пациентам затруднительно оценить тяжесть собственных симптомов, около 10% больных во время приступа не ощущают удушья и одышки, отмечая лишь свистящее дыхание и кашель. Классическим проявлением БА является приступ удушья. Предприступный период характеризуется симптомами аллергического ринита, вегетативной дистонии, покашливанием. Приступы удушья чаще развиваются ночью или в предутренние часы. Возникающие в дневное время приступы обусловлены контактом с различными аллергенами и раздражителями. Приступ удушья начинается с мучительного кашля с трудно отходящей мокротой, появляются экспираторная одышка с участием в дыхании вспомогательной мускулатуры, дистанционные хрипы. При осмотре можно увидеть цианоз губ, в ряде случаев акроцианоз, положение ортопноэ. При перкуссии во время приступа или при развитии эмфиземы легкого можно выявить коробочный звук. В легких с обеих сторон характерно ослабление везикулярного дыхания, удлинение выдоха, наличие свистящих хрипов, прослушивающихся на вдохе и выдохе. У части больных при наличии выраженной обструкции дыхательных путей могут отсутствовать свистящие хрипы или прослушиваться только на форсированном выдохе («немое легкое»). Этот феномен обусловлен тяжелыми нарушениями вентиляции. У таких больных обычно также имеют место цианоз, тахипноэ, тахикардия, сонливость, ступор, «вздутие» грудной клетки, участие в акте дыхания вспомогательных мышц и втяжение межреберных промежутков, парадоксальный пульс и обильное потоотделение. Во время приступа БА возникает тахикардия, повышается артериальное давление. Для острого приступа и обострения БА характерно наличие тахипноэ до 25-30 в минуту и тахикардии около 100 в минуту. Примерно в 25-30% случаев частота дыханий может быть более 30 в минуту, а пульса – более 120 в минуту. Диагностика БА в период приступа не представляет трудностей. Однако, поскольку клинические проявления БА определяются выраженностью бронхиальной обструкции и эта обструкция полностью обратима на ранних этапах, то данные физикального обследования дыхательной системы пациента могут быть в норме. Таким, образом, приступ БА, который врач наблюдает у пациента, должен быть внесен в историю болезней, поскольку при начале лечения таких пациентов эмпирически с помощью кортикостероидов, подтвердить диагноз и провести дифференциальную диагностику с ХОБЛ уже будет труднее. Кашлевой вариант БА. При кашлевом варианте БА кашель является ведущим, а в части случаев единственным симптомом заболевания. «Кашлевая» БА чаще наблюдается у лиц молодого возраста и детей. Для постановки диагноза у таких больных важную роль играют исследования вариабельности показателей функции легких, выявление бронхиальной гиперактивности и определение эозинофилов в мокроте. Кашлевой вариант БА следует отличать от ряда состояний, проявляющихся кашлем и эозинофилией мокроты. Например, при эозинофильном бронхите имеется хронический малопродуктивный кашель, повышение содержание эозинофилов в мокроте или бронхиальных смывах, но показатели функции легких остаются неизменными. Также следует учитывать возможность развития кашля, связанного с приемом ИАПФ, гастроэзофагеальным рефлюксом, хроническим синуситом и дисфункцией голосовых связок. Бронхоконстрикция, провоцируемая физическими нагрузками. У многих больных ведущей, а в некоторых случаях единственной причиной развития симптомов бронхоконстрикции, является физическая активность. Постнагрузочный бронхоспазм обычно развивается через 5–10 минут после прекращения физической активности (реже – во время нагрузки), при этом у пациентов наблюдаются типичные симптомы БА или иногда упорный кашель, самостоятельно проходящий через 40–45 минут. Некоторые виды физической активности (например, бег) провоцируют бронхоспазм чаще. Он также значительно чаще наблюдается при вдыхании сухого холодного воздуха. Быстрое устранение симптомов постнагрузочного бронхоспазма после ингаляции бета2 – агонистов свидетельствует в пользу наличия БА. Анамнестическое Исследование при БА При сборе анамнеза следует получить информацию о симптомах заболевания и о том, когда они развиваются: при нахождении в определенном месте дома или на работе, при контакте с постельными принадлежностями, уходе за животными, приготовлении пищи, прогулках в саду и т.п. При постановке диагноза БА важное уточнить ответы на следующие вопросы: 1. Был ли у пациента эпизод (эпизоды) свистящего дыхания? 2. Бывает ли у пациента мучительный ночной кашель? 3. Бывают ли у пациента свистящее дыхание и/или кашель через 5-10 минут после физической нагрузки? 4. Бывают ли у пациента развитие свистящего дыхания, сдавления в грудной клетке или кашля после контакта с аэроаллергенами или поллютантами? 5. Отмечает ли пациент, что у него часто «простуда опускается в грудную клетку» или продолжается более 10–ти дней? Правильно собранный анамнез, позволяет предположить соответствующую природу приступов удушья на основании сведений о: · семейной (наследственной) отягощенности по астме или другим аллергическим заболеваниям, · повышенной чувствительности к тем или иным экзоаллергенам, · указаний на внелегочные аллергические заболевания (аллергический риносинусит, экзема, крапивница). При сборе анамнеза иногда удается проследить тесную связь развития и течения заболевания с острыми респираторными вирусными инфекциями или хроническими очагами инфекции в дыхательных путях. При расспросе больного и оценке медицинской документации также важно установить у него наличие различных факторов, способных указывать на наличие БА или усугублять ее течение, таких как: наличие: патологии носа или околоносовых пазух; атипического дерматита/крапивницы/поллиноза; пищевой аллергии; гастроэзофагеального рефлюкса; непереносимости аспирина. Современная классификация и Формулирование диагноза БА В новом пересмотре рекомендаций GINA 2014 отсутствует раздел, посвященный классификации БА. Тем не менее, традиционно при оценке БА используют три параметра, включающие этиологическое происхождение, тяжесть заболевания и степень достижения его контроля. По этиологии. Возможности классификации БА на основе этиологии с учетом сенсибилизирующих внешних факторов заметно ограничены, так как для некоторых больных не удается выявить внешние факторы риска. Руководство GINA 2014 указывает, что выделение аллергической (атопической, экзогенной) и неаллергической (эндогенной) БА нецелесообразно, так как причиной БА редко является единственный специфический аллерген. Несмотря на это поиск внешних факторов развития БА (например, профессиональной БА, аспириновой БА) должен обязательно проводиться у каждого пациента. Кроме того, указание на этиологию при формулировке диагноза является привычным и в ряде случаев полезным для определения тактики лечения. По уровню контроля БА и риска осложнений. С целью оценки ответа пациента на назначенную терапию, введено понятие контроля БА. Термин «контроль» обозначает устранение проявлений заболевания. В идеале это должно относиться не только к клиническим проявлениям, но и к лабораторным маркерам воспаления и патофизиологическим признакам заболевания (например, гиперреактивности бронхов). В клинической практике рекомендуется использовать классификацию БА по уровню контроля над заболеванием и риску будущих осложнений течения заболевания и медикаментозной терапии (таблица №13). Таблица №13. Уровни контроля БА и риска осложнений
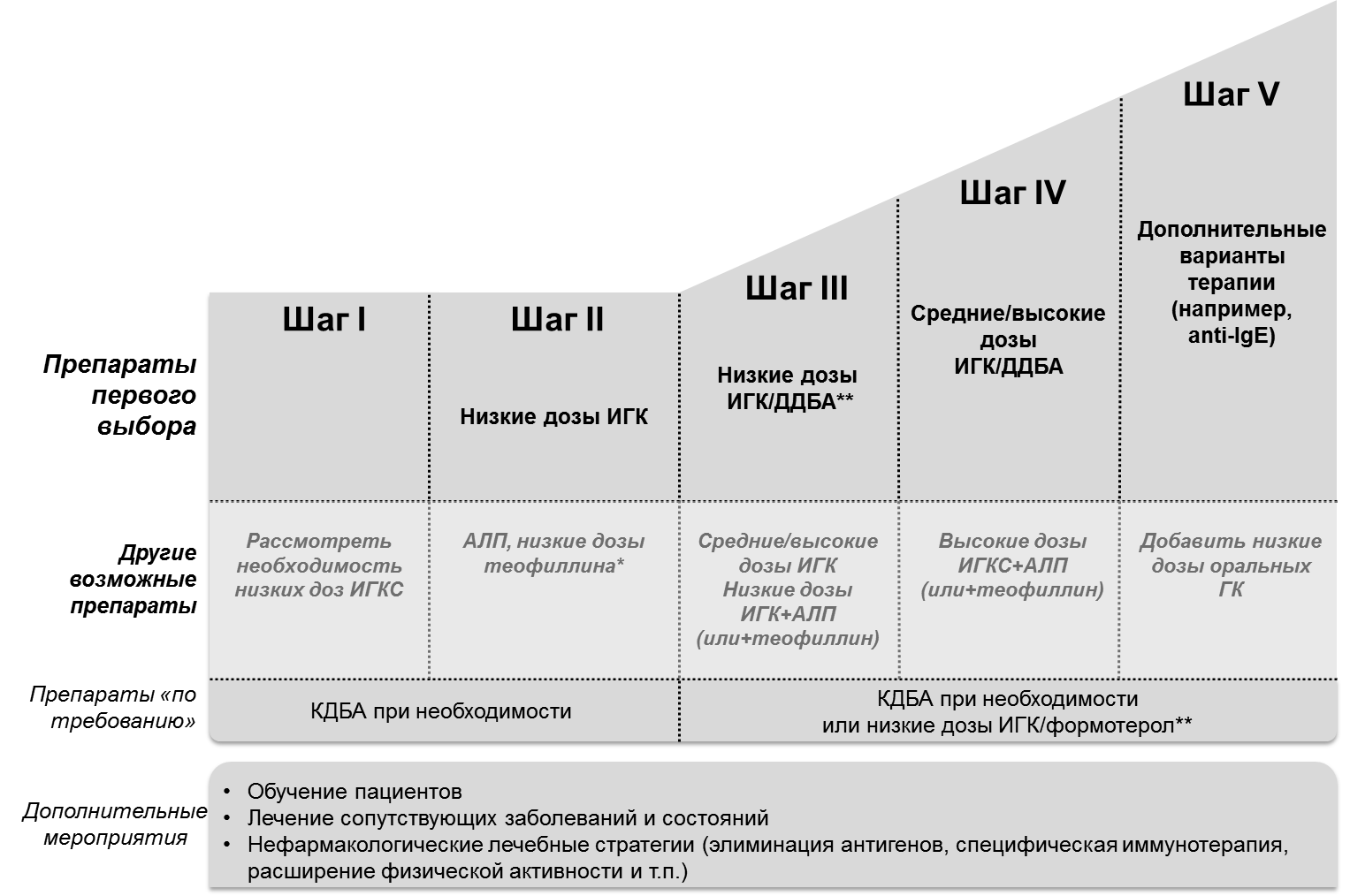
Признаки, ассоциируемые с высоким риском обострений БА, включают: · тяжелые или часты обострения БА в прошлом, особенно требовавшие интенсивной терапии и интубации; · плохой контроль над БА, · неприменение ингаляционных кортикостероидов, недостаточный комплаенс, неадекватная техника ингаляции; · избыточное употребление КДБА (более 1 баллончика на 200 доз за месяц); · частые обострения в течение последнего года, · любая госпитализация по поводу обострения БА, · низкий ОФВ1, особенно если показатель менее 60%; · значительные психоэмоциональные и социально-экономические проблемы; · воздействие табачного дыма, аллергенов · наличие ожирения, риносинусита, пищевой аллергии, эозинофилии мокроты или крови; · беременность. Факторы риска развития необратимой обструкции: · неприменение ИГК, · воздействие табачного дыма и аэрополлютантов, · низкий ОФВ1, · хроническая гиперсекреция слизи, · наличие эозинофилии мокроты или крови. По степени тяжести. Классификация БА по степени тяжести также является традиционным подходом, который основывается на результатах анализа комплекса клинических и функциональных признаков бронхиальной обструкции. Прежде считалось, что классификация БА по степени тяжести может оказаться полезной для выбора тактики лечения заболевания. Однако далеко не всегда первоначальная оценка выраженности клинических проявлений у больного может служить надежным критерием выбора оптимальной лечебной тактики и прогноза. Эксперты GINA пришли к заключению, что тяжесть БА целесообразно оценивать только ретроспективно по объему терапии, необходимому для достижения контроля заболевания после нескольких месяцев адекватно подобранной базисной терапии. При этом использовавшееся ранее разделение на интермиттирующую и персистирующую астму в настоящей редакции рекомендаций не упоминается. Легкая степень тяжести констатируется при достижении контроля БА на фоне применения только короткодействующих бета-агонистов (КДБА) по требованию или низких доз ИГК или антилейкотриеновых препаратов (АЛП), что соответствует 1-2 шагам терапии. Средняя степень тяже сти устанавливается при достижении контроля БА на фоне применения низких доз ИГК в сочетании с длительнодействующими бета-агонистами (ДДБА) или средних доз ИГК (соответствует 3 шагу терапии) (Рис. 3).
Рис.3 Подход к лечению БА, ориентированный на контроль над заболеванием (рекомендации GINA 2014)
Тяжелая БА констатируется, когда для достижения полного контроля необходим большой объем терапии (например, высокие дозы ИГК в сочетании с ДДБА, что соответствует 4-5 шагам терапии астмы) или, несмотря на большой объем терапии, контроль БА достигнуть не удается. Важно отличать тяжелую БА от недостаточно контролируемой. Прежде чем прийти к заключению о наличии тяжелой БА, следует убедиться, что исключены другие возможные причины отсутствия контроля: неадекватная техника ингаляции (до 80% пациентов); низкая приверженность лечению; некорректная диагностика БА; наличие коморбидных состояний (риносинусит, гастроэзофагеальный рефлюкс, ожирение, синдром обструктивного ночного апноэ и др.).
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2019-05-20; просмотров: 202; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.147.104.248 (0.081 с.) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||