
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Лекция 8. Оксосоединения (альдегиды и кетоны)Стр 1 из 6Следующая ⇒
Лекция 8. Оксосоединения (альдегиды и кетоны) Учебные вопросы: Альдегиды и кетоны в природе, их использование. Гомологический ряд альдегидов и кетонов, общая формула, изомерия, номенклатура. Природа связей в карбонильной группе. Физико-химические свойства оксосоединений. Причины, объясняющие повышенную пожарную опасность оксосоединений (по сравнению со спиртами). Основные химические реакции, в которые вступают альдегиды и кетоны: присоединение водорода, гидросульфита натрия, синильной кислоты; замещение пятихлористым фосфором, аммиаком и гидразином, окисление (неполное – до карбоновых кислот, горение, склонность к самовозгоранию), реакции полимеризации и поликонденсации альдегидов. Качественные реакции на альдегиды и кетоны. Различия в реакционной склонности альдегидов и кетонов. Краткая характеристика муравьиного и уксусного альдегидов, диметилкетона, метилэтилкетона, циклогексанона. Альдегиды и кетоны Альдегиды и кетоны представляют собой производные углеводородов, в молекулах которых имеется карбонильная группа, называемая также карбонилом, >С=О. Альдегидами называют соединения с карбонильной группой, в которых атом углерода этой группы связан, по крайней мере, с одним атомом водорода. Кетонами называют карбонилсоединения, в которых углерод карбонильной группы связан с двумя углеводородными остатками. Строение альдегидов и кетонов можно представить следующим общими формулами: R—C—H альдегид, R—C—R' кетон. II II O O
Группой, а карбонильную группу кетонов – кетогруппой. По международной номенклатуре карбонильная группа называется также оксогруппой, а альдегиды и кетоны – соответственно оксосоединениями. Общая формула СnH2nO. Альдегиды и кетоны отличаются по целому ряду свойств, однако, благодаря наличию в тех и в других карбонильной группы, в их свойствах есть много общего. Мы опишем эти соединения в одной главе, рассматривая их сходство и различия. Номенклатура и изомерия альдегидов Как мы увидим дальше, альдегиды легко окисляются, образуя кислоты с тем же углеродным скелетом. Наиболее употребительны русские и международные тривиальные названия альдегидов, происходящие от соответствующих тривиальных названий кислот, в которые альдегиды переходят при окислении. Простейший альдегид содержит один атом углерода, он называется муравьиным альдегидом или формальдегидом. Его состав и строение выражаются формулами:
Н—С—Н или Н—СН=О или СН2=О (НСОН) II II II II (III) I II (IV) O CH3 O Из них лишь нормальный (I) называется собственно валериановым или валеральдегидом и только один (II) – изовалериановым или изовалеральдегидом; для остальных из этих альдегидов изостроения используются систематические названия. Альдегиды (II) и (III) имеют один углеродный скелет, но изомерны по положению альдегидной группы. По международной заместительной номенклатуре названия альдегидов производят от заместительных названий соответствующих по углеродному скелету углеводородов, добавляя окончание – аль. Выбирая в формуле наиболее длинную (главную) углеродную цепь, в нее включают альдегидный углерод. Нумерацию цепи начинают с альдегидного углерода; при этом, поскольку альдегидная группа всегда находится при первичном углероде и, следовательно, в начале цепи, цифру 1, относящуюся к альдегидной группе, перед названием основы можно и не ставить. В соответствии с этим по заместительной номенклатуре название муравьиного альдегида – метаналь, уксусного – этаналь, н-валерианового (I) – пентаналь, изовалерианового (II) – 3-метил-1-бутаналь, или просто 3-метилбутаналь, а его изомера (III) – 2-метилбутаналь. По рациональной номенклатуре более сложные альдегиды (главным образом изостроения) рассматривают: а) как производные уксусного альдегида СН3—СН=О, в метильной группе которого атомы водорода замещены углеводородными радикалами, или б) как производные нормального альдегида, соответствующего самой длинной цепи, перед тривиальным названием которого указывают название боковых радикалов; положения последних в цепи нормального альдегида обозначают греческими буквами. (В цепи альдегидов и кетонов буквой a обозначают углерод, соседний с карбонильным углеродом, следующий за ним – буквой b и т.д., как показано в формуле (I) валерианового альдегида.) Соответственно изовалериановый альдегид (II) может быть назван как изопропилуксусный или b-метилмасляный альдегид; его изомер (III) – метилэтилуксусный или a-метилмасляный альдегид; изомер (IV) – триметилуксусный или a,a-диметилпропионовый альдегид.
О метилпропилкетон II О метилизопропилкетон Диметилкетон, или, как его обычно называют (тривиальное название), ацетон, является простейшим кетоном. Мы привели также формулы трех изомерных друг другу гомологов ацетона. На их примерах видно, что изомерия кетонов обусловлена с одной стороны, изомерией углеродного скелета (метилпропилкетон и метилизопропилкетон), с другой – изомерией положения карбонильной (кето-) группы в углеродной цепи молекулы (диэтилкетон и метилпропилкетон). Кетоны, в которых карбонильная группа связана с различными радикалами, называют смешанными кетонами (метилпропилкетон, метилизопропилкетон). Кетогруппа может быть образована только вторичными углеродными атомами; образование же карбонильной группы за счет первичных углеродных атомов, как мы видели, характерно для альдегидов. Из этого следует, что кетоны и альдегиды с одинаковым числом углеродных атомов изомерны друг другу по положению карбонильной группы. Так, ацетон и пропионовый альдегид имеют один состав (С3Н6О) и являются изомерами: СН3—С—СН3 СН3—СН2—СН II II пропионовый О ацетон О альдегид По международной заместительной номенклатуре названия кетонов производят от заместительных названий соответствующих углеводородов, добавляя к ним окончания –он. Нумерацию цепи начинают с того конца, к которому ближе кетонная группа. Цифру, обозначающую положение этой группы, ставят перед названием основы (главной цепи). В соответствии с этим по заместительной номенклатуре диметилкетон (ацетон) имеет название пропанон, диэтилкетон – 3-пентанон, метилпропилкетон – 2-пентанон, метилизопропилкетон – 3-метил-2-бутанон. Физические свойства Первый представитель альдегидов формальдегид – газообразное вещество, ацетальдегид – уже легколетучая жидкость, следующие гомологи – жидкости, температуры кипения которых по мере увеличения числа атомов углерода в молекулах закономерно возрастают. Высшие по числу углеродных атомов – альдегиды – твердые вещества. Формальдегид и ацетальдегид хорошо растворяются в воде, растворимость последующих гомологов постепенно падает. Низшие альдегиды обладают резкими характерными запахами. Среди кетонов при нормальных условиях нет газообразных веществ: уже ацетон – жидкость; высшие кетоны – твердые вещества. Для кетонов характерен не очень сильный, и даже приятный запах, на чем основано применение некоторых из них в парфюмерии. Низшие кетоны смешиваются с водой. Химические свойства Благодаря наличию в молекулах альдегидов и кетонов карбонильной группы эти вещества очень активны в химических реакциях. При этом альдегиды гораздо более реакционноспособны, чем кетоны. В карбонильной группе кислород более электроотрицателен, чем углерод, поэтому p-электроны двойной связи смещены к кислороду. Эта связь значительно поляризована, чем объясняется активность карбонильной группы (I): R
>Сd+=Оd- R®CH=O R®C =O (I) (II) (III) Алкильные остатки обладают электродонорными свойствами (способностью подавать электроны). В альдегидах смещение электронов от алкила к карбонильному углероду (II) уменьшает его частичный положительный заряд (d+). Поэтому реакционная способность карбонильной группы в уксусном альдегиде СН3—СН=О уже несколько меньше, чем в муравьином СН2=О, в котором карбонильный углерод не связан с алкилом. В ряду альдегидов реакционная способность уменьшается по мере усложнения алкильных радикалов. В кетонах под влиянием двух алкилов (III) положительный заряд карбонильного углерода и, следовательно, активность карбонильной группы еще более уменьшены. Реакции окисления Альдегиды и кетоны различно относятся к действию окислителей. Альдегиды окисляются очень легко; это обусловлено тем, что в их молекулах при уже окисленном углеродном атоме карбонильной группы имеется водород, который под действием различных окислителей (и даже кислорода воздуха) окисляется, образуя группу – ОН. Таким образом, альдегидная группа превращается в карбоксильную, и альдегиды, следовательно, окисляются в карбоновые кислоты с таким же, как в исходном альдегиде, числом углеродных атомов: [O] R—C—H ¾® R—C—OH II II Альдегид О О кислота Например: [О] [О] Н—С—Н ¾® Н—С—ОН; СН3—С—Н ¾® СН3—С—ОН II II II II О О О О II II О О Альдегид кислота В качестве реактива берут бесцветный раствор оксида серебра в водном аммиаке, содержащий комплексное соединение [Ag(NH3)2]OH. При нагревании его с альдегидом, а иногда и на холоду выпадает серебро, образующее на поверхности стеклянного сосуда зеркальный слой (реакция серебряного зеркала). II II Альдегид О О кислота Обычно для реакции берут так называемую жидкость Фелинга, которую готовят смешением раствора сульфата меди со щелочным раствором соли винной кислоты. При нагревании с альдегидом интенсивный синий цвет реактива исчезает и из раствора выпадает осадок оксид меди (I). Кетоны этих реакций не дают.
Альдегид (первичный) СН3 СН3 ½ ½ СН3—С Н ¾® СН3—СН II + ½ Ni ½ изопропиловый спирт Присоединение воды Альдегиды могут присоединять молекулы воды, образуя гидраты. Водород воды присоединяется к карбонильному кислороду, а гидроксил – к углероду:
R—CH OH R—CH—OH II + ½ ® ½ O H OH гидрат альдегида Образующийся гидрат альдегида представляет собой не что иное, как двухатомный спирт с двумя гидроксилами при одном углероде. Но мы уже знаем, что такие спирты неустойчивы: образуясь при реакциях, они выделяют воду и превращаются в соединения с карбонильной группой. Поэтому гидраты альдегидов существуют, за редким исключением, лишь в водном растворе. Приведенная реакция обратима, причем в зависимости от характера связанного с альдегидной группой радикала равновесие смещено в ту или иную сторону. Например, для раствора муравьиного альдегида оно почти полностью смещено вправо. Раствор уксусного альдегида тоже содержит значительное количество гидрата, а в случае высших альдегидов равновесие сильно смещено влево. [Интересным примером альдегида, прочно удерживающего молекулу воды, является трихлоруксусный альдегид, или хлораль, образующий устойчивый кристаллогидрат, именуемый хлоральгидратом: CCl3—CH + OH ¾® CCl3—CH—OH хлораль II ½ ½ хлоральгидрат (жидкость О Н ОН (кристаллическое с Ткип. 98 оС) вещество с Тпл. 57 оС) В этом случае два гидроксила удерживаются при одном углероде благодаря влиянию атомов хлора при соседнем углероде. Хлоральгидрат вновь отщепляет молекулу воды и образует хлораль лишь при действии серной кислоты или при кипячении.] R—CH O—R R—CH—O—R II + ½ ¾® ½ Альдегид О Н ОН полуацеталь Полуацетали – не что иное, как неполные простые эфиры рассмотренных выше гидратов альдегидов, т.е. не существующих в свободном виде двухатомных спиртов; они тоже неустойчивы: разлагаются на исходные спирт и альдегид, и реакция их образования обратима. При нагревании альдегидов со спиртами в присутствии следов сухого хлористого водорода (катализатор) первоначально образовавшиеся полуацетали реагируют с еще одной молекулой спирта и, выделяя воду, превращаются в полные простые эфиры гидратов альдегидов – в так называемые ацетали: R—CH—O—R R—CH—O—R ½ ½ OH + HO—R ¾® O—R + H2O Полуацеталь спирт ацеталь Ацетали устойчивы и могут быть выделены в чистом виде. Это обычно приятно пахнущие, труднорастворимые в воде жидкости. В отличие от простых эфиров простых спиртов ацетали в присутствии кислот гидролизуются, образуя исходный спирт и альдегид; под действием щелочей их гидролиз не происходит. В качестве примера приведем реакцию образования ацеталя из уксусного альдегида и этилового спирта: СН3—СН СН3СН2ОН СН3—СН—О—СН2—СН3 СН3СН2ОН уксусный II ¾¾¾¾® ½ ¾¾¾¾® Альдегид О ОН полуацеталь ¾® СН3—СН—О—СН2—СН3 ½ + Н2О О—СН2—СН3 Бисульфитная реакция Альдегиды присоединяют молекулу бисульфита натрия NaHSO3, образуя кристаллические бисульфитные производные: R—CH SO3Na R—CH—SO3Na II + ½ ¾® ½ О Н ОН бисульфитное Альдегид производное Кетоны также дают эту реакцию, но не все, преимущественно лишь те, у которых при карбонильной группе есть хотя бы одна метильная группа. Реакцию с бисульфитом применяют для выделения альдегидов и кетонов из различных смесей. Образующееся бисульфитное производное можно отделить, а затем разложить кислотой или щелочью; при этом вновь выделяется альдегид или кетон.
II диметил 2,2-дибромпропан О кетон (ацетон) Действие аммиака Альдегиды реагируют с аммиаком, образуя кристаллические соединения – так называемые альдегидаммиаки. Вначале молекула альдегида взаимодействует с одной молекулой аммиака; при этом выделяется вода и карбонильный кислород замещается на двухвалентный остаток аммиака – иминогруппу >NH; образующиеся вещества называются альдиминами: R—CH=O + H2NH ¾® R—CH=NH + H2O Альдегид аммиак альдимин Затем в результате соединения трех молекул альдимина (с разрывом в них двойных связей) получается альдегидаммиаки, имеющие циклическое строение:
II R—CH CH—R R—HC CH—R + II ¾® ½ ½
CH CH ½ ½ альдегидаммиак R R Альдегидаммиаки разлагаются при действии разбавленных минеральных кислот, вновь выделяя исходные альдегиды. Реакция с гидроксиламином Альдегиды и кетоны реагируют с гидроксиламином ((NH2—OH); в результате с выделением воды карбонильный кислород замещается оксииминогруппой >N—OH и образуется так называемые оксимы альдегидов (альдоксимы) и кетонов (кетоксимы) R—CH=O + H2N—OH ¾® R—CH=N—OH + H2O Оксимы обычно хорошо кристаллизуются; для каждого альдегида или кетона характерен оксим с определенной температурой плавления; это имеет большой значение для выделения и идентификации альдегидов и кетонов. Оксимы гидролизуются в присутствии минеральных кислот, выделяя исходный альдегид ил кетон. Реакция с фенилгидразином Аналогично гидроксиламину с альдегидами и кетонами реагирует фенилгидразин (NH2—NH—C6H5); при этом выделяется вода и образуется фенилгидразоны альдегидов и кетонов: R—CH=O + H2N—NH—C6H5 ¾® R—CH=N—NH—C6H5 + H2O Альдегидов и кетонов Альдегиды и кетоны вступают в реакции не только при участии их карбонильной группы, но и при участии связанных с ней углеводородных радикалов. Карбонильная группа оказывает определенное влияние на течение этих реакций. Так, в предельных альдегидах и кетонах под влиянием карбонильной группы особую подвижность приобретают атомы водорода при углеродных атомах, соседних с этой группой, или, как говорят иначе, в a-положении к карбонильной группе, они особенно легко подвергаются замещению, а также участвуют в ряде других реакций. Карбонильная группа влияет и на некоторые реакции присоединения непредельных альдегидах и кетонах. Акролеин О Br O альдегид В этом случае влияние карбонильной группы приводит к тому, что НBr присоединяется по месту двойной связи не в соответствии с правилом Марковникова. Аналогично протекает реакция присоединения воды. Это объясняется смещением p-электронов этиленовой двойной связи, вызываемым электронным сдвигом в карбонильной группе:
СН=СН—СН=О Естественно, что анион галогена (в данном случае Br-) присоединяется к атому углерода этиленовой группы, несущему частичный положительный заряд (d+). Полимеризация альдегидов Альдегиды, особенно их низшие представители, очень склонны к полимеризации. Реакция идет с разрывом двойных связей альдегидных групп, причем атомы карбонильного кислорода одной молекулы альдегида соединяются с атомами карбонильного углерода другой молекулы. Так, например, формальдегид полимеризуется по схеме: nCH2=O <=> (—CH2—O—)n СН СН ½ ½ СН3 СН3 О Н О ОН Н О О Лекция 8. Оксосоединения (альдегиды и кетоны) Учебные вопросы:
|
|||||||||
|
Последнее изменение этой страницы: 2017-02-22; просмотров: 478; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.218.168.16 (0.062 с.) |

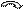
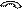
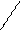

 NH NH
NH NH NH NH HN NH
NH NH HN NH II
II
 d+ d-
d+ d- 


