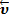Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Рябухин Ю.И., Шавель И.И., Севостьяненко Л.А.Стр 1 из 6Следующая ⇒
ФЕДЕРАЛЬНОЕ АГЕНСТВО ПО РЫБОЛОВСТВУ ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ОБРАЗОВАНИЯ "АСТРАХАНСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ" ИНСТИТУТ НЕФТИ И ГАЗА КАФЕДРА "ОБЩАЯ, НЕОРГАНИЧЕСКАЯ И АНАЛИТИЧЕСКАЯ ХИМИЯ"
Рябухин Ю.И., Шавель И.И., Севостьяненко Л.А.
ОСНОВЫ ХИМИЧЕСКОЙ КИНЕТИКИ. ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Учебно-методическое пособие Под редакцией профессора Ю.И. Рябухина
Астрахань УДК ББК Р 98
Основы химической кинетики. Химическое равновесие: учебно-методическое пособие / Рябухин Ю.И., Шавель И.И., Севостьяненко Л.А. / Под ред. проф. Ю.И. Рябухина – Астрахань: Астрахан. гос. техн. ун-т., 2016. – с.
Пособие составлено в соответствии с рекомендациями федеральных государственных образовательных стандартов высшего образования для нехимических направлений и специальностей. Предназначено для студентов, изучающим дисциплины "Химия" и "Общая и неорганическая химия". Пособие содержит теоретические основы химической кинетики и химического равновесия, исторический очерк, вопросы для самоконтроля студентов, типовые тестовые задания и лабораторную работу, а также перечень рекомендуемой литературы.
Ил.: 8, табл.: 2, библиогр.: 6 назв.
Печатается по решению кафедры "Общая, неорганическая и аналитическая химия" (протокол № 7 от 30 июня 2016).
Рецензент: кандидат химических наук, доцент Поморцева Н.П.
Компьютерный набор и вёрстка – Шахайда А.Ю, Рябухин И.Ю. © Рябухин Ю.И., Шавель И.И., Севостьяненко Л.А., 201 6
ВВЕДЕНИЕ
Химия одна из основных областей естествознания. Она изучает химическую форму движения материи [1]. Она изучает состав, строение и свойства веществ, условия и пути превращения одних веществ в другие, ведущие к изменению их состава и/или строения.
Раздел физической химии, изучающий химические реакции (от лат. re – противо и actio – действие) как процессы, протекающие во времени, их механизм изависимость от условий осуществления, называется химической кинетикой (от греч. kinētikós – приводящий в движение)[2].
Иными словами, химическая кинетика – это учение о механизмах химических реакций и закономерностях их протекания во времени. Для понимания закономерностей, определяющих протекание химических реакций, необходимо рассматривать их с позиций, как химической термодинамики (от греч. therme – жар, тепло и dynamicos – относится к силе, сильный), так и химической кинетики. Химическая термодинамика предсказывает возможность осуществления химических реакций с позиции энергетики на основе общих законов превращения теплоты, работы и энергии. Однако необходимо знать, как происходят эти реакции, и как быстро, то есть их механизм и скорость. Если химическая термодинамика позволяет определить, насколько полно произойдёт превращение исходных веществ в продукты реакции, то кинетика отвечает на вопросы, как быстро протекает химическая реакция и каков её механизм, то есть её путь; более того кинетика дает ключ к управлению реакций. Некоторые реакции, например, взаимодействие кислорода с водородом (в объемном соотношении 1:2 называется "гремучим газом"), протекают мгновенно - взрывообразно, а образование угля и нефти происходит миллионы лет. В живых системах процессы с участием химических реакций также совершаются с различной скоростью: процесс передачи нервного импульса происходит в сотые доли секунды; процессы усвоения пищи требуют нескольких часов, а процессы старения длятся десятилетия. В связи с этим любую химическую реакцию можно охарактеризовать скоростью, которая служит количественной мерой интенсивности её протекания.
Понятие о катализе
Изменение скорости химической реакции под воздействием веществ - катализаторов называется катализом (от греч.katálisis–разрушение). Катализатор – вещество, которое изменяет скорость химической реакции или вызывает её, но не входит в состав продуктов.
Влияние катализатора на скорость химической реакции заключается в его участии в этой реакции и изменении её механизма. Катализатор образует с каким-либо из реагентов промежуточное соединение, которое с другим реагентом образует продукт (продукты) реакции с высвобождением катализатора.
Например, для реакции А + В → АВ
А + К → [А… К ] → А К; А К + В → [А К… В] → АВ + К,
В присутствии катализатора изменяется механизм химической реакции, и она направляется по пути с меньшей энергией активации каждой стадии, что и приводит к увеличению её скорости (рис. 6). Активность катализатора характеризуется величиной изменения скорости реакции при введении его в химическую систему.

Координата (путь) реакции
Рис. 6. Энергетический профиль (от итал. profilo – очертание) реакции, протекающей без катализатора (а) и с участием катализатора (б): А и В – исходные вещества; АВ – продукт реакции; К – катализатор; [А…В] – активированный комплекс; [А… К ], [А К …В] – активированные комплексы с участием катализатора; А К – интермедиат (промежуточное вещество); Еа – энергия активации реакции; Е ' а , Е '' а – энергии активации двухстадийной каталитической реакции.
Типичные катализаторы кислотно-основных реакций: растворы кислот и оснований (щелочей) или твёрдые вещества с кислотными (Al2O3,TiO2, алюмосиликаты, цеолиты) или основными (CaO, BaO, MgO) свойствами. Для окислительно-востановительных реакций наиболее распространёнными катализаторами являются переходные металлы (Pt, Pd, Ni, Fe, Co), оксиды (V2O5, MnO2, MoO3, Cr2O3) и сульфиды (MoS2, WS2, CoS). На скорость химической реакции в ряде случаев влияет присутствие в системе ингибитора, который в отличие от катализатора, замедляет реакцию. Ингибитор – это вещество, которое замедляет химическую реакцию или прекращает её. Ингибирование характерно для каталитических и цепных реакций, которые протекают с участием активных центров или активных частиц. Тормозящее действие ингибитора обусловлено тем, что он блокирует активные центры катализатора или реагирует с активными частицами с образованием неактивных или малоактивных веществ. Ингибитор изменяет путь реакции, переводя какое-либо исходное вещество в интермедиат. Энергия активации процесса перехода интермедиата в продукты реакции оказывается чрезвычайно большой, и такой процесс становится маловероятным. Ингибирование широко применяется для регулирования скорости радикальной полимеризации, стабилизации полиолефинов и каучуков при их переработке и в условиях эксплуатации, для стабилизации смазочных материалов и углеводородных топлив, сохранение пищи, жиров, лекарственных препаратов, при защите металлов от коррозии. Различают два типа катализа: гомогенный, при которомкатализатор и реагирующие вещества находятся в одной фазе и гетерогенный, при которомкатализатор и реагирующие вещества находятся в разных фазах. При гетерогенном катализе реакция протекает на поверхности раздела фаз: газ – твёрдое тело, жидкость – твёрдое тело, причём твёрдое тело обычно является катализатором. Скорость гомогенных каталитических реакций прямо пропорциональна количеству катализатора, хотя оно в системе и невелико. Гомогенный катализ в растворах и биологических средах может вызываться ионами водорода Н+ (кислотный катализ) и гидроксила ОН− (оснóвный катализ), некоторыми ионами и комплексами металлов.
Скорость гетерогенных каталитических реакций сильно зависит от площади и состояния поверхности твёрдого катализатора, так как реакция происходит не на всей его поверхности, а только на её активных центрах, способных адсорбировать[10], то есть концентрировать вещества из жидкой или газовой фазы. Некоторые вещества даже при незначительном их содержании снижают или полностью подавляют активность твёрдого катализатора. Такие вещества называются каталитическими ядами. Ими являются, например, соединения мышьяка, ртути, свинца и цианиды, к которым особенно чувствительны платиновые катализаторы. Специфичность действия каталитических ядов заключается в хемосорбции их на активных центрах катализаторов. В промышленных условиях исходные вещества подвергают очистке от каталитических ядов, а «отравленные» катализаторы восстанавливают (регенерируют), обрабатывая определёнными веществами. Существуют и такие вещества, которые увеличивают активность, селективность и устойчивость катализаторов, но сами катализаторами не являются. Эти вещества называются промоторами, или сокатализаторами (промотирование платиновых катализаторов осуществляется, например, добавками металлических железа или алюминия). Действие катализаторов избирательно, поэтому, применяя разные катализаторы, можно получить из одного вещества разные продукты. Так, например, в присутствии оксида алюминия при 300 °С этиловый спирт дегидратируется, превращаясь в этилен:
CH3CH2OH
При этой же температуре, но в присутствии мелко раздробленной меди этиловый спирт дегидрируется, превращаясь в уксусный альдегид (ацетальдегид): CH3CH2OH
Особую роль играют биологические катализаторы – ферменты [11], или энзимы [12], при участии которых протекают биохимические процессы в растительных и животных организмах. ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Химические реакции бывают необратимые и обратимые. Необратимыми называют химические реакции, которые протекают только в одном направлении практически до полного расходования одного из веществ, то есть практически до конца. При протекании необратимых реакций:
а) образующиеся вещества уходят из сферы реакции – выпадают в виде осадка (обозначается стрелкой вниз ↓) или выделяются в виде газа (обозначается стрелкой вверх ↑):
BaCl2 + H2SO4 = BaSO4¯ + 2HCl,
Na2CO3 + 2HCl = 2NaCl + H2O + CO2,
б) образуются малодиссоциирующие вещества, например вода в реакции нейтрализации:
NaOH + HCl = NaCl + H2O,
в) образуются комплексные соединения:
CuSO4 + 4NH3· Н2О = [Cu(NH3)4] SO4 + 4Н2О,
г) происходит выделение большого количества энергии, например при горении магния:
Mg + ½ O2 = MgO, DH = −602,5кДж/моль.
Примером необратимых химических реакций являются, например, реакции активных металлов с кислородом, водой или неорганическими кислотами:
а также реакция термического разложения сложных веществ:
NH4NO3 = 2H2 + N2O; 2КМnО4 = K2MnО4 + MnO2 + O2. Необратимых реакций в природе меньше, чем обратимых, которые лучше называть обратимыми химическими процессами. В технике обратимые процессы, как правило, не выгодны, поэтому различными способами (изменением температуры, давления и др.) их делают практически необратимыми.
Обратимыми химическими реакциями называются процессы, в которых одновременно протекают две взаимно противоположные реакции – прямая и обратная.
В уравнениях обратимых химических процессов вместо знака равенства ставят две противоположно направленные стрелки.
Примерами обратимых химических процессов являются реакции:
а) образования (при t < 350 0C) и разложения (при t > 350 0C) йодоводорода:
Н2 + I2
б) образования и гидролиза сложного (уксусноэтилового) эфира:
Н+ СН3СООН + С2Н5ОН
Образование сложного эфира (реакция этерификации) происходит, как правило, в присутствии иона водорода как катализатора. Однако эта реакция обратима, и в кислотной среде происходит распад сложных эфиров с образованием органической кислоты и спирта (реакция гидролиза), поэтому образующуюся в реакции этерификации воду удаляют посредством добавления поглотителей: безводного хлорида кальция CaCl2 или концентрированной серной кислоты H2SO4. Поскольку в обратимом химическом процессе В таких случаях в системе без каких-либо внешних воздействий происходят взаимообратные химические превращения, которые приводят систему в устойчивое равновесное состояние, характеризующееся равенством скоростей прямой и обратной реакций (

Рис. 7. Изменение скоростей прямой
Химическим равновесием называется состояние обратимой химической реакции, при котором скорости её прямой и обратной реакций равны. Химическое равновесие является динамическим (подвижным), т.е. его установление не означает прекращение реакции. В состоянии равновесия прямая и обратная реакции продолжают идти с равными скоростями.
Состояние химического равновесия в системе характеризуется постоянством её параметров. Поэтому в системе, где протекает обратимый химический процесс, в состоянии химического равновесия наблюдается не только равенство скоростей взаимно противоположных реакций, но и постоянство равновесных концентраций исходных веществ и продуктов реакции.
Равновесными концентрациями называются концентрации всех веществ системы, которые устанавливаются в ней при наступлении состояния химического равновесия.
Равновесные концентрации веществ, выраженные в моль/л, принято обозначать их химическими формулами, заключёнными в квадратные скобки. Так, для приведённых выше примеров обратимых химических процессов а и б (с. 23, 24) следует представлять концентрации исходных и реагирующих веществ:
а) с (Н2), с (I2), с (НI); б) с (СН3СООН), с (С2Н5ОН), с (СН3СООС2Н5), с (Н2О),
а равновесные концентрации:
а) [Н2], [I2], [HI]; б) [СН3СООН], [С2Н5ОН], [СН3СООС2Н5], [Н2О].
Особенности состояния химического равновесия:
· динамический характер – прямая и обратная реакции не прекращаются, а протекают с равными скоростями; · постоянство во времени – при неизменных внешних условиях состав равновесной системы не меняется (равновесные концентрации постоянны); · подвижность – при изменении внешних условий происходит смещение химического равновесия, то есть установление новых равновесных концентраций исходных веществ и продуктов реакции; · возможность подхода к состоянию равновесия с двух сторон – как со стороны исходных веществ, так и со стороны продуктов реакции.
В равновесной химической системе нет ни исходных веществ, ни продуктов реакции, так как все вещества и процессы их взаимодействия участвуют в создании равновесия. В таких системах реагирующие вещества называются "исходными веществами" и "продуктами реакции" лишь формально в соответствии с уравнением химической реакции. Так как в основе химического равновесия лежит равенство скоростей прямой и обратной реакций, то количественная оценка состояния химического равновесия в системе характеризуется важнейшим параметром – константой равновесия, которая равна отношению констант скоростей прямой и обратной реакции:
К =
Выразим константу химического равновесия для гомогенной системы:
aА + bВ
Так как в состоянии химического равновесия
Отсюда К =
Константа химического равновесия равна отношению произведений равновесных концентраций продуктов реакций к произведению равновесных концентраций исходных веществ, возведённых в степени, равные стехиометрическим коэффициентам, при формулах этих веществ в уравнении химической реакции.
Так формулируется закон действующих масс для обратимых химических реакций.
Для гомогенной реакции:
Н2(г) + Сl2(г)
К = Для гетерогенной реакции: С(т) + О2(г)
К =
В гетерогенных системах концентрации твёрдых веществ не входят в выражение константы химического равновесия, так как они практически не влияют на скорость реакции и учитываются величинами констант скоростей гетерогенных реакций. Величина константы химического равновесия определяет положение равновесия, то есть относительное содержание исходных веществ и продуктов реакции в системе, находящейся в равновесном состоянии. Если К > 1, то в системе больше содержание продуктов реакции, чем исходных веществ, равновесие реакции смещено вправо (→). Если К < 1, то в системе выше содержание исходных веществ, чем продуктов реакции, равновесие смещено влево (←). Константа химического равновесия зависит от природы реагирующих веществ и температуры, но не зависит от концентрации реагирующих веществ, а в случае газообразных веществ и от давления в системе, так как эти факторы не влияют на константы скоростей химических реакций. Константа химического равновесия также не зависит от наличия катализатора в системе, поскольку он изменяет скорость как прямой, так и обратной реакции в одинаковое число раз. Однако увеличивая скорости прямой и обратной реакций, катализатор уменьшает время, необходимое для достижения равновесия в системе (рис.8).
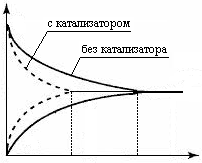
Рис. 8.Влияние катализатора на время установления равновесия в обратимой реакции в присутствии катализатора (t1) и без катализатора (t2) ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ
1. Ниже указаны направления смещений равновесий химических процессов при изменении температуры:
а) 2H2 (r) + O2 (r) ← 2Н2О(r) (температура повышается); б) 3H2 (r) + N2 (r) → 2NН3(r) (температура понижается); в) СаСО3(т) → СаО(т) + СО2(r) (температура повышается). Укажите знаки тепловых эффектов и изменения энтальпий для прямых реакций этих процессов. Составьте выражения для констант этих равновесий.
2. Как влияет изменение давления на равновесие в системах:
а) H2 (r) + Сl2 (г) б) СН4 (г) + 2О2 (г) в) 2H2 (r) + O2 (r) Напишите выражения для констант этих равновесий.
3. Как влияет изменение давления на равновесие в системах:
а) Fe2О3 (т) + 3Н2 (г) б) Н2О (ж) в) СuО (т) + СО (г) Составьте выражения для констант этих равновесий.
4. Как влияет изменение давления на равновесие в системах:
а) 2ZnS (т) + 3О2 (r) б) 3H2 (r) + N2 (r) Напишите выражения для констант этих равновесий.
5. Как влияет изменение давления на равновесие в системах:
а) 2SО2 (г) + О2 (г) б) 3NО2 (г) + Н2О (ж)
6. Как повлияет уменьшение давления на равновесие в системах:
а) N2O4 (r) б) 2NО(r) + О2(r) в) FеО(т) + СО (г)
7. Начальные концентрации газообразных оксида углерода и хлора в системе СО + Сl2
8. Составьте кинетическое уравнение для реакции 2NO + O2
9. Как следует изменить давление в системах: а) СО (г) + Н2О (г) б) Н2 (г) + I2 (г) чтобы скорость прямых реакций увеличилась соответственно в 36 и 16 раз?
10. Если объём газовой смеси уменьшить в 3 раза, то, как изменятся при этом скорости прямой и обратной реакций в системе:
а) СО + Сl2 б) 2SО2 + О2 и как это скажется на состоянии химического равновесия?
11. Как изменятся скорости прямой и обратной реакций и как повлияет на состояние химического равновесия увеличение давления в 3 раза в системах: а) N2 + 3Н2 б) Н2 + Сl2
12. Составьте кинетическое уравнение для реакции 2SO2 + O2
13. Составьте кинетические уравнения для гомогенных реакций:
а) 2A + 3B б) N2O4
14. Каков физический смысл константы скорости химической реакции?
15. Составьте кинетические уравнения для прямой и обратной реакций, протекающих в газообразных системах:
а) N2 + O2 б) СО + Cl2 в) N2 + 3H2 Как изменятся скорости этих реакций, если: а) уменьшить концентрацию каждого из реагирующих веществ в 2 раза; б) увеличить давление в каждой системе в 3 раза.
16. Составьте выражение для константы равновесия обратимой реакции СО2(г)+ С(т) Как изменится скорость прямой реакции, если концентрацию оксида углерода(IV) уменьшить в 4 раза? Как следует изменить давление в системе, чтобы повысить выход оксида углерода(II)?
17. Образование фосгена осуществлялось в закупоренном сосуде при 22 0С согласно уравнению реакции СО + Сl2 Определите концентрации реагирующих газообразных веществ и константу данного химического равновесия, зная, что в реакцию вступила половина оксида углерода.
18. Как изменится скорость химической реакции, протекающей в газовой фазе, при понижении температуры в системе на 30 0С, если температурный коэффициент её скорости равен 3?
19. Дайте определения понятиям "катализ" и "катализатор".
20. При нормальных условиях две химические реакции протекают с одинаковой скоростью (γ1=3, γ2=4). Как будут относится скорости прямой и обратной реакций при температуре 313 К?
ТЕСТОВЫЕ ЗАДАНИЯ Химическая кинетика
1. Гомогенной является реакция …. 1) СаСО3 (т) + 2НСl (р) = СаСl2 (р) + Н2О (ж) + СО2 (г) 2) 2SО2 (г) + О2 (г) = 2SО3 (г) 3) S (т) + О2 (г) = SО2 (г) 4) С (т) + СО2 (г) = 2СО (г)
2. Гетерогенной является реакция …. 1) Zn (т) + Н2О (г) = ZnО (т) + Н2 (г) 2) Н2 (г) + I2 (г) = 2НI (г) 3) 4НСl (г) + О2 (г) = 2Сl2 (г) + 2Н2О (г) 4) 2Н2О (г) = 2Н2 (г) + О2 (г)
3. Увеличение скорости химической реакции при повышении температуры обусловлено увеличением …. 1) энергии активации 2) числа активных молекул 3) общего числа молекул 4) объёма системы
4. При увеличении концентрации вещества А в 2 раза и уменьшении концентрации вещества В в 2 раза скорость реакции 2А + В = 2АВ …. 1) возрастёт в 2 раза 2) возрастёт в 4 раза 3) уменьшится в 2 раза 4) не изменится
5. На каталитический характер химической реакции указывает увеличение интенсивности …. 1) горения угля при его измельчении 2) горения фосфора при внесении его в атмосферу кислорода 3) разложения пероксида водорода в присутствии оксида марганца(IV) 4) горения серы при подаче кислорода
6. Скорость реакции А (г) + В (т) = АВ (г) определяется кинетическим уравнением ….
1) υ = k · с А 2) υ = k · с В 3) υ = k · с АВ 4) υ = k · с А · с В
7. Для увеличения скорости реакции 2NО + О2 = 2NО2, протекающей в газовой фазе, в тысячу раз давление в системе необходимо увеличить в … раз. 1) 5 2) 10 3) 15 4) 20
8. Константа скорости химической реакции – это …. 1) средняя скорость движения реагирующих веществ в газообразном состоянии 2) число соударений реагирующих частиц за единицу времени в единице объёма 3) скорость реакции при равных концентрациях реагирующих веществ 4) скорость реакции при единичных концентрациях реагирующих веществ
9. К изменению константы скорости химической реакции может привести изменение …. 1) давления или объёма системы 2) температуры системы 3) концентрации исходных веществ 4) концентрации конечных веществ
10. Если при неизменной температуре концентрацию водорода в системе N2 (г) + 3Н2 (г)
1) увеличится в 3 раза 2) уменьшится в 3 раза 3) увеличится в 27 раз 4) увеличится в 9 раз
11. Если при температуре 25 0С давление в системе
FеО(т) + СО(г) увеличить в 2 раза, то скорость восстановления оксида железа …. 1) увеличится в 2 раза 2) уменьшится в 2 раза 3) увеличится в 4 раза 4) уменьшится в 4 раза
12. Если, не изменяя температуру, давление в системе
СО (г) + Н2 (г) уменьшить в 4 раза, то скорость обратной реакции …. 1) не изменится 2) уменьшится в 4 раза 3) увеличится в 4 раза 4) уменьшится в 16 раз
13. Для увеличения скорости разложения оксида углерода согласно уравнению реакции 2СО (г) = СО2 (г) + С (т) в 9 раз его концентрацию необходимо увеличить в … раза, (раз).
1) 1,5 2) 2 3) 3 4) 6
14. Значения температурных коэффициентов скоростей большинства химических реакций находятся в пределах …. 1) 1 – 9 2) 2 – 4 3) 2 – 6 4) 1 – 6
15. Если температурный коэффициент скорости химической реакции равен 3, то её скорость при повышении температуры на 20 К …. 1) уменьшится в 3 раза 2) увеличится в 9 раз 3) уменьшится в 6 раза 4) увеличится в 6 раз
7.2. Химическое равновесие"
1. Константа равновесия изменяется при …. 1) изменении давления в системе 2) изменении температуры в системе 3) введении катализатора в систему 4) изменении концентрации реагирующих веществ
2. Равновесие смещается влево при понижении температуры в системах … 1) С (т) + Н2О (г) 2) Н2 (г) + Сl2 (г) 3) РСl5 (г) 4) СО (г) + Сl2 (г)
3. Понижение температуры вызывает смещение химического равновесия вправо в системах …. 1) СО (г) + Н2О (г) 2) С (т) + СО2 (г) 3) 4НСl (г) + О2 (г) 4) Н2 (г) + I2 (г)
4. Увеличение давления практически не влияет на химическое равновесие в системе …. 1) 2SО2 (г) + О2 (г) 2) N2 (г) + 3Н2 (г) 3) FеО (т) + СО (г) 4) 3NО2 (г) + Н2О (ж)
5. Химическое равновесие смещается вправо при увеличение давления в системе …. 1) 2NО (г) + О2 (г) 2) 2Н2О (г) 3) N2О4 (г) 4) СаСО3 (т)
6. Химическое равновесие в системе 2СО (г) + О2 (г)
1) понижение температуры 2) увеличении давления 3) введении катализатора 4) уменьшении давления
7. Фактором, способствующим смещению химического равновесия вправо в системе СаСО3 (т)
1) повышение температуры в системе 2) увеличение давления в системе 3) введение катализатора в систему 4) увеличение концентрации оксида углерода
8. Смещение химического равновесия влево в системе
Н2 (г) + Сl2 (г)
вызывает …. 1) повышение температуры 2) понижение температуры 3) введение катализатора 4) увеличение давления
9. Повышение выхода оксида углерода(II), получаемого согласно уравнению обратимой реакции
|
|||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-21; просмотров: 283; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.220.137.164 (0.368 с.) |

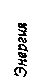
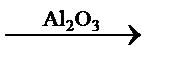 H2C = CH2 + H2O.
H2C = CH2 + H2O. CH3-CНО + Н2.
CH3-CНО + Н2. 2HI;
2HI;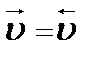 ).
). и обратной
и обратной 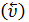 реакции и установление химического равновесия
реакции и установление химического равновесия

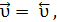 то
то
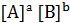 =
= 

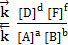 .
. .
.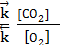 .
. =
=