Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Уравнение изобары химической реакции
K2ΔrH ln K1 = R ((1/T1) – (1/T2)) Прогнозирование смещения химического равновесия. С помощью уравнения изотермы можно рассчитать G реакции при заданном значении Πc, если известна Kc реакции. И наоборот, если известна G реакции при заданном Πc, то можно рассчитать Kc. Гомеостаз - относительное динамическое постоянство внутренней среды (крови, лимфы, тканевой жидкости) и устойчивость основных физиологических функций (кровообращения, дыхания, терморегуляции, обмена веществ и т. д.) организма человека и животных. Регуляторные механизмы, поддерживающие физиологическое состояние или свойства клеток, органов и систем целостного организма на оптимальном уровне, называются гомеостатическими. Учение о гомеостазе - это учение о жизненных процессах, имеющих только одну цель: поддержание постоянства условий жизни во внутренней среде, как необходимый элемент свободной и независимой жизни. Основная функция буферных систем предотвращение значительных сдвигов рН путём взаимодействия буфера как с кислотой, так и с основанием. Действие буферных систем в организме направлено преимущественно на нейтрализацию образующихся кислот. В организме одновременно существует несколько различных буферных систем. В функциональном плане их можно разделить на бикарбонатную и небикарбонатную. Небикарбонатная буферная система включает гемоглобин, различные белки и фосфаты. Она наиболее активно действует в крови и внутри клеток. Организм можно определить как физико-химическую систему, существующую в окружающей среде в стационарном состоянии. Именно эта способность живых систем сохранять стационарное состояние в условиях непрерывно меняющейся среды и обусловливает их выживание. Для обеспечения стационарного состояния у всех организмов - отморфологически самых простых до наиболее сложных - выработались разнообразные анатомические, физиологические и поведенческие приспособления, служащие одной цели - сохранению постоянства внутренней среды. Химическая кинетика как основа для изучения скоростей и механизмов биохимических процессов. Скорость реакции, средняя скорость реакции в интервале, истинная скорость. Факторы, влияющие на скорость реакции. Химическая кинетика изучает скорости химических реакций, их зависимость от различных факторов и механизмы реакций. Последовательность и характер стадий химических реакций называют механизмом реакции.
Скорость химической реакции (v) определяется изменением концентрации Ас реагирующих веществ (или продуктов реакции) в единицу времени. Размерность скорости химической реакции — концентрация/время: Скорость химической реакции в общем случае не является постоянной в течение всего времени ее протекания. Рассмотрим обратимую реакцию: Истинная скорость (в любой момент времени) определяется первой производной концентрации по времени: Скорость химической реакции зависит в первую очередь от природы реагирующих веществ. Скорость гомогенной реакции зависит от концентрации реагентов, а гетерогенных — от площади соприкасающихся фаз, т. е. степени дисперсности. Скорости всех реакций зависят от температуры, многих реакций — от присутствия катализаторов. Классификации реакций, применяющиеся в кинетике: реакции, гомогенные, гетерогенные и микрогетерогенные; реакции простые и сложные (параллельные, последовательные, сопряженные, цепные). Молекулярность элементарного акта реакции. Кинетические уравнения. Порядок реакции. Период полупревращения. По фазовому состоянию реагентов реакции бывают гомогенные (однородные) и гетерогенные (неоднородные). В гомогенных реакциях все взаимодействующие вещества находятся в одной фазе (газовой, жидкой или твердой). Зоной реакции при проведении гомогенных реакций служит весь реакционный объем. В гетерогенных процессах реагенты, принимающие участие в реакции, находятся в разных фазах. В реакционном объеме одновременно находятся две или более фазы, а химическая реакция протекает на границе раздела фаз или в объеме одной из фаз.
По механизму различают простые и сложные реакции. Простые реакции осуществляются посредством однотипных элементарных актов. Под элементарным актом понимают единичный акт взаимодействия или превращения частиц, в результате которого образуются новые частицы продуктов реакции или промежуточных соединений. В элементарном акте принимает участие одна или две частицы (описаны единичные случаи одновременного взаимодействия трех частиц). Для осуществления сложных реакций необходимы разнотипные (не менее двух) элементарные акты. Различают следующие типы сложных реакций: параллельные, последовательные, сопряженные, цепные. Для параллельных реакций характерно протекание нескольких процессов с участием одних и тех же исходных веществ. Эти процессы завершаются образованием разных продуктов реакции. Скорость параллельных реакций определяется наиболее быстрой стадией. В последовательных реакциях образование конечного продукта реакции из исходных веществ происходит не непосредственно, а через ряд промежуточных продуктов. Скорость последовательной реакции определяется наиболее медленной стадией, которая называется лимитирующей. Некоторые сложные реакции состоят как из последовательных, так и параллельных В любом элементарном акте участвует одна, две или (очень ред- ко) три частицы. Таким образом, для каждой элементарной реакции можно указать её молекулярность. В мономолекулярных реакциях участвует одна молекула, кото- рая либо распадается на две части, либо перегруппировывает свои атомы. В бимолекулярном процессе происходит столкновение двух частиц, что приводит к их химическому превращению. Тримолекулярные элементарные реакции, в которых происхо- дит одновременное столкновение трёх частиц с последующим обра- зованием продуктов, обнаруживаются редко. Вероятность истинной тримолекулярной стадии в газовой фазе очень мала: тройные столк- новения происходят гораздо реже (1:1000), чем двойные. реакций. Уравнение, описывающее зависимость скорости реакции (v) от концентрации (с) реагирующих веществ, называется кинетическим. Важной характеристикой реакции является период полупревращения t0 5 — время, за которое в реакцию вступает половина исходного вещества. Для радионуклидов аналогичная величина называется периодом полураспада.
13.Зависимость скорости реакции от концентрации. Кинетические уравнения реакций первого, второго и нулевого порядков. Экспериментальные методы определения скорости и константы скорости реакций. Скорость гомогенной хим. Реакции определяется изменением концентрации реагирующих веществ (или продуктов реакции) в единицу времени. Скорость прямой реакции уменьшается по мере расходования исходных веществ, а скорость обратной реакции увеличивается по мере накопления продуктов реакции. Когда скорости прямой и обратной реакции сравняются, система перейдет в состояние химического равновесия.
Истинная скорость в любой момент времени является только положительной величиной и определяется первой производной концентрации по времени V= - Средняя скорость: Vср = Зависимость скорости хим.реакции от концентрации описывается кинетическим уравнением. Порядок реакции показывает, каким образом скорость реакции зависит от концентрации реагентов. Порядок кинетического уравнения может принимать значения 0,1,2 и 3; он может быть также дробным. Уравнения нулевого порядка: С0– с1=kt; C0-0.5C0=kt0.5 ; T0.5= Где с0– начальная концентрация реагента; с1 – концентрация реагента в момент времениt; k– константа скорости реакции; T0.5 – период полураспада. Уравнения первого порядка: ln= T0.5= Где ct=0.5c0 Уравнения второго порядка: T0.5= Закон действующий масс(Закон Гульберта и Вааге): скорость химической реакции пропорциональна произведению концентраций реагирующих веществ в степени их стехиометрических коэффициентов. Т.е. чем больше концентрация, тем больше скорость хим.реакции. Измерение скорости реакции основано на определении концентрации одного из реагирующих веществ через различные промежутки времени от начала реакции. Для определения концентраций можно применять методы физико-химического анализа, основанные на зависимости физических свойств смеси от её состава (например, определение показателя преломления, угла вращения плоскости поляризации, вязкости, электрической проводимости, объёма, плотности, изменения температур замерзания и кипения, интенсивности окраски и т. п.), и методы аналитической химии (например, титрование). Поскольку концентрации по ходу реакции непрерывно меняются, то необходимо или очень быстрое измерение концентрации (методы физико-химического анализа), или торможение реакции во взятой пробе (химический контроль). Торможение может быть достигнуто охлаждением, резким разбавлением, устранением катализатора или совместным действием всех указанных факторов. Если реакция, протекающая в газовой фазе, сопровождается изменением числа молекул, то её течение удобно контролировать по изменению давления смеси во времени.
К сравнительно медленным реакциям со временем полупревращения порядка получаса и более можно применять спектроскопию, масс-спектрометрию и хроматографию. Для исследования скоростей очень быстрых реакций (с периодом полупревращения до 10-7и даже 10–9с) используются специально разработанные методы и особая аппаратура.
14. Зависимость скорости реакции от температуры. Правило Вант - Гоффа. Температурный коэффициент скорости реакции и его особенности для биохимических процессов. Правило Вант-Гоффа: при повышении температуры на 10 градусов скорость гомогенной хим.реакции увеличивается в 2-4 раза.
где V2 — скорость реакции при температуре Т2,V1— скорость реакции при температуре Т1, Из уравнения Вант-Гоффа температурный коэффициент вычисляется по формуле:
Теория активных соударений обобщает закономерности зависимости скорости хим.р-и от температуры: 1.Реагировать могут не все молекулы, а только находящиеся в особом активном состоянии 2.Активация молекулы происходит в результате биомолекулярного столкновения. 3.При столкновении частиц с примерно одинаковым запасом энергии происходит её перераспределение, в результате чего энергия одной из молекул достигает значения, соответствующего энергии активации. 4.Влияние температуры на скорость реакции: смещение равновесия между обычными и активными молекулами в сторону увеличения концентрации первых. Энергетический профиль реакции (график зависимости потенциальной энергии от координаты реакции)
|
||||||||
|
Последнее изменение этой страницы: 2017-02-21; просмотров: 303; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.22.240.205 (0.017 с.) |
 ,наиболее употребляемая единица измерения — моль на литр-секунду (моль/л*с)
,наиболее употребляемая единица измерения — моль на литр-секунду (моль/л*с)
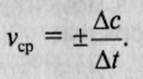
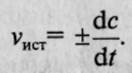
 . Если измерение истинной скорости проводят по изменению концентрации исходных веществ, то перед производной ставят знак минус:
. Если измерение истинной скорости проводят по изменению концентрации исходных веществ, то перед производной ставят знак минус:

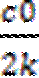 ;
;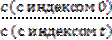 = -kt;
= -kt; =
=  ;
;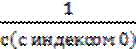 -
-  =kt;
=kt; ;
;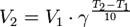
 — температурный коэффициент реакции (если он равен 2, например, то скорость реакции будет увеличиваться в 2 раза при повышении температуры на 10 градусов).
— температурный коэффициент реакции (если он равен 2, например, то скорость реакции будет увеличиваться в 2 раза при повышении температуры на 10 градусов).