
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тепловой баланс процессов, протекающих на первой тарелке
Приход тепла с газом Q1 = m×Cp×t, где m - количество поступающих газов, равное 10399,1 нмоль; Ср - средняя молярная теплоемкость газов, равная в пределах 0-100°С 30,0 кДж/(кмоль×°С); t - температура поступающего газа, °С. Q1 = 10399,1×30,0×35 = 10800000 кДж. Приход тепла в результате окисления NO: Q2 = m×q, m – количество окислившегося NO (32 кмоль). Q2 = 32× Приход тепла от образования безводной HNО3: Q3 = m×q =80,8× Приход тепла от разбавления моногидрата до 65%-го раствора HNО3: Q4 = m×q =80,8×19700=1590000 кДж. Расход тепла с уходящими газами Q1 = m×Cp×t = 10302,8×29,7×35=10720000 кДж. Определим количество тепла, уносимого охлаждающей водой: Q = 10800000+1805000+2985000+1590000-10720000=6400000 кДж. Рассчитываем расход воды на отнятие тепла реакции при начальной температуре воды 20°С и конечной 25°С:
Для определения поверхности змеевиков принимаем диаметр труб змеевиков 38´2,5 мм и количество труб в секции 36. Скорость воды в трубках составляет:
Коэффициент теплоотдачи от кислоты к стенке принимаем равным 2326 Вт/(м2×°С). Коэффициент теплоотдачи от стенки к воде определяем по уравнению:
где d - диаметр трубок, раdный 0,033 м; R - радиус кривизны змеевика, равный 0,95 м; tср - средняя температура воды, равная 22,5°С;
Находим коэффициент теплопередачи:
где d1 - толщина стояка трубки (0,0025 м); d2 - толщина накипи на стенках (0,0005 м); l1 - коэффициент теплопроводности хромо-никелевой стали, равный 17,45 Вт/(м×°С); l2 - коэффициент теплопроводности накипи, 2,33 Вт/(м×°С).
Средняя разность температур составляет 35 20 Dtср= Змеевиков на первой тарелке будет:
Объем труб:
Объем межтарелочного пространства:
По мере снижения скорости окисления вследствие уменьшения концентрации NO и NO2 в верхней части колонны можно увеличивать расстояние между тарелками в соответствии с уравнением
где В.И.Атрощенко совместно с В.С.Багдасаряном, Н.И.Перловым и В.К.Фурсиковой разработан метод расчета равновесного состава нитрозных газов над растворами HNO3 через степень его окисленности и составлены соответствующие номограммы. При этом используется известное уравнение равновесия для реакции (40) и реакции^
2NO2 = N2O4 + 56940,48 кДж.
где
Обозначим через Р - общее давление газа, ат; an - начальную концентрацию всех оксидов азота в исходном газе, в долях ед.; рn - парциальное давление оксидов в начальном газе; aн - степень окисления оксидов азота в начальном газе, доли ед. Тогда: A = P×aн(3-2×aн); или A = рn(3-2×aн) = 2рn(1,5-aн). Для определения равновесной степени окисления aр составлена таблица, в которой aр приведены в зависимости lg(A/K) и lg (K1K). Определив по таблице aр, можно вычислить равновесный состав газа по уравнениям
где рр - парциальное давление всех оксидов азота при равновесии, ат; pno+2n2o4 - парциальное давление NO + 2N2О4 при равновесии, ат. При этом не учитываем изменения объема газа вследствие реакции. По таблице находим при
и
равновесная степень окисления оксидов азота составит aр»0,89, что соответствует предыдущему расчету
В таком случае парциальное давление оксидов азота при равновесии
такое же, как это получено при расчете.
Расчет карбамида (NН2)2СО, стр 486-509 (Лобойко)
Карбамид - концентрированное азотное удобрение для разных почв под различные сельскохозяйственные культуры. В животноводстве применяется как заменитель протеина. Синтез карбамида осуществляется при температуре 458-468 К и давлении 19-20 МПа из жидкого аммиака и газообразной двуокиси углерода по суммарной реакции: NH3 + CO2 = CO(NH2)2 + H2O (48) Реакция протекает в две стадии по уравнениям: NH3 + CO2 = NH2COONH4 + 125,69 кДж (49) 2COONH4 = NH2-CO-H2N + H2O - 15,51 кДж (50) Технологический процесс производства карбамида состоит из следующих стадий: ·Синтез карбамида; ·Дистилляция плава; ·Концентрирование раствора карбамида; ·Гранулирование концентрированного раствора карбамида. Быстрый рост производства карбамида обусловлен усовершенствованием его технологии и конструктивного оформления процесса синтеза, успехами химического машиностроения, а также доступностью и дешевизной исходного сырья.
Технологическая схема производства карбамида изображена на рисунке 5.
Рис. 5. Технологическая схема производства карбамида: 1 - углекислотный компрессор; 2 - колонна синтеза; 3 - разлагатель первой ступени; 4 - разлагатель второй ступени; 5 - подогреватель; 6 - газосепаратор; 7,8 - вакуум-кристаллизаторы; 9, 27 - центробежные насосы; 10 - центрифуга; 11 - эжектор; 12 - сборник; 13 - вентиляторы; 14 - циклон; 15 - плавитель; 16 - грануляционная башня; 17 - конвейер; 18 - сушилка; 19 - калорифер; 20, 21 - конденсаторы-абсорберы аммиака и С02; 22 - промывная колонна; 23 - теплообменник к промывной колонне; 24 - конденсатор; 25 - буферная емкость; 26 - плунжерные насосы
Материальный баланс
Расчет годового выпуска при 330 рабочих дня в год:
Стехиометрический выход NH3 и CO2 в соответствии с реакцией 49 составит:
где 17; 44; 60 – молярные массы соответственно NH3, СО2, (NH2)2СО; 1,07 – коэффициент, учитывающий потери карбамида. Практический выход реагентов в цикле с учетом их мольного соотношения и степени превращения составит:
Масса NH3, СО2, H2О, которые направляются в цикл с раствором угле-аммонийных солей (УАС), определяется следующим образом. Обозначим массовые доли компонентов NH3, СО2, H2О в УАС соответственно a, b, g. В соответствии с практическими данными a=30%, т.к. a+b+g=1, то g=0,7-b. Тогда:
где П – потери карбамида при дистилляции и выпаривании за исключением безвозвратных потерь: П = 0,05+0,01-0,005 = 0,055.
Масса свежего и оборотного аммиака без учета того, что возвращается с УАС:
Масса воды, введенной со свежим и оборотным аммиаком:
где 0,002 – содержание воды в аммиаке. Кроме того, массу воды, введенной со свежим и оборотным аммиаком, можно определить из равновесия:
Следовательно:
Тогда: b=0,4858, g=0,7-0,4858=0,2142. Определим массу воды, которая приходит с раствором УАС:
Всего в цикл с раствором УАС поступает:
Масса свежего и оборотного аммиака без учета аммиака, поступающего с УАС:
Масса воды, введенной со свежим и оборотным аммиаком:
|
||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-19; просмотров: 204; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.15.202.4 (0.028 с.) |
 =1805000 кДж.
=1805000 кДж. =2985000 кДж.
=2985000 кДж.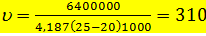 м3/ч.
м3/ч.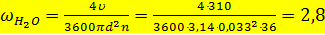 м/с.
м/с.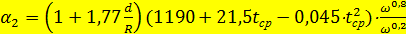 ,
,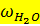 - скорость движения воды, равная 2,8 м/с
- скорость движения воды, равная 2,8 м/с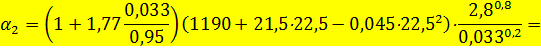
 ккал/(м2×ч×°С) = 9130 Вт/(м2×°С).
ккал/(м2×ч×°С) = 9130 Вт/(м2×°С). ,
, Вт/(м×°С).
Вт/(м×°С). 35
35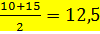 .
. м;
м; м3;
м3;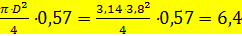 м3.
м3.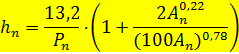
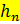 - свободное расстояние между тарелками, м;
- свободное расстояние между тарелками, м; 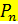 - давление на данной тарелке, Па;
- давление на данной тарелке, Па; 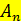 - общая степень абсорбции, достигаемая на n-й тарелке, %,
- общая степень абсорбции, достигаемая на n-й тарелке, %,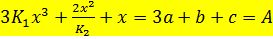 ,
, - частная константа равновесия NO и NO2 с НNO3, ат-2 [
- частная константа равновесия NO и NO2 с НNO3, ат-2 [  - частная константа равновесия NO2 с N2O4, ат [
- частная константа равновесия NO2 с N2O4, ат [ 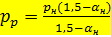 ;
;  ,
,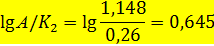
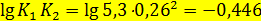
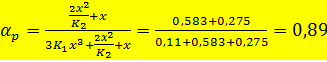 .
.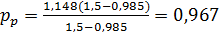 ат,
ат,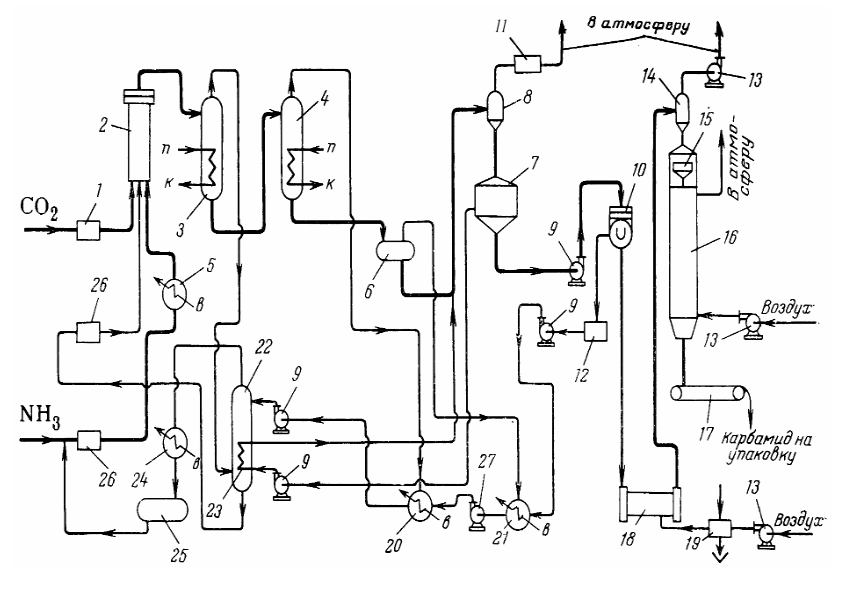
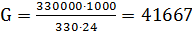 кг/год.
кг/год.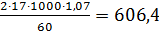 кг NH3,
кг NH3, кг СО2,
кг СО2,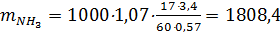 кг/т;
кг/т;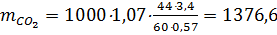 кг/т;
кг/т;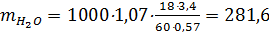 кг/т.
кг/т.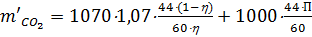 ;
;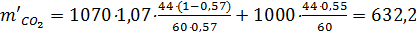 кг/т;
кг/т;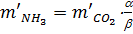 ;
;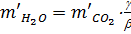 .
.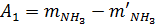
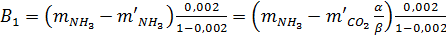 ;
;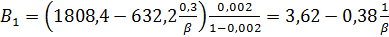 ;
; ;
;
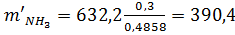 кг/т;
кг/т;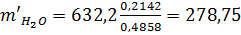 кг/т.
кг/т.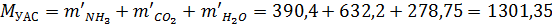 кг/т.
кг/т.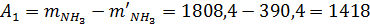 кг/т.
кг/т. кг/т.
кг/т.


