Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Кинетика химических процессов.Стр 1 из 4Следующая ⇒
Кинетика химических процессов. Кинетика биологических процессов изучает поведение во времени самых разнообразных процессов, присущих различным условиям живой материи: биохимические превращения в клетке, генерацию электрического потенциала на биологических мембранах, биологические ритмы, процессы накопления биомассы или размножения вида, взаимодействия популяции живых организмов в биоценозах. В этом определении охвачен широкий спектр уровней сложности рассматриваемых систем от молекулярного до ценотического. Общим для всех процессов считается «поведение во времени».
ЭЛЕМЕНТАРНЫЕ КИНЕТИЧЕСКИЕ УРАВНЕНИЯ И ИХ РЕШЕНИЕ Здесь будут рассмотрены кинетические уравнения, которые первоначально были получены в химической кинетике. Это - дифференциальные уравнения, в левой части которых стоит скорость изменения во времени концентрации какого-либо вещества. Правая часть уравнения составляется на основе закона действующих масс, согласно которому скорость элементарной стадии химической реакции при постоянной температуре пропорциональна концентрациям реагирующих веществ в степенях, равных их стехиометрическим коэффициентам в химическом уравнении этой стадии. Закон действующих масс является макроскопическим выражением статистического механизма взаимодействий на молекулярном уровне, который в упрощенном виде можно представить так. Для того, чтобы два атома или две молекулы химически прореагировали друг с другом, они должны встретиться. Скорость реакции должна быть пропорциональной числу встреч или столкновении в единицу времени. Очевидно, что чем больше концентрация каждого из реагирующих веществ, тем больше число столкновении. Следовательно, скорость химической реакции пропорциональна концентрациям реагирующих веществ. Соотношения, подобные закону действующих масс, могут хотя бы в самом грубом приближении оказаться полезной моделью процессов, происходящих в системах, элементами которых могут быть самые разнообразные объекты органического происхождения. Наибольшая степень, в которой концентрации входят в правую часть кинетического уравнения, определяет порядок реакции. Реакции нулевого порядка Если скорость реакции не зависит от концентрации участвующих в реакции реагентов, ее называют реакцией нулевого порядка.
Пусть вещество А превращается в вещество В со скоростью, не зависящей от наличной концентрации вещества А. Запишем химическое уравнение
Обозначим строчными буквами концентрации a и b, получим кинетические уравнения
Решения этих уравнений представляют собой лишенные функции от времени
Ситуацией, когда скорость реакции не зависит от концентрации реагента, являются условия, при которых количество реагента столь велико, что не лимитирует протекание процесса с максимальной скоростью, определяемой константой В числе ферментов, расщепляющих в полипептидной цепочке связь между карбоксильной и аминной группой, имеется фермент карбопепсидаза. Водные растворы этого фермента разной концентрации облучали одной и той же дозой ионизирующей радиации. При прямом действии вероятность попадания ионизирующей частицы в молекулу фермента должна с увеличением концентрации фермента возрастать. При косвенном действии число инактивированных молекул фермента должно оставаться одним и тем же независимо от концентрации раствора, так как облучение одной и той же дозой ведет к образованию одинакового числа свободных радикалов, способных прореагировать только с определенным числом молекул фермента. Так оно и оказалось. В широком диапазоне изменении концентрации фермента число инактивированных молекул оставалось постоянным. Этот феномен был назван Дейлом эффектом разбавления.
Линейные цепи реакций Множество метаболических процессов и процессов более высокого уровня биологической организации представляют цепи последовательных превращений, которые можно упрощенно представить в виде трехзвенной цепи: субстрат - промежуточный продукт – конечный продукт:
(8) Оговорим вновь условия протекания процесса. При
(9) Решение первого из уравнений (9) можно записать сразу:
Из условия постоянства массы вещества в системе имеем:
Подставляя это выражение в последнее из уравнении (9), получим
(10) Общее решение этого уравнения с правой частью, отличной от нуля, как известно, складывается из решения однородного уравнения
и частного решения неоднородного уравнения. Это частное решение будем искать в виде
где
Приравнивая свободные члены и коэффициенты при экспонентах, найдем
Полное решение уравнения (10) выглядит с учетом общего решения однородного уравнения так:
Из начальных условий найдем константу интегрирования
Выражение для
Частным случаем трехзвенной цепи является также последовательность превращений первого и пулевого порядков
В этом случае кинетические уравнения упрощаются:
и дают такие решения (при сохранении указанных условий):
Характерными примерами подобных цепей являются многие ферментативные реакции при высоких концентрациях субстрата, некоторые стадии всасывания аминокислот, условия размножения насекомых и др. Разветвленные цепи реакций В процессах превращения веществ (и во многих биологических процессах более высокого уровня) нередко их развитие может происходить двумя альтернативными путями (возможно и большее ветвление процесса). Рассмотрим простейший случай, когда вещество А может превращаться либо в В, либо в С, но с разными в общем случае константами скоростей:
Считаем систему закрытой и в начальный момент времени
(11) Решая эти уравнения, получим:
Нетрудно видеть, что Конкурентное ингибирование Более сложный пример кинетики ферментативного катализа имеет место, когда в системе существует фактор, ингибирующих ферментативный процесс. Ингибирование может быть конкурентным и неконкурентным. Здесь мы рассмотрим случай конкурентного ингибирования, когда ингибитор фермента объединяется с последним и образует комплекс
(14) имеется еще обратимая реакция
(15)
для которой константа диссоциации определяется выражением
(16) Здесь
Но в случае существования наряду с комплексом
и предыдущее равенство можно расписать как
Чтобы избавиться от величин в правой части этого уравнения, которые нельзя рассчитать, воспользуемся таким рассуждением, опирающимся на закон действующих масс. Если бы все молекулы фермента были задействованы в реакции, скорость ее была бы максимальной
Из выражений для
Откуда
отсюда получим
После несложных алгебраических преобразований получаем уравнение, аналогичное уравнению Лайнуивсра—Бэрка, но уже с учетом конкурентного ингибирования:
(17) Кинетика химических процессов. Кинетика биологических процессов изучает поведение во времени самых разнообразных процессов, присущих различным условиям живой материи: биохимические превращения в клетке, генерацию электрического потенциала на биологических мембранах, биологические ритмы, процессы накопления биомассы или размножения вида, взаимодействия популяции живых организмов в биоценозах. В этом определении охвачен широкий спектр уровней сложности рассматриваемых систем от молекулярного до ценотического. Общим для всех процессов считается «поведение во времени».
ЭЛЕМЕНТАРНЫЕ КИНЕТИЧЕСКИЕ УРАВНЕНИЯ И ИХ РЕШЕНИЕ Здесь будут рассмотрены кинетические уравнения, которые первоначально были получены в химической кинетике. Это - дифференциальные уравнения, в левой части которых стоит скорость изменения во времени концентрации какого-либо вещества. Правая часть уравнения составляется на основе закона действующих масс, согласно которому скорость элементарной стадии химической реакции при постоянной температуре пропорциональна концентрациям реагирующих веществ в степенях, равных их стехиометрическим коэффициентам в химическом уравнении этой стадии. Закон действующих масс является макроскопическим выражением статистического механизма взаимодействий на молекулярном уровне, который в упрощенном виде можно представить так. Для того, чтобы два атома или две молекулы химически прореагировали друг с другом, они должны встретиться. Скорость реакции должна быть пропорциональной числу встреч или столкновении в единицу времени. Очевидно, что чем больше концентрация каждого из реагирующих веществ, тем больше число столкновении. Следовательно, скорость химической реакции пропорциональна концентрациям реагирующих веществ.
Соотношения, подобные закону действующих масс, могут хотя бы в самом грубом приближении оказаться полезной моделью процессов, происходящих в системах, элементами которых могут быть самые разнообразные объекты органического происхождения. Наибольшая степень, в которой концентрации входят в правую часть кинетического уравнения, определяет порядок реакции. Реакции нулевого порядка Если скорость реакции не зависит от концентрации участвующих в реакции реагентов, ее называют реакцией нулевого порядка. Пусть вещество А превращается в вещество В со скоростью, не зависящей от наличной концентрации вещества А. Запишем химическое уравнение
Обозначим строчными буквами концентрации a и b, получим кинетические уравнения
Решения этих уравнений представляют собой лишенные функции от времени
Ситуацией, когда скорость реакции не зависит от концентрации реагента, являются условия, при которых количество реагента столь велико, что не лимитирует протекание процесса с максимальной скоростью, определяемой константой В числе ферментов, расщепляющих в полипептидной цепочке связь между карбоксильной и аминной группой, имеется фермент карбопепсидаза. Водные растворы этого фермента разной концентрации облучали одной и той же дозой ионизирующей радиации. При прямом действии вероятность попадания ионизирующей частицы в молекулу фермента должна с увеличением концентрации фермента возрастать. При косвенном действии число инактивированных молекул фермента должно оставаться одним и тем же независимо от концентрации раствора, так как облучение одной и той же дозой ведет к образованию одинакового числа свободных радикалов, способных прореагировать только с определенным числом молекул фермента. Так оно и оказалось. В широком диапазоне изменении концентрации фермента число инактивированных молекул оставалось постоянным. Этот феномен был назван Дейлом эффектом разбавления.
|
|||||||||
|
Последнее изменение этой страницы: 2017-02-19; просмотров: 203; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.133.79.70 (0.155 с.) |



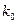 - константа скорости реакции нулевого порядка.
- константа скорости реакции нулевого порядка.
 и
и 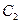 – константы интегрирования, которые можно найти, задав начальные условия (например, при
– константы интегрирования, которые можно найти, задав начальные условия (например, при 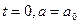 и
и  ).
).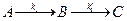
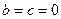 . Система закрытая, так что
. Система закрытая, так что 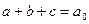 в любой момент времени. Запишем систему уравнений:
в любой момент времени. Запишем систему уравнений: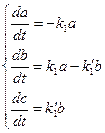
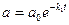
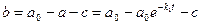
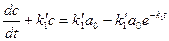
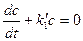

 и
и  - искомые постоянные. Подставляя это выражение в уравнение (10), получим
- искомые постоянные. Подставляя это выражение в уравнение (10), получим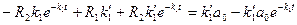
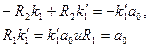

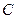 :
: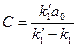
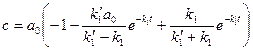
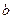 находится без труда из условия сохранения количеств вещества. После несложных преобразовании оно приводится к виду:
находится без труда из условия сохранения количеств вещества. После несложных преобразовании оно приводится к виду: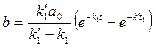

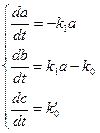
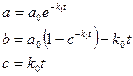


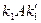
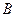
 . Кинетические уравнения запишутся следующим образом:
. Кинетические уравнения запишутся следующим образом: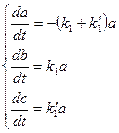
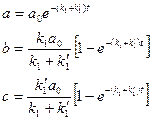
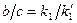 , т. е. количества конечных продуктов gо каждому направлению относятся как константы скоростей но этим направлениям.
, т. е. количества конечных продуктов gо каждому направлению относятся как константы скоростей но этим направлениям. , что в свою очередь исключает возможность образования фермент-субстратного комплекса
, что в свою очередь исключает возможность образования фермент-субстратного комплекса  . Ингибитор, таким образом, конкурирует с субстратом за взаимодействие с ферментом. При этом наряду с процессом
. Ингибитор, таким образом, конкурирует с субстратом за взаимодействие с ферментом. При этом наряду с процессом


 - концентрация фермент-ингибиторного комплекса. Из равенства (16) с учетом условия (14) следует, что
- концентрация фермент-ингибиторного комплекса. Из равенства (16) с учетом условия (14) следует, что


 , а концентрация фермент-субстратного комплекса
, а концентрация фермент-субстратного комплекса  равнялась бы
равнялась бы  . При наличии ингибитора отношение действительной скорости к максимальной должно быть пропорционально реальной концентрации фермент-субстратного комплекса, отнесенной к максимально возможной, т. е.
. При наличии ингибитора отношение действительной скорости к максимальной должно быть пропорционально реальной концентрации фермент-субстратного комплекса, отнесенной к максимально возможной, т. е.
 и
и  следует, что
следует, что