
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Основы молекулярно-кинетической теории газов
●Закон Бойля-Мариотта
где p — давление; V — объём; Т — термодинамическая температура; m — масса газа.
● Закон Гей-Люссака и закон Шарля
● Закон Дальтона для давления смеси n идеальных газов
где
● Уравнение состояния идеального газа (уравнение Менделеева- Клапейрона)
где
● Зависимость давления газа от концентрации n молекул и температуры Т
где
● Основное уравнение молекулярно-кинетической теории идеальных газов
или
или
где
● Скорость молекул:
наиболее вероятная
средняя квадратичная
средняя арифметическая
● Средняя кинетическая энергия поступательного движения молекулы идеального газа
● Закон Максвелла для распределения молекул идеального газа по скоростям
где функция ● Закон Максвелла для распределения молекул идеального газа по энергиям теплового движения
где функция f(ε) распределения молекул по энергиям теплового движения определяет относительное число молекул
● Барометрическая формула
где
● Распределение Больцмана во внешнем потенциальном поле
где n и n0 – концентрация молекул на высоте h и h0.
● Среднее число соударений, испытываемых молекулой газа за 1 секунду,
где d — эффективный диаметр молекулы; n – концентрация молекул;
● Средняя длина свободного пробега молекул газа
● закон теплопроводности Фурье
где Q теплота, прошедшая посредством теплопроводности через площадь S за время t;
где сv — удельная теплоемкость газа при постоянном объеме; ρ — плотность газа.
● Закон диффузии Фика
где М — масса вещества, переносимая посредством диффузии через площадь S за время t;
● Закон Ньютона для внутреннего трения (вязкости)
где F — сила внутреннего трения между движущимися слоями площадью S;
Основы термодинамики ● Средняя кинетическая энергия поступательного движения, приходящаяся на одну степень свободы молекулы,
● Средняя энергия молекулы
где
● Внутренняя энергия газа
где
● Первое начало термодинамики
где Q — количество теплоты, сообщенное системе или отданное ею;
● Первое начало термодинамики для малого изменения системы
● Молярные теплоемкости газа при постоянном объеме и постоянном давлении
● Уравнение Майера
● Изменение внутренней энергии идеального газа
● Работа, совершаемая газом при изменении его объема,
● Полная работа при изменении объема газа
где V1 и V2 — соответственно начальный и конечный объемы газа.
● Работа газа:
при изобарном процессе
при изотермическом процессе
● Уравнение адиабатического процесса (уравнение Пуассона)
где
● Работа в случае адиабатического процесса
где T1 , T2 и V1, V2 — соответственно начальные и конечные температура и объем газа.
● Термический коэффициент полезного действия для кругового процесса (цикла)
где Q1 — количество теплоты, полученное системой; Q2 — количество теплоты, отданное системой; А — работа, совершаемая за цикл.
● Термический коэффициент полезного действия цикла Карно
где T1 — температура нагревателя; T2 — температура холодильника.
● Изменение энтропии при равновесном переходе из состояния 1 в состояние 2, в переменных Р V
В переменных Т, V
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Задача 1. В баллоне объёмом 20л находится аргон под давлением 1,0 Мпа и температуре 300 К. После того как из баллона было взято 20,0 г аргона, температура в баллоне понизилась до 280 К. Определить давление газа, оставшегося в баллоне.
Решение: Для решения задачи воспользуемся уравнением состояния идеального газа, применив его к начальному и конечному состояниям газа:
Из уравнений (1) и (2) выразим m1 и m2 и найдём их разность:
откуда находим
Проверку решения проведем по размерности физических величин. В правую часть вместо символов величин подставим их единицы измерения. В правой части два слагаемых. Первое из них имеет размерность давления, так как состоит из двух множителей, первый из которых – давление, а второй – безразмерный. Проверим второе слагаемое:
Вычисления произведём по формуле (3) с учётом, что для аргона
Ответ: 875 кПа.
Задача 2. Определите наиболее вероятную скорость молекул газа, плотность которого при давлении р = 40 кПа составляет r = 0,35 кг/м3.
Решение: Воспользуемся формулой
Из уравнения состояния выражаем плотность газа:
Тогда, подставляя, получим
Задача 3. Плотность газа увеличили в k 1 = 3 раза, а температуру уменьшили в k 2 = 4 раза. Как изменилось число столкновений молекул в единицу времени?
Решение:
Среднее число столкновений молекул в единицу времени находится по формуле
где
Формула для вычисления средней скорости:
связь концентрации молекул с плотностью газа определяется формулой:
Эффективный диаметр молекул d, т.е. минимальное расстояние, на которое сближаются при столкновении центры молекул, зависит от скорости сталкивающихся молекул, т.е. от температуры газа (несколько увеличивается при понижении температуры). Но при решении данной задачи это изменение величины d учитывать не будем.
Подставляем записанные выражения в первую формулу:
тогда после изменения давления и температуры
т. е. длина свободного пробега при этом увеличится в
Следует отметить, что в формулы входит именно термодинамическая температура.
Задача 4. Коэффициенты диффузии и внутреннего трения водорода при некоторых условиях равны соответственно D=1,42 см2/сек и η=8,5·10-6 Н·сек/м2. Найти число молекул водорода в 1 м3 при этих условиях.
Решение: Для решения задачи воспользуемся формулами расчета коэффициента внутреннего трения (динамической вязкости) и коэффициента диффузии:
Объединив формулы (1) и (2), получим
Откуда следует, что плотность водорода равна
С другой стороны плотность газа может быть найдена по формуле
Объединив формулы (3) и (4), получим выражение для массы водорода
Известно, что число молекул
где m = 2·10-3 кг/моль — молярная масса водорода,
N A = 6,02·1023 1/моль — число Авогадро.
Из формул (5) и (6) находим концентрацию молекул газа
Подставив численные значения, получим:
Ответ: n = 1,8·1025 м-3
Задача 5. Работа расширения некоторого двухатомного идеального газа составляет А = 2 кДж. Определите количество подведенной к газу теплоты, если процесс протекал: 1) изотермически; 2) изобарно; Решение: Согласно первому началу термодинамики подведенное к газу количество теплоты Q расходуется им на изменение внутренней энергии и на совершение работы расширения: Q= D U+A.
1) В случае T= const,
2) При p= constполучаем
где D T — изменение температуры при изобарном увеличении объема на D V. Из уравнений начального и конечного состояний получаем:
т. е.
Тогда
где i = 5, т.к. газ двухатомный.
Задача 6. Баллон содержит
Решение:
По закону Дальтона давление смеси равно сумме парциальных давлений газов, входящих в состав смеси. По уравнению Менделеева — Клапейрона парциальные давления
Следовательно, по закону Дальтона давление смеси двух газов:
откуда объем баллона
Произведем вычисления, учитывая, что масса кислорода,
Ответ:
Задача 7. Гелий массой
Решение:
Определим количество вещества
где m = 2·10-3 кг/моль — молярная масса гелия.
Рассмотрим каждый участок цикла отдельно.
(1-2): запишем первый закон термодинамики
На данном участке давление пропорционально объему:
где
Работа
где Воспользуемся уравнением состояния идеального газа
тогда
где для одноатомного гелия число степеней свободы
Так как
(2-3): Так как
где
(3-1):
где Так как
Итого:
Замечание: используя геометрический смысл работы в координатной плоскости (р, V) видно, что работу за цикл можно рассчитать, определив площадь фигуры цикла (в нашем случае – это площадь треугольника).
Ответ:
Задача 8. Двигатель работает как машина Карно и за цикл получает от нагревателя
1. Совершаемую за цикл работу; 2. Количество теплоты, отдаваемое холодильнику.
Решение:
Запишем формулу для КПД тепловой машины:
т. к. двигатель работает по циклу Карно, то
Совершаемая газом работа за цикл
Тогда
где
Количество теплоты:
Ответ:
Задача 9. Один моль идеального двухатомного газа, находящегося в закрытом сосуде, охладили с
Решение:
Запишем второй закон термодинамики в формулировке Клаузиуса
где dS — приращение энтропии. По первому закону термодинамики, записанному для элементарного теплового процесса
Элементарное приращение внутренней энергии газа
тогда
Для идеального газа молярная теплоемкость при постоянном объеме
где i — число степеней свободы. Из уравнения состояния идеального газа следует, что
Тогда
После деления на абсолютную температуру Т, имеем
Проинтегрируем полученное дифференциальное уравнение, расставляя пределы интегрирования
Итого, приращение энтропии
Замечание: Используя полученное выражение для
где
Рассчитаем изменение энтропии газа, учитывая, что при закрытом сосуде
(для двухатомного газа число степеней свободы
Ответ: энтропия газа уменьшилась на
Задача 10. Во сколько раз следует изотермически увеличить объем идеального газа в количестве 3 моль, чтобы его энтропия увеличилась на 25 Дж/К?
Решение:
Для обратимого процесса
где
Так как процесс изотермический, то для идеального газа
Изменение энтропии
Из последнего соотношения находим
Показатель экспоненты – величина безразмерная.
Вычисления:
Ответ:
КОНТРОЛЬНАЯ РАБОТА № 4 1. В баллоне емкостью V = 10 л находится газ при температуре t = 27 0С. Вследствие утечки газа, давление в баллоне снизилось на DР = 4,14 кПа. Какое количество молекул вышло из баллона, если температура газа не изменилась? 2. Концентрация молекул газа идеального двухатомного газа равна n = 5·1024 м-3 . При этом средняя энергия молекулы равна E = 8,5·10-20 Дж. Найти давление, оказываемое молекулами газа на стенки сосуда. 3. В баллоне находилось m = 10 кг некоторого газа при давлении P1 = 107 Па. Найти, какое количество газа Dm взяли из баллона, если давление в нем понизилось до P2 = 2,5·106 Па. 4. Сколько молекул воды содержится в стакане объемом V = 200 мл? 5. Газ, находящийся при температуре t = 27 0С занимает объем V. До какой температуры следует изобарно охладить газ, чтобы его объем стал равен 0,75V? 6. В баллоне объемом V = 15 л находится смесь идеальных газов, при температуре T = 300 К. Смесь содержит 0,3 моля углекислого газа, 0,2 моля азота и 0,1 моля кислорода. Найти молярную массу смеси и давление в баллоне. 7. Определить концентрацию молекул водорода, находящегося в сосуде под давлением P = 2,67·105 Па, если средняя квадратичная скорость движения молекул при этих условиях равна 8. В сосуде объемом V = 5 л содержится 14 г азота и 22 г углекислого газа при температуре t = 57 0С. Найти число молекул содержащихся в сосуде. 9. Смесь водорода и азота общей массой m = 290 г при температуре Т = 600 К и давлении Р = 2,46 МПа занимает объем V = 30 л. Найти массу водорода и массу азота. 10. Смесь кислорода и азота находится в сосуде при давлении Р = 1,2 МПа. Определить парциальные давления газов, если массовая доля кислорода в смеси составляет 0,2 %. 11. Объем воздушного шара V = 224 м3, масса оболочки m = 145 кг. Шар наполнен горячим воздухом при нормальном атмосферном давлении Р = 1,01·105 Па. Какую температуру должен иметь воздух внутри оболочки, чтобы шар начал подниматься? Температура воздуха вне оболочки t = 0 0С, молярную массу воздуха принять равной m = 29·10-3 кг/моль. 12. В горизонтальной, запаянной с одного конца капиллярной трубке столбик ртути длинной L = 40 см запирает столбик воздуха длиной l = 20 см. Какой окажется длина воздушного столба в трубке, если ее поставить вертикально открытым концом вниз. Атмосферное давление считать равным 760 мм рт. ст. 13. В сосуде объемом V = 30 л содержится идеальный газ при температуре t = 0 0С. После того как часть газа выпустили, давление в сосуде понизилось на D Р =0,78 атм без изменения температуры. Найти массу выпущенного газа Dm. Плотность этого газа при нормальных условиях r = 1,3 г/л. 14. Посередине откачанной и запаянной с обоих концов капиллярной трубке длиной L = 1 м находится столбик ртути длинной l = 20 см. Если капилляр поставить вертикально, то столбик ртути переместится на расстояние D l = 10 см. До какого давления был откачан капилляр? 15. При нагревании 16. Плотность некоторого газа равна r = 6·10-2 кг/м3, средняя квадратичная скорость равна 17. Внутри закрытого горизонтально расположенного поршня находится тонкий поршень, способный скользить без трения. В одной части цилиндра находится водород массой m 1 = 3 г водорода, а в другой m 2 = 18 г азота. Температуры газов одинаковы. Какую часть объема цилиндра занимает водород? 18. В баллоне объёмом 19. С глубины h = 10 м всплывает шарообразный пузырек воздуха. На какой глубине радиус пузырька увеличится в n = 1,2 раза, если атмосферное давление Р = 1·105 Па? Плотность воды r = 1000 20. В баллоне объемом V = 22,4 л находится водород при нормальных условиях. После того, как в баллон было введено дополнительно некоторое количество гелия, давление в баллоне повысилось до значения Р = 0,5·106 Па. Считая процесс изотермическим определить массу гелия, введённого в баллон. 21. Определить плотность водорода, если средняя длина свободного пробега его молекул 22. Определить коэффициент теплопроводности азота при температуре t = 10 0С и давлении Р = 1·105 Па. 23. Коэффициенты диффузии и динамической вязкости водорода при некоторых условиях равны соответственно D = 1,42 см2/с и h = 8,5·106 Па/с. Найти число молекул водорода в 1 м3при этих условиях. 24. Определить среднее число соударений в секунду 25. Азот и кислород находятся при одинаковой температуре. Во сколько раз коэффициент вязкости кислорода больше, чем коэффициент вязкости азота? 26. Плотность гелия при некоторых условиях r = 2·10-2 кг/м3. Найти среднюю длину свободного пробега молекул гелия при этих условиях. 27. Какое максимальное число молекул аргона должно находиться в 1 см3 сферического сосуда, чтобы молекулы не сталкивались друг с другом? 28. Найти среднее число столкновений в 1 секунду молекул некоторого газа 29. В сферической колбе объемом 2 л находится кислород. При какой плотности кислорода средняя длина свободного пробега его молекул 30. В сосуде находится углекислый газ, плотность которого r = 1,7 кг/м3. Средняя длина свободного пробега его молекул при этих условиях равна
31. Найти удельные теплоемкости C v и C р некоторого газа, если известно, что его молярная масса m = 84 г/моль, а отношение C р / C v = 1,67. 32. Найти удельные и молярные теплоемкости C v и C р водяного пара. 33. Двухатомный идеальный газ занимает объем V = 8 л. Определить теплоемкость этого газа при постоянном давлении C р. 34. Чему равны удельные теплоемкости C v и C р некоторого двухатомного газа, если плотность этого газа при нормальных условиях r = 1,43 кг/м3. 35. Найти удельную теплоемкость при постоянном объеме газовой смеси, состоящей из 12 киломолей гелия и 7 киломолей азота. 36. Смесь содержит 10 г гелия и 16 г кислорода. Найти показатель адиабаты g = C р / C v для этой смеси газов. 37. Удельная теплоемкость газа при постоянном давлении равна 976 Дж/(кг·К), а молярная масса равна 30 г/моль. Определить число степеней свободы молекулы этого газа. 38. Разность между удельной теплоемкостью при постоянном давлении и удельной теплоемкостью при постоянном объеме некоторого газа равна 260 Дж/(кг·К). Определить число степеней свободы молекул этого газа. 39. Удельная теплоёмкость некоторого трехатомного газа при постоянном объеме C v = 567 Дж/(кг·К). Определить, что это за газ. 40. Некоторый двухатомный газ находится под давлением Р = 2·105 Па и температуре Т = 600 К. Найти плотность этого газа, если его удельная теплоемкость при постоянном давлении C р = 909 Дж/(кг·К). 41. При изотермическом расширении 10 г азота, находящегося при температуре t = 17 0С, была совершена работа А = 860 Дж. Во сколько раз изменилось давление азота? 42. В сосуде под поршнем площадью S = 100 см2 находится 56 г азота при температуре t1 = 20 0С. Азот нагревают до температуры t2 = 120 0С. На какую высоту поднимется поршень? Атмосферное давление принять равным Р = 1·105 Па. 43. Газ, занимающий объем V = 5 л и находящийся под давлением Р = 2·105 Па и при температуре t = 27 0С нагревают изобарно. Расширяясь газ совершил работу А = 200 Дж. Чему стала равна температура газа в конце процесса расширения? 44. Работа некоторого газа при его изотермическом расширении с увеличением объема в два раза А = 575 Дж. Найти среднеквадратичную скорость молекул этого газа при этой температуре. Масса газа 10 г. 45. Некоторое количество кислорода сжимают так, что его объем уменьшается от V1 = 15 л, до объема V2 = 3 л. Как выгоднее сжимать газ – адиабатически или изотермически? 46. 16 г водорода находятся под давление Р = 2 атм. и температуре t = 57 0С. Газ нагревают при постоянном давлении, вследствие чего его объем становится равным V = 15 л. Найти работу, совершенную газом при расширении. 47. Один м
|
|||||||||
|
Последнее изменение этой страницы: 2017-02-19; просмотров: 328; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.137.170.183 (0.37 с.) |
 при
при  ,
, при
при 
 ;
; при
при  ,
, ,
,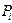 — парциальное давление i — го компонента смеси.
— парциальное давление i — го компонента смеси. ,
, — газовая постоянная, μ — молярная масса газа.
— газовая постоянная, μ — молярная масса газа. ,
, — постоянная Больцмана (k=R/ N A ), N A = 6,02·1023 1/моль — число Авогадро.
— постоянная Больцмана (k=R/ N A ), N A = 6,02·1023 1/моль — число Авогадро.  ,
,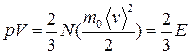 ,
, ,
, — средняя квадратичная скорость молекул; Е — суммарная кинетическая энергия поступательного движения всех молекул газа; n — концентрация молекул;
— средняя квадратичная скорость молекул; Е — суммарная кинетическая энергия поступательного движения всех молекул газа; n — концентрация молекул;  — масса одной молекулы;
— масса одной молекулы;  — масса газа; N — число молекул в объеме газа V.
— масса газа; N — число молекул в объеме газа V. ;
; ;
; .
. .
.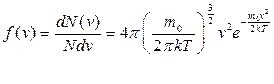 ,
, (
( ) распределения молекул по скоростям определяет относительное число молекул
) распределения молекул по скоростям определяет относительное число молекул 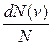 из общего числа N молекул, скорости которых лежат в интервале от
из общего числа N молекул, скорости которых лежат в интервале от  .
. ,
, из общего числа N молекул, которые имеют кинетические энергии
из общего числа N молекул, которые имеют кинетические энергии  , заключенные в интервале от ε до ε+dε.
, заключенные в интервале от ε до ε+dε. ,
, и
и  – давление газа на высоте h и h0.
– давление газа на высоте h и h0. ,
, ,
, .
. ,
, — градиент температуры; λ — коэффициент теплопроводности:
— градиент температуры; λ — коэффициент теплопроводности: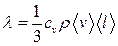 ,
, ,
, — градиент плотности, D — коэффициент диффузии:
— градиент плотности, D — коэффициент диффузии: .
. ,
, — градиент скорости; η — коэффициент динамической вязкости:
— градиент скорости; η — коэффициент динамической вязкости: .
. .
.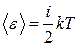 ,
, — число степеней свободы.
— число степеней свободы. ,
, — количества вещества; m — масса газа; μ — молярная масса газа.
— количества вещества; m — масса газа; μ — молярная масса газа. ,
, — изменение её внутренней энергии; А — работа системы против внешних сил.
— изменение её внутренней энергии; А — работа системы против внешних сил. .
. ,
,  .
. .
. .
. .
.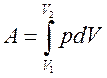 ,
, , или
, или  ;
; , или
, или  .
.
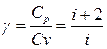 — показатель адиабаты.
— показатель адиабаты. или
или  ,
, ,
, ,
, .
.
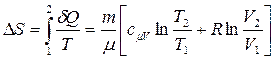 .
. , (1)
, (1) . (2)
. (2) ,
,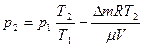 (3)
(3)
 кг/моль.
кг/моль.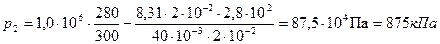 .
.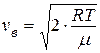 .
. ,
, = 478 м/с.
= 478 м/с. ,
, — средняя скорость движения молекул, d — эффективный диаметр молекул, n — концентрация молекул.
— средняя скорость движения молекул, d — эффективный диаметр молекул, n — концентрация молекул. ,
,
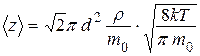 ,
, ,
, =
=  = 1,5 раза.
= 1,5 раза. (1)
(1) (2)
(2)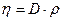
 (3)
(3) (4)
(4) (5)
(5) можно рассчитать по формуле
можно рассчитать по формуле , (6)
, (6)
 = 0, D U
= 0, D U  = 0 и Q 1 = A = 2 кДж.
= 0 и Q 1 = A = 2 кДж. ,
, ,
,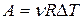 .
. =
=  = 7 кДж.
= 7 кДж. кислорода и
кислорода и  аргона. Давление смеси газов
аргона. Давление смеси газов  , температура
, температура  . Принимая данные газы за идеальные, определить объем V баллона.
. Принимая данные газы за идеальные, определить объем V баллона. кислорода и
кислорода и  аргона выражаются формулами:
аргона выражаются формулами:


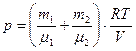

 –—молярная
–—молярная – молярная масса аргона
– молярная масса аргона .
. .
. совершает цикл, изображенный на рисунке. Найти работу А, совершаемую газом за один цикл, количество теплоты, принятое от нагревателя
совершает цикл, изображенный на рисунке. Найти работу А, совершаемую газом за один цикл, количество теплоты, принятое от нагревателя  и переданное холодильнику
и переданное холодильнику  за цикл, КПД цикла, если
за цикл, КПД цикла, если  ,
, 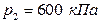 ,
, 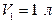 ,
,  .
.
 ,
, .
. ,
, .
. определяется, исходя из изотермического смысла работы газа в координатной плоскости (р, V):
определяется, исходя из изотермического смысла работы газа в координатной плоскости (р, V): .
. .
. ,
,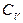 — молярная теплоемкость при постоянном объеме.
— молярная теплоемкость при постоянном объеме. ,
, , тогда
, тогда .
.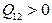 , то газ на этом участке получает от нагревателя теплоту.
, то газ на этом участке получает от нагревателя теплоту. , то
, то  и первый закон термодинамики принимает вид
и первый закон термодинамики принимает вид ,
, ;
;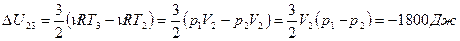 .
. , значит внутренняя энергия уменьшается.
, значит внутренняя энергия уменьшается. . Так как
. Так как  , то газ на этом участке отдает теплоту холодильнику.
, то газ на этом участке отдает теплоту холодильнику. ,
,  (газ совершает «отрицательную» работу; его сжимают).
(газ совершает «отрицательную» работу; его сжимают).
 — молярная теплоемкость при постоянном давлении.
— молярная теплоемкость при постоянном давлении. , то газ на участке 3-1 также отдает теплоту холодильнику.
, то газ на участке 3-1 также отдает теплоту холодильнику. ,
, .
. или
или  .
.
 ,
,  ,
, 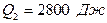 ,
, 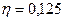 .
.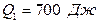 теплоты. Температура нагревателя
теплоты. Температура нагревателя  , температура холодильника
, температура холодильника  . Найти:
. Найти: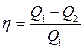 ,
, .
.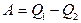 .
. ,
,  ,
, ,
,  .
.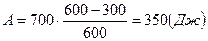
 (Дж).
(Дж).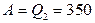 Дж.
Дж. до
до  . На сколько и как изменилась энтропия газа?
. На сколько и как изменилась энтропия газа? ,
,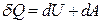 или
или  .
. ,
, .
.
 .
. .
.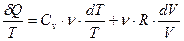 ,
, .
.
 ,
, .
.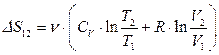 .
. и уравнение Менделеева-Клапейрона для начального и конечного состояний идеального газа, легко получить
и уравнение Менделеева-Клапейрона для начального и конечного состояний идеального газа, легко получить ,
, .
. .
. ,
, 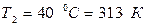 ,
, 
 ).
). .
. .
. ,
,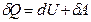 .
. , а элементарная работа равна
, а элементарная работа равна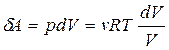 .
. для изотермического процесса будет равно
для изотермического процесса будет равно .
. .
. .
. .
. = 2·103 м/с.
= 2·103 м/с.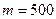 гр газа на
гр газа на  изобарически требуется на
изобарически требуется на  теплоты больше, чем при изохорическом нагревании. Что это за газ?
теплоты больше, чем при изохорическом нагревании. Что это за газ? л находится смесь, содержащая
л находится смесь, содержащая  водорода,
водорода,  водяного пара и
водяного пара и  азота. Температура смеси
азота. Температура смеси 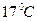 . Определите давление.
. Определите давление. , температуру считать постоянной по всей глубине.
, температуру считать постоянной по всей глубине. = 0,1 см.
= 0,1 см. и длину свободного пробега молекулы водорода при температуре t = 27 0С и давлении Р = 1·10-3 мм рт. ст.
и длину свободного пробега молекулы водорода при температуре t = 27 0С и давлении Р = 1·10-3 мм рт. ст.


