
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Гетерокоагуляция и гетероадагуляция.
Слипание разнородных частиц называется гетерокоагуляцией. Прилипание частиц дисперсной системы к вводимой в систему чужеродной поверхности называется гетероадагуляцией. Гетероадагуляция наблюдается при отложении частиц красителя на волокне, при проклеивании бумажной массы при получении бумаги, в процессах получения водоотталкивающих тканей. Явление вызвано адсорбцией стабилизатора на чужеродной поверхности, в результате чего понижается его концентрация в системе.
Коагуляция под действием электрического поля.
Переменное электрическое поле может усиливать коагуляцию. Это вызвано поляризацией частиц и последующим притяжением разноименно-заряженных частей поверхностей. Особо важно это явление в эмульсиях. Оно применяется при обезвоживании нефтей или, наоборот, очистке воды от масел и нефтепродуктов.
Стабилизация коллоидов.
При адсорбции ПАВ на поверхности частиц образуются сольватные слои. Они могут структурироваться при взаимной ориентации и сильном притяжении молекул в адсорбционном слое. Прочные адсорбционно-сольватные слои создают структурно механический барьер, препятсвующий слипании частиц. Вещества, создающие такие слои называются стабилизаторами. Это как правило ВМС. Их защитное действие может быть настолько велико, что стабилизированный коллоидный раствор сохраняет агрегативную устойчивость даже при очень высоких концентрациях дисперсной фазы. Подвижность частиц при этом очень ограниченна, но коллоидный раствор не теряет своей устойчивости. Создаются пространственные структуры из стабилизирующих коллоидных частиц (гели, или студни) Защитное действие ВМС проявляются при достаточной его концентрации в коллоидном растворе. При малых концентрациях ВМС они могут могут вызывать коагуляцию (флокуляция): концы молекулы ВМС присоединяются к 2 частицам, скрепляя их и образуя хлопьевидные частицы коагулянта (флоккулы).
Кинетика коагуляции.
Скорость коагуляции характеризуется изменением числа частиц в единицу времени, то есть:
V – частичная концентрация дисперсных частиц, τ – время. Зависимость скорости коагуляции V от концентрации коагулянта С представляет собой кривую:
которую условно можно разделить на 3 области: 1 - скорость коагуляции близка к «0». Золь можно считать практически устойчивым (зона устойчивости); 2 – скорость коагуляции возрастает с ростом концентрации коагулянта (электролита), - зона медленной коагуляции;
Количественная теория быстрой коагуляции разработана Смолуховским в 1916 г.
Теория быстрой коагуляции Смолуховского. Предполагается, что в области быстрой коагуляции любое столкновение частиц приводит к их слипанию. Вокруг частиц существует силовое поле. Если a - расстояние, на которое действуют силы притяжения, R – радиус частиц, то силовое поле вокруг частиц ограниченно сферой радиуса (R+a) – это сфера притяжения. Условием коагуляции по Смолуховскому является перекрывание сфер притяжения 2 частиц. Для количественного описания коагуляции пользуемся уравнениями формальной химической кинетики (т.е. коагуляция как реакция 2 порядка). Тогда:
к – константа, характеризующая вероятность сближения.
ρ – расстояние; D – скорость броуновской диффузии
получим:
откуда численная концентрация золя в момент τ:
определим по уравнению (4) время половинной коагуляции частиц τ1/2: подставим:
с учетом (2): подставим в уравнение (4)
Уравнение (7) позволяет, зная ν0 и ν для различных τ вычислить τ1/2 и k. Из (3) следует, что 1/ν – линейная функция τ. На опыте эта зависимость поттверждается Теория Смолуховского позволяет вычислить расстояние ρ между центрами двух частиц, при котором возможно их слипание: Подставим в (6)
из эксперимента известно, что ρ/r = 2,3 т.е. ρ ≈ 2r т.е силы притяжения действуют только на очень малых расстояниях Теория Смолуховского учитывает столкновение не только первичных частиц, но и уже слипшихся (двойников, тройников и т.д.): суммарная концентрация всех частиц:
зависимость числа частиц от времени выражается кривой:
Теория медленной коагуляции Фукса. В области медленной коагуляции не все столкновения приводят к коагуляции. Смолуховский попытался учесть этот факт, введя в уравнения для теории быстрой коагуляции параметр α – долю эффективных столкновений. Но полученные уравнения далеко не всегда описывали эксперимент. Советский физхимик Фукс разработал более совершенную теорию медленной коагуляции. Она учитывает замедление коагуляции с ростом высоты энергетического барьера при взаимодействии частиц. Коэффициент замедления коагуляции, или фактор устойчивости
а – радиус частицы, W – коэффициент замедления коагуляции Из (8) видно, что W резко возрастает с ростом высоты энергетического барьера U, коагуляция замедляется. Фактор устойчивости зависит от концентрации электролита: СК - концентрация электролита, соответсвующая переходу в зону быстрой коагуляции. При С < СК W < 1, что соответствует U < 0, (потенциальная яма). (на кривой U-x). Т.е. скорость коагуляции в условиях преобладания сил притяжения > чем при быстрой коагуляции без учета взаимодействий. Теория Фукса наиболее точно описывает кинетику коагуляции с учетом энергетических параметров. Теория хорошо согласованна с экспериментом (зависимость V коагуляции от Z ионов, зависимость W от С элемента и т.д.). В коллоидном состоянии перемещаются и перераспределяются различные химические элементы, кремнезем, гумусовые вещества, оксиды железа, сульфиды, карбонаты и т.д. Большую роль процессы коагуляции играют в образовании почв. Глинистые минералы, образующие коллоидные частицы почв, обладают высокой обменной емкостью. Поглотительная способность, особенно по отношению к катионам, во многом определяет их плодородие. Большая адсорбционная способность коллоидных частиц минералов играет важную роль в миграции многих элементов.
|
||||||
|
Последнее изменение этой страницы: 2017-02-10; просмотров: 261; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.143.239 (0.014 с.) |

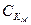 - порог медленной коагуляции; 3 – скорость коагуляции велика и не зависит от концентрации электролита; - зона быстрой коагуляции
- порог медленной коагуляции; 3 – скорость коагуляции велика и не зависит от концентрации электролита; - зона быстрой коагуляции  - порог быстрой коагуляции.
- порог быстрой коагуляции. (1)
(1) (2)
(2) . из уравнения (1) получим:
. из уравнения (1) получим: интрегрируя от ν0 до ν и от 0 до τ,
интрегрируя от ν0 до ν и от 0 до τ, (3)
(3) (4)
(4) в уравнение (4):
в уравнение (4):
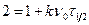
 (5)
(5) (6)
(6) :
: (7)
(7) - уравнение Эйнщтейна:
- уравнение Эйнщтейна:

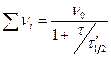

 показывает во сколько раз скорость коагуляции уменьшается при медленной коагуляции.
показывает во сколько раз скорость коагуляции уменьшается при медленной коагуляции. (8)
(8)


