
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Классификация и методы получения ионитов.
Иониты
По происхождению По составу По знаку заряда обменивающихся ионов Природные Синтетические Неорганические Органические Кат-ты Аниониты Амфолиты
Природные неорганические – кристаллические силикаты типа неолитов. Если в порах сетчатой структуры располагаются ионы щелочных металлов, способных обмениваться с катионами раствора, то это катионы (шабазит, глауконит). Некоторые минералы (апатит) – аниониты. Природные органические иониты это, например, гумусовые вещества (карбоксильная группа участвует в ионном обмене). Типичным амфотерным природным ионитом является почва (может быть обмен катионами или анионами). Синтетические иониты. К ним относятся гелеобразные пермутиты (алюмосиликаты), применявшиеся для умягчения воды; гели гидроксидов AI и Fe (аниониты). Это неорганические синтетические иониты. Они разрушаются кислотами и щелочами. Синтетические иониты органической природы получают из каменного угля, дерева, торфа, обрабатывая их кислотами. Широкое распространение получили синтетические иониты на основе органических смол. Они обладают большой емкостью обмена и химической стойкостью. Ионообменные смолы получают двумя методами; поликонденсацией и полимеризацией. Синтез включает три стадии: 1) получение линейных полимеров; 2) образование сетчатой структуры с помощью мостикообразователей; 3) введение активных ионогенных групп. Готовые ионообменные смолы обычно состоят из отдельных гранул.
Физико – химические характеристики ионитов. (емкость, кислотно - основные свойства, селективность, набухаемость, химическая стойкость, механическая прочность).
1.Емкость. а) Статическая обменная емкость – полная емкость, характеризующая общее число ионогенных групп в мэкв/г адсорбента. У природных – 0,2 – 0,3 мэкв/г (небольшая статическая емкость). У синтетических – 3 – 5 мэкв/г, иногда до 10. б) Динамическая обменная емкость – рабочая емкость, которая относится только к используемой в данных условиях части гомогеных групп. Например, в ионообменной колонке при относительном движении ионита и раствора. Она зависит от скорости движения, размеров колонки и других факторов. Статическую емкость, определяют, насыщая ионит каким – либо одним ионом
(например, катионит - Н+ ионом), а затем вымывая его, например, раствором NaCI. Количество перешедшей в раствор кислоты определяют титрованием щелочью. Емкость равна количеству кислоты отнесенная к массе ионита. 2. Кислотно – основные свойства. По кислотно – основным свойствам иониты делятся на; 1. Сильнокислотные катиониты (- SO3H) 2. Слабокислотные катиониты (- OH; - COOH; - SiOH) 3. Слабоосновные аниониты (- NH2; = NH; N) 4. Сильноосновные аниониты [- N+(CH3)3CI-] 5. Полифункциональные иониты 3) Набухаемость при контакте сухого ионита с раствором. Причиной набухаемости является наличие гидрофильных функциональных групп. Набуханние увеличивает скорость ионного обмена. Степень набухания характеризуется отношением
Кинетика ионного обмена включает пять стадий: 1 Диффузия адсорбирующихся ионов из раствора к поверхности ионита. 2 Диффузия внутри зерен. 3 Обмен ионов. 4 Диффузия замещающихся ионов к поверхности ионита. 5 Диффузия замещающихся ионов от поверхности ионита в растворе. Обычно лимитирующей стадией является диффузия внутри зерен. 4) Химическая стойкость. Имеет важное практическое значение и оценивается по потере обменной емкости при обработке кислотами или щелочами. Изотерма ионного оьмена. Изотерма имеет вид:
Уравнение аналогично изотерме адсорбции из бинарных растворов. Концентрация ионов выражается в эквивалентных долях:
у1 + у2 = 1 Применение ионного обмена. Ионообменная адсорбция широко применяется для известкования почв; извлечения и разделения ионов; для умягчения и очистки воды; извлечения драгоценных металлов; разделения редкоземельных элементов (с высокой степенью чистоты). Очень широко применяется в аналитической химии (хромотография). Примеры умягчения воды: 2 П- Na+ + Ca2+ ® П2- Ca2+ + 2 Na+ Определение воды: 1) На катионы: П- Н+ + Na+ + CI - ® П- Na+ + Н+ + CI- 2)
П- Н+ + П+ ОН- + Na+ + CI- ® П- Na+ + П+ CI- + Н2О Ионы легко регенерируются обработкой кислотой и щелочью. Известкование почвы и обработка аммиачной водой (удобрение): 2 П- Н+ + Ca(ОН)2 ® П2- Са2+ + 2 Н2О П- Н+ + NH4OH ® П- NH4+ + Н2О
Кинетика адсорбции. Адсорбционное равновесие в системе устанавливается в течении определенного времени, колеблющегося от долей секунд (при адсорбции газов) до нескольких часов (при адсорбции из растворов). Кинетика адсорбции часто лимитируется диффузионной стадией. Кинетику изучают либо по привесу адсорбента, либо измеряя концентрацию адсорбтива во времени. При повышении температуры устанавливается уменьшение адсорбционного равновесия, но скорость установившегося равновесия возрастает. Обозначим: V1- cкорость адсорбции; V2 – скорость десорбции; n1- число столкновений молекул адсорбата с единицей поверхности адсорбента. n2-число молекул, десорбирующихся с единицы площади занятой поверхности. a- доля молекул, способных закрепиться на поверхности. q - степень заполнения поверхности. (1- q) - доля свободной поверхности. Тогда скорость адсорбции выразится уравнением:
или
Обозначим правую часть уравнения за х:
Продифференцируем по Q:
Правая часть уравнения представляет собой константу, обозначим ее К – константа скорости адсорбции. К = Проинтегрируем это уравнение:
При х=0 Интегрируем: Х = К(QP – Q) (7) Полученное значение х подставим в уравнение (2)
Из уравнения (8) видно, что скорость адсорбции максимальна в начальный момент времени, когда Q мало. С ростом Q скорость адсорбции снижается. Уравнение скорости адсорбции имеет вид:
, где Аравн – количество адсорбционного вещества при установившемся адсорбционном равновесии.
|
||||||
|
Последнее изменение этой страницы: 2017-02-10; просмотров: 358; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.138.114.94 (0.054 с.) |

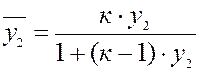

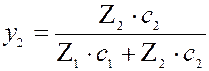
 На аниониты: П+ ОН- + Н+ + CI- ® П+ CI- + Н2О
На аниониты: П+ ОН- + Н+ + CI- ® П+ CI- + Н2О (1)
(1) (2)
(2) (3)
(3)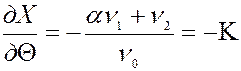 (4)
(4) (5)
(5) (6)
(6) (8)
(8)



