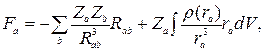Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
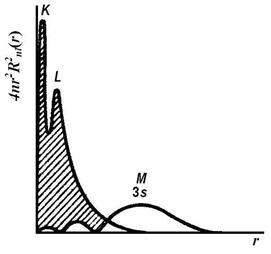
Радиальное распределение для орбиталей атома водорода.
Нормированные действительные угловые волновые функции
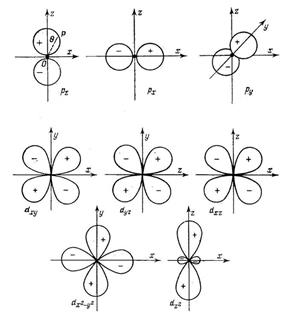
Орбитальные диаграммы для p и d орбиталей.
Различные способы изображения атомных орбиталей на примере 1s и 3dxz – о рбиталей А – граничная поверхность, б – диаграммы электронной плотности, в – зарядовое облако
Форма атомных орбиталей s-, p-, d- и f- типа. Строение многоэлектронных атомов Методы решения волнового уравнение для многоэлектронных атомов
Радиальное распределение вероятности нахождения Электронов в атоме натрия
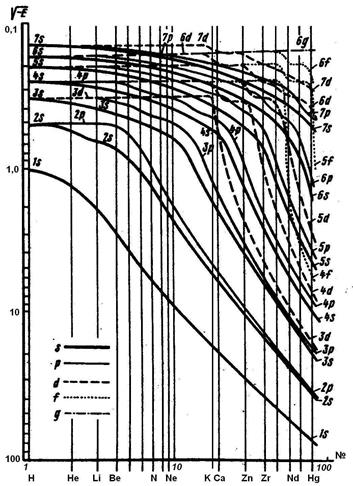
Зависимость энергии атомных орбиталей от порядкового Номера элемента.
Принцип Паули - в данном атоме или молекуле не может быть электронов, у которых бы все четыре квантовых числа совпадали; любая электронная, волновая функция должна, быть антисимметрична по отношению к перестановке любой пары электронов. Правило Хунда - в пределах одного подуровня электроны распределяются по орбиталям таким образом, чтобы модуль суммы их спиновых квантовых чисел был максимальным . Принцип минимума энергии - наиболее устойчивыми состояниями любой системы являются состояния с минимальным запасом энергии. Энергия подуровней растет в ряду: 1 s < 2 s < 2 р < 3 s < 3 р < 4 s < 3 d < 4 р < 5 s < 4 d < 6 p < 6 s < 4 f ≈ 5 d< 6 p<7 s <5f ≈ 6d < 7p... 1-е правило Клечковского − уровни и подуровни атомов заполняются электронами в порядке возрастания суммы главного и орбитального квантовых чисел (n + l). 2-е правило Клечковского − при одном и том же значении суммы (n + l) заполнение подуровней происходит в порядке возрастания главного квантового числа п.
Электронная конфигурация (формула) атома − это условная запись распределения электронов по орбиталям в основном состоянии этого атома. [Ne] ≡ 1 s 22 s 22 p 6; [Cl] ≡ 1 s 22 s 22 p 63 s 23 p 5 или [Ne] 3 s 23 p 5 1 s 2 2 s 22 px 2 py Хром [Ar]3 d 54 s 1, медь [Ar]3 d 104 s 1, палладий [Kr]4 d 105 s 1, ниобий [Kr]4 d 45 s 1, рутений [Kr]4 d 75 s 1, родий [Kr]4 d 85 s 1, платина [Xe]4 f 145 d 85 s 1
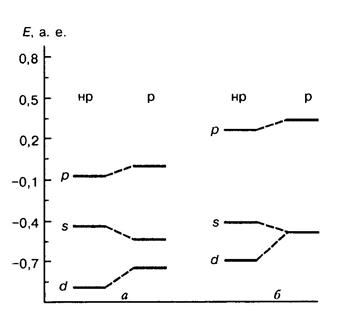
Энергетические уровни, в рассчитанные в релятивистском (р) и нерелятивистском (нр) приближениях:
А – атом ртути; б – кристаллическая фаза.
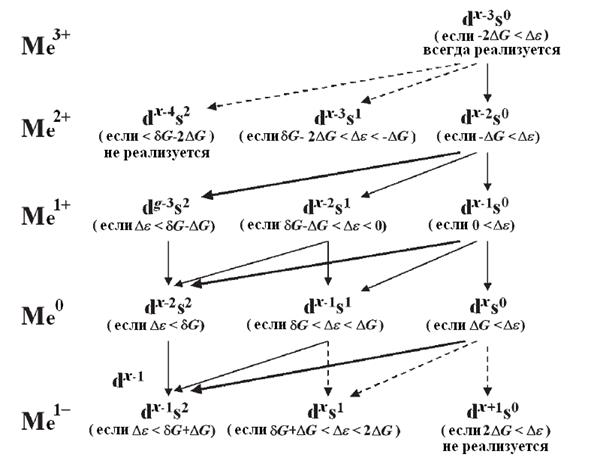
Возможные электронные конфигурации атомов и ионов переходных металлов и переходы между ними
V [Ar]3d34s2 → V+ [Ar]3d44s0 Ti [Ar]3d25s2 → Ti+ [Ar]3d25s1 Y [Ar]4d15s2 → Y+ [Ar]4d05s2 Δ ε = E s – E d – разница в энергии между внешним s -АО и предвнешней d – АО δ G = G ds – G ss Δ G = G dd – G ds, где G ij – энергия взаимодействия между электронами, находящимися на АО i и j Gss < G ds < G dd + ТЕОРИЯ И МЕТОДЫ ОПИСАНИЯ ХИМИЧЕСКОЙ СВЯЗИ И СТРОЕНИЯ МОЛЕКУЛ Метод валентных связей
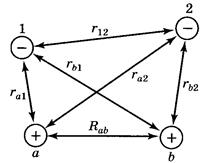
Fa − вектор силы, действующей на ядро с номером а; Zа − заряд ядра с номером а; ρ (ra) - электронная плотность в окрестности точки с радиус-вектором ra, проведенным от ядра а в данную точку; Rab − расстояние между ядрами a и b;ra − расстояние от ядра а до элемента объема, содержащего электронный заряд ρ (ra) dV
где х1, y1 и z1 − координаты первого электрона; х2, у2, z2 — координаты второго электрона
|
||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-10; просмотров: 426; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.58.112.1 (0.012 с.) |

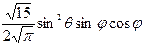



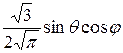
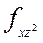

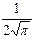
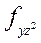


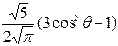
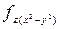
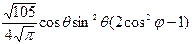
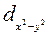
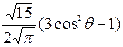
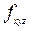
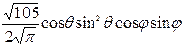
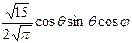
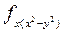
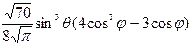
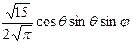
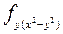
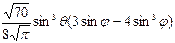

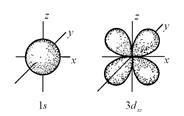 а
а
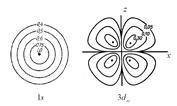 б
б
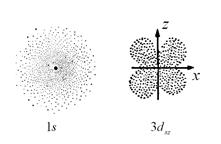 в
в