
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Каким образом получают атомные спектры испускания?
Какое значение имеет атомная спектроскопия для химии? Какие спектральные серии наблюдаются в атомном спектре водорода, в какой последовательности они были открыты? 4. Энергия какого перехода в атоме Н больше – с n = 14 на n = 15 или с n = 114 на n = 115? Почему? 5. СерияХемфриявляется одной из серий в спектре атомарного водорода. Она начинается при 12368 нм и может быть прослежена до 3281,4 нм. Какие переходы дают ее? Каковы длины волн промежуточных переходов? В чем сущность экспериментов Д. Франка и Г. Герца, что они доказывают? Каким образом теория строения атома Бора объясняла основные закономерности атомных спектров? Чем модель атома А. Зоммерфельда отличается от модели Бора? Каковы принципиальные затруднения теории строения атома Бора?
Корпускулярно-волновая природа вещества Л. де Бройль (1924 г.) - двойственной природой обладает любой движущийся материальный объект.
λ – длина волны; т – масса; v – скорость, E к – кинетическая энергия.
Схема опыта К. Дэвиссона и Л. Джермера
Зависимость силы тока i в цепи от
Где
Опыт Томсона и Тартаковского
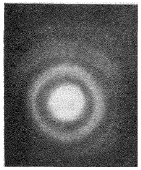
Дифракционная картина, возникающая при рассеянии электронов в пленке золота Принцип неопределенностей Хайзенберга
ОСНОВЫ КВАНТОВО – МЕХАНИЧЕСКОЙ ТЕОРИИ Волна – это изменение состояния среды (возмущение), распространяющееся в этой среде и переносящее с собой энергию.
Бегущие волны.
φ – амплитуда смещения расстоянии х от начала струны; λ – длина волны; ν — частота; а – постоянная (максимальное значение амплитуды); с – скорость распространения волны a 1 φ 1 + a 2 φ 2
где λ = c/v
Некоторые допустимые решения волнового уравнения для одномерных колебаний натянутой струны.
f(x) заменено на Ψ
Ψ – функция декартовых координат х, у, z.
Н – оператор Гамильтона, или Гамильтониан, определяющий операцию или последовательность операций, производимых над функцией Ψ.
УравнениеШредингера
1. Уравнение Шредингера описывает состояние микросистем (атомов, молекул, ионов и др.) с учетом корпускулярно-волнового дуализма. 2. Уравнение – постулат, но отражает объективную реальность. Это закон природы. Решения, полученные на его основании (значения Е для заданных х, у, z), не противоречат экспериментальным фактам. 3. Уравнение связывает энергию системы (электрона) с ее волновым движением. Энергия электрона зависит только от некоторой волновой функции Ψ, которая характеризует его движение. Поскольку волновая функция полностью определяет состояние системы, любому набору координат частиц системы при заданном значении t соответствует только одно значение Ψ. 4. Решение уравнения Шредингера позволяет найти вид Ψ – функций, характеризующих возможные состояния микрочастиц в данных условиях, и соответствующие им значения энергии. Полученные данные позволяют составить некий образ системы (атома).
Вероятность пребывания электрона в данной единице объема атома dV равна Ψ2dV иназывается электронной плотностью. Вероятность найти частицу в любом элементе объема не должна обращаться в бесконечность.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-10; просмотров: 137; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.216.94.152 (0.006 с.) |












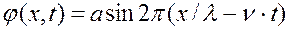
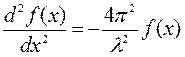 ,
,
 а
а
 б
б


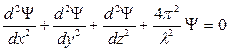

 заменяет выражение
заменяет выражение

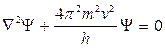


 HΨ = EΨ
HΨ = EΨ



