Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Важнейшей характеристикой спектральных свойств атома является полный набор термов как определяющий все возможные спектральные линии.
Постулаты Бора и их экспериментальное подтверждение. Н. Бор предложил (1913 г.) первую неклассическую модель атома, взяв за основу планетарную модель атома Резерфорда и применив к ней положения квантовой теории излучения. Электроны считались корпускулами, обладающими при этом удивительными свойствами, которые были определены в постулатах Бора. Постулаты Н. Бора (1926 г.): I. Атомная система устойчива только для определенной совокупности состояний - «стационарных состояний», которая в общем случае соответствует дискретной последовательности значений энергии атома. Каждое изменение этой энергии связано с полным «переходом» атома из одного стационарного состояния в другое. II. Способность атома поглощать и испускать излучение подчиняется закону, по которому излучение, связанное с переходом, должно быть монохроматическим и иметь частоту ν, определяемую соотношением
где h – постоянная Планка и Е 1и Е 2– энергия двух соответствующих стационарных состояний. Д. Франк и Г. Герц (1913 – 1914 гг.). При неупругих столкновениях электрона с атомом происходит передача энергии от электрона атому. Если внутренняя энергия атома изменяется непрерывно, то атому может быть передана любая порция энергии. Если же состояния атома дискретны, то при неупругом столкновении электрон может передать атому лишь определенные порции энергии.
Схема опыта Франка и Герца
Зависимость силы анодного тока в цепи от ускоряющей разности потенциалов eVа. Разница внутренних энергий основного состояния атома ртути и ближайшего возбужденного состояния eV равна 4,9 эВ, что доказывает дискретность внутренней энергии атома и, следовательно, справедливость первого постулата Бора. Строение атома водорода по H. Бору и объяснение важнейших закономерностей атомных спектров. ν = T n – T k hv = E к – E n E n= -hT n ,; E k = – hT k .
n – положительное целое число, названное главным квантовым числом; h – постоянная Планка; m и v – масса и скорость электрона; r – радиус орбиты.
где Z – порядковый номер элемента, r – радиус орбиты электрона.
Схема энергетических уровней атома водорода. Цифры у вертикальных линий, обозначающих переходы, – длины волн в нм. Развитие теории строения атома Бора.
Параметры r и φ для электрона, вращающегося по окружности и эллиптической орбите.
Возможные электронные орбиты при квантовом числе n = 3.
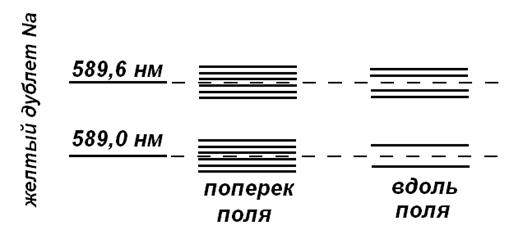
Эффект Зеемана для двух близких спектральных линий атома натрия (жёлтого дублета Na) в магнитном поле при наблюдении поперёк и вдоль поля.
Контрольные вопросы и задания.
|
|||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-10; просмотров: 125; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.133.147.87 (0.008 с.) |



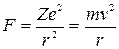

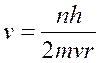
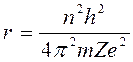


 ,
,