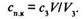Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Изменение агрегативной устойчивости при помощи электролитов
Одним из способов изменения агрегативной устойчивости дисперсных систем, особенно золей, является введение электролитов. Электролиты в состоянии изменить структуру ДЭС (см. рис. 7.2—7.4) и его диффузный слой, уменьшают или увеличивают ^-потенциал и электростатическое отталкивание n3(h), т.е. способны вызвать или предотвратить коагуляцию. Возможны нейтрализационная и концентрационная коагуляция электролитами (рис. 10.8). Причина их одна и та же -снижение величины дзета-потенциала и ослабление или исключение электростатического отталкивания между частицами. Однако, механизм снижения дзета-потенциала различный. Нейтрализационная (адсорбционная) коагуляция наблюдается для золей, которые имеют незначительный электрический заряд и небольшой ф-потенциал (< 10 мВ). Причем значения £-потен-циала немного отличаются от значений ф-потенциала. Нейтрализационную (адсорбционную) коагуляцию вызывают электролиты, имеющие ионы, которые способны к специфической адсорбции, т.е. адсобции в потенциалобразующем слое (прямая 3 рис. 10.8, а). В результате нейтрализуется часть зарядов потенциалобразующего слоя, снижаются и ф-потенциал и дзета потенциал, с ср^о ф2 (кривая 1) и с ^ до ^ (кривая 2), что в свою очередь приводит к ослаблению электростатического отталкивания и способствует слипанию частиц. Теория ДЛФО позволяет определить значение электрического потенциала (ф)кр, при котором исчезает потенциальный барьер, что соответствует кривой яДй) на рис. 10.5, б. Критическое значение электрического потенциала можно рассчитать по следующей формуле: ((p)Kp=V^/(eX), (10.39) где Я — постоянная величина; А — константа ГамакераДсм. формулу (10.25)]; е — диэлектрическая проницаемость дисперсионной среды; X — толщина диффузного слоя. Концентрационная коагуляция, характерна для золей, имеющих значительный электрический заряд, когда электрический потенциал достигает значений свыше 100 мВ. В этих условиях различие между (^-потенциалом и ср-потенциалом становится существенным (рис. 10.8, б). При концентрационной коагуляции потеря устойчивости вызывается сжатием диффузной части ДЭС при неизменном ф-потенциале поверхности. Она протекает под воздействием ин-
Рис. 10.8. Изменение электрического потенциала до (кривая 1) и
после (кривая 2) введений электролита в процессе нейтрализздионной (а) и концентрационной (б) коагуляции: Ф, и ф2, С, и Сз — значения электрического и электрокинетического потенциалов, соответственно, до и после введения электролитов; 3 и 4 — направление адсорбции ионов электролита; х — расстояние от твердой поверхности в глубь жидкости дифферентных электролитов (прямая 4 рис. 10.8, б), когда происходит сжатие диффузного слоя за счет подавления диффузии и перемещения ионов из диффузного в адсорбционный слой; в результате снижается электрокинетрческий потенциал (£-по-тенциал с £, до ^ при измененном ф-потенциале, кривые 1 и 2). Это позволяет частицам подойти друг к другу на близкое расстояние, а за счет межмолекулярного взаимодействия произойдут слипание частиц и коагуляция. Компоненты почв способны переходить в коллоидное состояние, но для сохранения питательных свойств почв необходимо иметь агрегаты, т.е. нарушить агрегативную устойчивость и обеспечить коагуляцию почвенных коллоидов. Применительно к почвам агрегативная устойчивость, т.е. дезагрегация почвенных коллоидов, является нежелательным процессом: снижается адсорбционная способность почв, из нее удаляются вещества, необходимые дли питания растений. Подобный процесс имеет место, например, при обработке почвы электролитами, содержащими ноны Na+. В результате ионообменной абсорбции (см. параграф 6.5) вымываются ионы Са2+ и Mg2+, нарушается структура двойного электрического слоя и происходит концентрационная коагуляция. Коагуляция зависит от природы и концентрации электролитов. С изменением концентрации электролитов изменяется скорость коагуляции Изменение скорости коагуляции показано на на рис. 10.9. На участке /коагуляция отсутствует, и ик = 0. Элек-
Рис. 10.9. Изменение скорости коагуляции В зависимости От концентрации электролита: 1 — обычная коагуляция; 2 — коагуляция в случае тростатическое отталкивание превалирует над межмолекулярным притяжением: яэ(А) > nu(h) (см. рис. 10.5, а), а изменение расклинивающего давления в зависимости от расстояния между двумя телами соответствует кривой п{И).
При определенной концентрации электролитов, называемой порогом коагуляции спк, начинается слипание частиц. Порог коагуляции — это наименьшая концентрация электролита, при которой начинается коагуляция. Порог коагуляции характеризует начало участка // на кривой 7. Если не все соприкасающиеся частицы слипаются, то процесс идет по механизму медленной коагуляции. Именно такой процесс характеризует участок //на кривой 7. Для этого участка численная кокцентрация определяется по формуле (10.17), а скорость коагуляции увеличивается от нуля до определенного значения. Участок ///на кривой 7 характерен тем, что скорость коагуляции постоянна. Процесс идет по механизму быстрой коагуляции, происходит слипание всех соприкасающихся частиц, и численная концентрация определяется формулой (10.16). Коагуляция при помощи электролитов подчиняется некотором эмпирическим правилам. К числу их относятся правила Шульце-Гарди, определяющие порог коагуляции при добавлений противоионов одинаковой и различной валентности. Первое правило Щулъце-Гарди формулируется следующим образом: чем выше валентность коагулирующего иона, тем меньше его нужно для коагуляции. Это правило следует также из теории ДЛФО. Согласно теории, для слипания частиц, ковда межмолекулярное взаимодействие превышает электростатическое отталкивание [кривая n'(h) на рис. 10.5, б], порог коагуляции обратно пропорционален шестой степени валентности z иона электролита
где к — коэффициент, характеризующий дисперсную фазу, дисперсионную среду и структуру ДЭС. Если обозначить через с£к, с^к и с"^к порог коагуляции, вызываемый одно-, двух- и трехвалентными ионами соответственно, то согласно условию (10.40) для одной и той же дисперсной системы соотношение между этими величинами будет таким:
(10.41) Так, например, для коагуляции золя сульфида мышьяка (строение ДЭС частиц дисперсной фазы которого соответствует изображенному на рис. 7.2) порог коагуляции для различных электролитов равен (моль на 1 л золя): LiCI — 58,0. MgCI2 — 0,71 и AICI3 — 0,043, что соответствует соотношению (10.41). Порог коагуляции можно определить другим способом. Для этого необходимо концентрацию раствора электролита сэ (моль/м3) умножить на такой его объем К(м3), который вызывает коагуляцию в расчете на единицу объема золя F3 (м3):
(Ю.42) Формула (10.42) справедлива, когда F3 > Vy а порог коагуляции определяется в моль/м3. Для ионов одинаковой валентности порог коагуляции тем ниже, чем выше порядковый номер этого иона (второе правилр Шулъце-Гарди). Коагулирующая способность электролита определяется положением иона в лиотропном ряду [условия (6.17)— (6.19)]. Рассмотренные правила коагуляции являются полуэмпирическими и соблюдаются при определенных условиях, Прежде всего, дисперсные системы не должны содержать примеси других электролитов. Возможны случаи коагуляции электролитами, которые не подчиняются этим правилам. Некоторые многовалентные ионы, например Fe3+, Al3+ и Т13+, вызывают коагуляцию только в определенном диапазоне концентраций; изменение скорости коагуляции при помощи таких электролитов характеризуется кривой 2 на рис. 10.9. Вопреки закономерности, характерной для участка ///, скорость коагуляции падает. Это объясняется способно1 стью многовалентных ионов перезаряжать поверхность частицы и изменять значение и знак ^-потенциала (см. рис. 7.2—7.4). После перезарядки поверхности частицы коагуляция прекращается. Многовалентные ионы, обладающие способностью перезаряжать поверхность частицы, образуют неправильные ряды иойов.
Коагуляция смесью двух или более электролитов имеет ряд особенностей. При аддитивном действии двух электролитов (если они действуют независимо друг от друга) порог коагуляции определяется суммой порога коагуляции одного с'пк и ВТ°РОГО Ск электролитов; фактическая концентрация электролитов сф, определяющая порог коагуляции, выразится формулой сф = спк = с/пк + с^к. Аддитивное действие электролитов встречается довольно редко; чаще оно нарушается. В одних случаях суммарная концентрация электролитов сф, вызывающая коагуляцию, ниже, чем это вытекает из правила аддитивности, т.е. сф < спк, и совместное присутствие электролитов повышает их коагулирующую способность. В других случаях наоборот: электролиты противодействуют друг другу, и суммарная концентрация электролитов становится выше, чем это следует из правила аддитивности, т.е. сф > спк. Одним из видов коагуляции является флокуляция. Она происходит под действием веществ, называемых флокулянтами. В качестве флокулянтов часто применяют синтетические полимерные материалы, в частности полиакриламид. Макромолекулы полимеров образуют своеобразные мостики между частицами дисперсной фазы. В результате возникают рыхлые хлопьевидные агрегаты (флокулы), которые впоследствии могут оседать. Флокуляция позволяет очистить воду для различных бытовых и промышленных целей от загрязнений в виде высокодисперсных частиц. Флокулянты широко используются в промышленности ,Щ1Я ВОДОПОДГОТОВКИ. Агрегативная устойчивость и коагуляция в каждом конкретном случае могут зависеть от различных причин: независимого или совместного проявления седиментации и агрегации, действия электролитов и наличия примесей в сочетании с внешними факторами. Все это свидетельствует о сложности проблемы устойчивости и о необходимости в конкретных случаях определять основные факторы, обеспечивающие существование дисперсных систем.
|
||||||||||
|
Последнее изменение этой страницы: 2017-02-10; просмотров: 202; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.188.61.223 (0.062 с.) |