
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Формулы для расчёта газовых смесей
Газовую постоянную смеси газов (Rсм) можно выразить либо через газовые постоянные отдельных компонентов, входящих в смесь, либо через кажущуюся молекулярную массу смеси:
или:
Связь между давлением газовой смеси и парциальными давлениями отдельных компонентов, входящих в смесь, устанавливается следующей зависимостью (закон Дальтона), легко получаемой из основного уравнения кинетической теории газов:
где P – общее давление газовой смеси; p1, p2, …, pn – парциальные давления отдельных компонентов, входящих в смесь. Парциальные давления определяются проще всего, если известны объемные доли отдельных компонентов, входящих в смесь:
или вообще:
где pi – парциальное давление любого газа, входящего в смесь. В табл. 1.2 дана сводка формул, применяемых при расчетах газовых смесей.
Теплоёмкость газов Теплоемкостью (точнее удельной теплоемкостью) называют количество теплоты, которое необходимо сообщить телу (газу), чтобы изменить температуру какой-либо количественной единицы на 1° С (1К). Количество теплоты в системе СИ измеряют в Дж или кДж. В зависимости от количественной единицы вещества различают массовую теплоемкость С – кДж/(кг·К), объемную теплоемкость С’–кДж/(м3·К) и киломольную теплоемкость μС – кДж/(кмоль·К). Поскольку в 1 м3 в зависимости от параметров состояния содержится различная масса газа, то объемную теплоемкость всегда относят к 1 м3 газа при нормальных условиях (РН = 760 мм рт. ст., tН = 0° С). Массовая, киломольная и объемная теплоемкости связаны между собой следующими зависимостями:
где μ – молекулярная масса или количество кг в киломоле данного вещества, кг/кмоль;
где 22,4 – объем киломоля любого идеального газа в нормальных физических условиях (следствие из закона Авогадро), м3н /кмоль;
C’= С·ρн, (1.29)
где ρН – плотность данного вещества при нормальных условиях, кг/м3н.
Теплоемкость идеальных газов зависит от атомности, характера процесса и температуры. Теплоемкость реальных газов, кроме перечисленных выше факторов, зависит еще и от давления. Зависимость теплоемкости от температуры обычно выражают формулой:
C = a + bt + et2, (1.30)
где t–температура в °С; a, b, е – численные коэффициенты, определяемые экспериментально. Аналогичные зависимости получены не только для массовых, но и для других видов теплоемкости (объемных, киломольных). Различают среднюю и истиннуютеплоемкости. Средняятеплоемкость в интервале температур t1 – t2 равна:
где q1-2 – количество теплоты, подведенное в данном процессе, кДж/кг; t1, t2 – температура в начале и в конце процесса, °С. Если выражение (1.31) записать для бесконечно малого количества теплоты dq и интервала температур dt, то получим формулу так называемой истинной теплоемкости С при данной температуре:
Из выражения (1.32) dq = Cdt, а для всего процесса 1–2 количество теплоты q1-2 будет равно:
Это же количество теплоты можно выразить через среднюю теплоемкость, что следует из (1.31):
Имеется еще одна формула для подсчета q1-2:
Применение этого выражения удобно при наличии таблиц средних теплоемкостей В некоторых случаях требуется, пользуясь таблицами средних теплоемкостей
В теплотехнике особое значение имеют два случая нагревания (охлаждения): при постоянном давлении (изобарный процесс) и при постоянном объеме (изохорный процесс). Обоим этим случаям соответствуют изобарные и изохорные теплоемкости, имеющие в обозначениях индексы «p» «v». Изобарные теплоемкости: Изохорные теплоемкости: Между теплоемкостями при постоянном давлении и постоянном объеме существует следующая зависимость: -для массовых теплоёмкостей:
-для мольных теплоемкостей:
Для приближенных расчетов и при невысоких температурах можно принимать следующие значения мольных теплоемкостей (табл. 1.3).
В технической термодинамике большое значение имеет отношение теплоемкостей при постоянном давлении и постоянном объеме, обозначаемое буквой k и называемое показателем адиабаты:
Принимая теплоемкость постоянной, на основании данных табл. 1.3 можно получить для одноатомных газов k=1,67; для двухатомных газов k=1,4; для трехатомных газов k=1,29.
Таблица.1.3. Приближенные значения киломольных теплоемкостей газов при постоянном объеме и постоянном давлении (C = const)
Если в процессе участвуют М кг или Vн м3 газа, то подсчет количества тепла производится по формулам:
и:
Теплоемкость газовой смеси определяется на основании следующих формул: массовая теплоемкость смеси:
oбъемная теплоемкость смеси:
мольная теплоемкость смеси:
где i – номер компонента смеси; n – число компонентов смеси. В этих выражениях mi, ri – соответственно массовая и объемная доля i-го компонента газовой смеси;
|
|||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-10; просмотров: 879; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.22.181.209 (0.016 с.) |

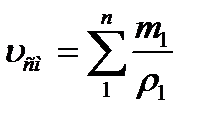






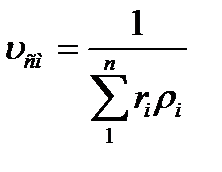



 (1.23)
(1.23) (1.24)
(1.24) , (1.25)
, (1.25) ,
, . (1.26)
. (1.26)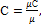 (1.27)
(1.27) (1.28)
(1.28) , (1.31)
, (1.31) . (1.32)
. (1.32) . (1.33)
. (1.33) . (1.34)
. (1.34)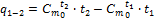 . (1.35)
. (1.35) .
. . Для этого из (1.34) и (1.35) можно получить формулу:
. Для этого из (1.34) и (1.35) можно получить формулу: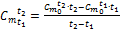 . (1.36)
. (1.36)
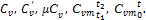
 , (1.37)
, (1.37) . (1.38)
. (1.38) . (1.39)
. (1.39) , (1.40)
, (1.40) . (1.41)
. (1.41) (1.42)
(1.42) (1.43)
(1.43) (1.44)
(1.44) ,
, 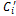 ,
,  – соответственно массовая, объемная и мольная теплоемкость i-го компонента;
– соответственно массовая, объемная и мольная теплоемкость i-го компонента;  ,
,  ,
, 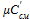 – соответственно массовая, объемная и мольная теплоемкость газовой смеси.
– соответственно массовая, объемная и мольная теплоемкость газовой смеси.


