Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Взаимодействие клеток при иммунном ответеСтр 1 из 4Следующая ⇒
ИММУНОПАТОЛОГИЯ В организме человека постоянно происходят мутации. Их суммарное количество в расчёте на один клеточный цикл составляет примерно 1*106. Часть мутаций сопровождается синтезом новых белков, обладающих антигенными свойствами. Происходящие в связи с этим структурные и функциональные изменения могут привести к существенные расстройствам жизнедеятельности клеток, тканей, органов и организма в целом. Кроме того, организм постоянно подвергается атаке вирусов, бактерий, риккетсий, грибов, паразитов, способных вызвать различные болезни. В связи с этим в ходе эволюции сформировалась высокоэффективная система клеточных и неклеточных факторов распознавания собственных и чужих структур - система иммунобиологического надзора (ИБН). СИСТЕМА ИММУНОБИОЛОГИЧЕСКОГО НАДЗОРА Биологическое значение системы иммунобиологического надзора ИБН заключается в контроле (надзоре) за индивидуальным и однородным клеточно молекулярным составом организма.
Рис. 16–1. Структура системы иммунобиологического надзора организма.
К числу основных в системе представлений о механизмах надзора за индивидуальным и однородным антигенном составе организма относят понятия об Аг, иммунитете, иммунной системе и системе факторов неспецифической защиты организма. АНТИГЕНЫ Инициальным звеном процесса формирования иммунного ответа является распознавание чужеродного агента — антигена (Аг). Происхождение этого термина связано с периодом поиска агентов, веществ или «тел», обезвреживающих факторы, вызывающие болезнь, а конкретно речь шла о токсине дифтерийной палочки. Эти вещества назвали вначале «анти токсинами», а вскоре был введён более общий термин «анти тело». Фактор же, приводящий к образованию «анти тела» обозначили как «анти ген».
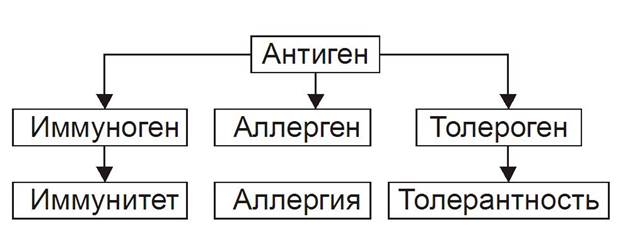
Антиген — вещество экзо- или эндогенного происхождения, вызывающее развитие иммунных реакций (гуморального и клеточного иммунных ответов, реакций гиперчувствительности замедленного типа и формирование иммунологической памяти). Учитывая способность Аг вызывать толерантность, иммунный или аллергический ответ их называют ещё, соответственно, толерогенами, иммуногенами или аллергенами соответственно.
Рис. 16–2. Потенциальные эффекты антигена в организме.
АНТИГЕННАЯ ДЕТЕРМИНАНТА Образование АТ и сенсибилизацию лимфоцитов вызывает не вся молекула Аг, а только особая его часть — антигенная детерминанта, или эпитоп. У большинства белковых Аг такую детерминанту образует последовательность из 4–8 аминокислотных остатков, а у полисахаридных Аг — 3–6 гексозных остатков. Число же детерминант у одного Аг может быть различным. Так, у яичного альбумина их не менее 5, у дифтерийного токсина — минимум 80, у тиреоглобулина — более 40.
ВИДЫ АНТИГЕНОВ В соответствии со структурой и происхождением Аг подразделяют на несколько видов.
Белки или сложные вещества (гликопротеины, нуклеопротеины, ЛП). Их молекулы могут иметь несколько различных антигенных детерминант;
Экзогенные Аг подразделяют на инфекционные и неинфекционные.
ИММУНОПАТОЛОГИЯ ИММУНИТЕТ В иммунологии термин «иммунитет» применяют в трёх значениях.
Иммунная система — комплекс органов и тканей, содержащих иммунокомпетентные клетки и обеспечивающая антигенную индивидуальность и однородность организма путём обнаружения и, как правило, деструкции и элиминации из него чужеродного Аг. Иммунная система состоит из центральных и периферических органов.
Заселение периферических органов иммунной системы T и B-лимфоцитами, поступающими из центральных органов иммунной системы, происходит не хаотически. Каждая популяция лимфоцитов мигрирует из кровеносных сосудов в определённые лимфоидные органы и даже в различные их регионы. Так, B-лимфоциты преобладают в селезёнке (в её красной пульпе, а также по периферии белой) и пейеровой бляшке кишечника (в центрах фолликулов), а T-лимфоциты — в лимфатических узлах (в глубоких слоях их коркового вещества и в перифолликулярном пространстве).
ИММУНОКОМПЕТЕНТНЫЕ КЛЕТКИ
Рис. 16–3. Организация и функции системы иммунокомпетентных клеток. Т-лимфоциты развиваются в тимусе из клеток-предшественниц. В-лимфоциты дифференцируются в печени плода и костном мозге взрослого организма. NK-клетки образуются из предшественников лимфоидных клеток в костном мозге. Лимфоциты, как и другие лейкоциты, на своей поверхности экспрессируют большое количество различных молекул, по которым при помощи моноклональных АТ идентифицируют их принадлежность к конкретной клеточной популяции. Чаще всего с этой целью выявляют дифференцировочные антигены (CD), являющиеся специфичными клеточными маркёрами. Идентификация клеточных маркёров при помощи АТ используется в проточной цитометрии для сортировки и подсчёта количества клеток в исследуемых популяциях. Эта субсистема образована различными клонами B-лимфоцитов. Название субсистемы отражает то обстоятельство, что лимфоциты, представляющие её, формируются у птиц в сумке (bursa) Фабрициуса (впервые B-лимфоциты были выявлены в лимфоидных органах птиц). У человека подобной бурсы нет, B-лимфоциты созревают в костном мозге, а также, возможно, в пейеровых бляшках, миндалинах, определённых зонах селезёнки и лимфоузлов. B-лимфоциты берут начало от стволовых кроветворных клеток костного мозга. B-лимфоциты обеспечивают реализацию эффекторного звена гуморального иммунного ответа.
В мембране B-лимфоцита присутствует рецептор Аг — мономер IgM. Из красного костного мозга B-лимфоциты мигрируют в тимус-независимые зоны лимфоидных органов. Продолжительность жизни большинства B-лимфоцитов не превышает десяти дней, если они не активируются Аг. Зрелые В-лимфоциты (плазматические клетки) вырабатывают АТ — Ig всех известных классов. CD19, CD20 и CD22 — основные маркёры, используемые для идентификации B-клеток.
АНТИГЕНЗАВИСИМАЯ СТАДИЯ
Увеличение числа клеток, дифференцирующихся в продуцирующие АТ (Ig) B-клетки (плазматические клетки). По мере созревания B-клеток и их превращения в плазматические клетки происходит интенсивное развитие белоксинтезирующего аппарата, комплекса Гольджи и исчезновение поверхностных первичных Ig. Вместо них продуцируются уже секретируемые (т.е. выделяемые в биологические жидкости — плазму крови, лимфу, СМЖ и др.) антигенспецифические АТ. Каждая плазматическая клетка способна секретировать большое количество Ig — несколько тысяч молекул в секунду. Процессы деления и специализации B-клетки осуществляются не только под влиянием Аг, но и при обязательном участии T-лимфоцитов хелперов, а также выделяемых ими и фагоцитами цитокинов — факторов роста и дифференцировки;
T-ЛИМФОЦИТЫ Субсистема T-лимфоцитов представлена различными клонами T-лимфоцитов. Их пролиферация и дифференцировка происходит под контролем вилочковой железы. В связи с этим их обозначают как T-клетки, или тимус зависимые лимфоциты. T-клетки, как и B-лимфоциты, развиваются из стволовых кроветворных клеток костного мозга. Отсюда в виде клеток–предшественниц T-лимфоциты попадают с кровью в тимус, где происходит их антигеннезависимое созревание, сопровождающееся экспрессией на цитолемме специфических (у каждого лимфоцита своего) рецепторов. NK-КЛЕТКИ NK-клетки (МНС нерестригированн ИФН, ИЛ1, GM CSF. При активации (например, под влиянием ИЛ2) NK-клетки приобретают способность к пролиферации. Функция NK-клеток нарушена при синдроме Шедьяка–Хигаси. Дефект NK-клеток — причина хронических инфекций.gые киллеры, естественные киллеры) составляют до 15% всех лимфоцитов крови. Они не имеют поверхностных детерминант, характерных для T- и B-лимфоцитов, не имеют рецептора Т-лимфоцитов. В типичных NK-клетках экспрессируются дифференцировочные Аг CD2, СD7, CD56 и CD16 (рецептор Fc фрагмента IgG). В плазматической мембране активированных NK-клеток появляется гликопротеин CD69. NK-клетки распознают и уничтожают опухолевые и вирус-инфицированные клетки. Механизм распознавания неясен. Существует представление о наличии поверхностноклеточных молекул, защищающих клетки организма от цитотоксического действия NK-êлеток. Примером служит продукт гена HLA C. Распознавание рецептором NK-êлетки этой молекулы тормозит цитотоксическую активность NK-êлеток и таким образом защищает клетку, экспрессирующую HLA C. Модификация продукта гена HLA C вирусами или связанными с опухолью молекулами приводит к уничтожению этой клетки NK-êлеткой. NK-êлетки, располагая рецептором IgG (CD16), способны также взаимодействовать с клетками, окружёнными молекулами IgG, и уничтожать их (феномен АТ зависимой цитотоксичности). Активированные NK-клетки выделяют АНТИГЕНПРЕДСТАВЛЯЮЩИЕ КЛЕТКИ Антигенпредставляющие клетки (А-субсистема на рис. 16-3) присутствуют преимущественно в коже, лимфатических узлах, селезёнке и тимусе. T ХЕЛПЕРЫ T хелпер распознаёт комплекс «Аг–молекула MHC класса II» на поверхности антигенпредставляющей клетки (рис. 16 5). Для активации Т хелпера специфическое узнавание Т хелпером фрагмента Аг на поверхности антигенпредставляющей клетки оказывается недостаточным. Активацию Т хелперов обеспечивает взаимодействие молекулы В7 (расположена на поверхности антигенпредставляющей клетки) с молекулой CD28 на поверхности Т хелпера. Узнавание Т хелпером нужных молекул на поверхности антигенпредставляющей клетки стимулирует секрецию ИЛ1 (рис. 16 5). Активированный ИЛ1 T хелпер синтезирует ИЛ2 и рецепторы ИЛ2, через которые агонист стимулирует пролиферацию Т хелперов и цитотоксических T лимфоцитов. В случае Т хелпера речь идёт об аутокринной стимуляции, когда клетка реагирует на тот агент, который сама же синтезирует и секретирует. Таким образом, после взаимодействия с антигенпредставляющей клеткой T хелпер приобретает способность отвечать на действие ИЛ2 всплеском пролиферации. Биологический смысл этого процесса состоит в накоплении такого количества Т хелперов, которое обеспечит образование в лимфоидных органах необходимого количества плазматических клеток, способных вырабатывать АТ против данного Аг.
Рис. 16 5. Взаимодействие клеток при иммунном ответе.
B ЛИМФОЦИТЫ ИФН. Под их действием B клетка активируется и пролиферирует, образуя клон. Активированный B лимфоцит дифференцируется в плазматическую клетку: увеличивается количество рибосом, гранулярная эндоплазматическая сеть и комплекс Гольджи становятся более выраженными.gАктивация B лимфоцита (рис. 16 5) предполагает прямое взаимодействие Аг с Ig на поверхности B клетки. В этом случае сам B лимфоцит процессирует Аг и представляет его фрагмент в комплексе с молекулой MHC II на своей поверхности. Этот комплекс распознаёт T хелпер, отобранный при помощи того же Аг. В активации В клетки участвуют две пары молекул: с одной стороны, специфическое взаимодействие Аг с рецептором (IgM) на поверхности В лимфоцита, а с другой стороны, молекула CD40 на поверхности В клетки взаимодействует с молекулой CD40L на поверхности Т хелпера, активирующего В клетку. Узнавание рецептором T хелпера комплекса «Аг–молекула MHC класса II» на поверхности B лимфоцита приводит к секреции из Т хелпера ИЛ2, ИЛ4, ИЛ5 и ПЛАЗМАТИЧЕСКИЕ КЛЕТКИ Плазматическая клетка синтезирует Ig. ИЛ6, выделяемый активированными Т хелперами, стимулирует секрецию Ig. Часть зрелых В лимфоцитов после Аг-зависимой дифференцировки циркулирует в организме как клетки памяти. КЛЕТОЧНЫЙ ИММУННЫЙ ОТВЕТ В клеточном иммунном ответе эффекторными клетками являются цитотоксические Т-лимфоциты, активность которых регулируют Т-хелперы и Т-супрессоры. РЕАКЦИИ КЛЕТОЧНО-ОПОСРЕДОВАННОГО ЦИТОЛИЗА Эффекторные клетки при помощи своих рецепторов распознают клетку–мишень и уничтожают её. За клеточно-опосредованный цитолиз отвечают не только Т-лимфоциты, но и другие субпопуляции лимфоидных клеток, а в некоторых случаях миелоидные клетки. В процессе узнавания участвуют различные молекулы, выставленные на поверхности взаимодействующих клеточных партнеров:
ЦИТОТОКСИЧЕСКИЕ T ЛИМФОЦИТЫ Предъявленный на поверхности клетки–мишени Аг в комплексе с молекулой MHC класса I связывается с рецептором цитотоксического T лимфоцита (TC, рис. 16 5). В этом процессе участвует молекула CD8 клеточной мембраны TC. Секретируемый T хелперами ИЛ2 стимулирует пролиферацию цитотоксических T лимфоцитов. УНИЧТОЖЕНИЕ КЛЕТКИ–МИШЕНИ Цитотоксический T лимфоцит раcпознаёт клетку–мишень и прикрепляетcя к ней. В цитоплазме активированного цитотоксического T лимфоцита присутствуют мелкие тёмные органеллы, напоминающие запаcающие гранулы cекреторных клеток. Гранулы концентрируютcя в той чаcти T киллера, которая расположена ближе к меcту контакта c клеткой–мишенью. Параллельно проиcходят переориентация цитоcкелета и cмещение в эту облаcть комплекса Гольджи, в котором и формируютcя гранулы. В них содержится цитолитический белок перфорин. Выделяемые T киллером молекулы перфорина полимеризуютcя в мембране клетки–мишени в приcутcтвии Ca2+. Сформированные в плазматической мембране клетки–мишени перфориновые поры пропуcкают воду и cоли, но не молекулы белка. Еcли полимеризация перфорина произойдет во внеклеточном проcтранcтве или в крови, где в избытке имеетcя кальций, то полимер не cможет проникнуть в мембрану и уничтожить клетку. Cпецифическое дейcтвие T киллера проявляется только как результат тесного контакта между ним и клеткой–мишенью, который доcтигаетcя за cчёт взаимодейcтвия Аг на поверхноcти жертвы c рецепторами T киллера. Cам T киллер защищён от цитотокcичеcкого дейcтвия перфорина. МЕХАНИЧЕСКИЕ БАРЬЕРЫ
Кожные покровы снабжены «неприступным» многослойным эпителием. Эта «линия обороны» подкреплена секретами кожных желёз и постоянным слущиванием отмерших слоёв эпидермиса. Нарушение целостности эпидермиса (например, при травмах или ожогах) — серьёзная предпосылка для микробных инвазий, особенно при контактах с инфицированными субстратами (почва, растительные остатки и т.д.). Следует помнить, что помимо барьерной роли кожа снабжена мощной системой иммунной защиты (лимфоциты, клетки системы мононуклеарных фагоцитов). Слизистые оболочки могут иметь специальные анатомические структуры (например, реснички в мерцательном эпителии трахеи). Погружённые в слизь реснички формируют волны однонаправленных колебаний и перемещают слизь с заключённые в ней частицами вверх (к выходу их дыхательных путей) по поверхности эпителия (процесс мукоцилиарного транспорта). ФИЗИКО-ХИМИЧЕСКИЕ ФАКТОРЫ Механические барьерные свойства кожи дополняются секретами кожных желёз; последние проявляют прямую бактерицидную активность, либо снижают рН кожи до неблагоприятных значений за счёт секреции кислот (уксусной, молочной и др.). СЛИЗИСТЫЕ ОБОЛОЧКИ Слизь. Слизистые оболочки покрыты слоем слизи — организованной гелеобразной гликопротеиновой структуры, задерживающей и фиксирующей различные объекты, в том числе микроорганизмы. Слизь гидрофильна; через неё могут диффундировать многие образующиеся в организме вещества, в том числе бактерицидные (например, лизоцим и пероксидазы). Лизоцим. В отделяемом слизистых оболочек содержится лизоцим — фермент, лизирующий клеточные стенки преимущественно грамположительных бактерий. Лизоцим присутствует и в других жидкостях организма (например, в слюне, слёзной жидкости). Сурфактант. В нижних участках воздухоносных путей и дыхательном отделе лёгкого слизи нет, но поверхность эпителия покрыта слоем сурфактанта — поверхностно-активного вещества, способного фиксировать и уничтожать грамположительные бактерии. Иммуноглобулины. На поверхность эпителия ЖКТ и респираторного тракта постоянно выделяются молекулы секреторного IgА. ИММУНОБИОЛОГИЧЕСКАЯ ЗАЩИТА. Если возбудитель преодолевает поверхностные физические и химические барьеры, его встречают факторы второй, иммунобиологической линии неспецифических защитных механизмов. Такие защитные механизмы принято делить на гуморальные и клеточные. СИСТЕМА КОМПЛЕМЕНТА Система комплемента — группа по меньшей мере 26 сывороточных белков - компонентов комплемента (табл. 16–3). Компоненты системы комплемента участвуют в реакциях свёртывания крови, способствуют межклеточным взаимодействиям, необходимым для процессинга Аг, вызывают лизис бактерий и клеток, инфицированных вирусами. В норме компоненты системы находятся в неактивной форме. Активация комплемента приводит к поочередному (каскадному) появлению его активных компонентов в серии протеолитических реакций, стимулирующих защитные процессы. Фагоциты выполняют не только защитные (поглощают и разрушают чужеродные агенты), но и дренажные функции (удаляют погибшие и деградировавшие структуры организма). Фагоциты непосредственно участвуют в осуществлении важных процессов:
· ДРУГИЕ ФАКТОРЫ НЕСПЕЦИФИЧЕСКОЙ РЕЗИСТЕНТНОСТИ · ИНТЕРФЕРОНЫ Система интерферона (ИФН) — важнейший фактор неспецифической резистентности организма человека. Интерфероны выполняют антивирусную, противоопухолевую, иммуномодулирующую и радиопротективную функции. Различают три класса ИФН: a-ИФН (его синтезируют лейкоциты периферической крови; ранее он был известен как лейкоцитарный ИФН); b-ИФН (синтезируется фибробластами; ранее обозначался как фибробластный ИФН); g-ИФН (продукт стимулированных Т-лимфоцитов, NK-клеток и, возможно, макрофагов; ранее назывался как иммунный ИФН). По способу образования различают ИФН типа I (образуется в ответ на обработку клеток вирусами, молекулами двухцепочечной РНК, полинуклеотидами и рядом низкомолекулярных природных и синтетических соединений) и ИФН типа II (продуцируется лимфоцитами и макрофагами, активированными различными индукторами; действует как цитокин). ИФН видоспецифичны. Каждый биологический вид, способный к их образованию, продуцирует свои уникальные продукты, похожие по структуре и свойствам, но не способные проявлять перекрёстный антивирусный эффект (то есть действовать в условиях организма другого вида). Механизм антивирусного действия. ИФН блокирут процессы проникновения и/или репродукции вирусов. Блокада репродуктивных процессов при проникновении вируса в клетку обусловлена угнетением трансляции вирусной мРНК. При этом противовирусный эффект ИФН не направлен против конкретных вирусов, то есть ИФН не обладают вирусоспецифичностью. ИФН I. Основной биологический эффект — подавление синтеза вирусных белков; способны воздействовать на другие этапы репродукции вирусных частиц, включая отпочковывание дочерних популяций. «Антивирусное состояние» клетки развивается в течение нескольких часов после введения интерферонов или индукции их синтеза. При этом интерфероны не влияют на ранние этапы репликативного цикла (адсорбцию, пенетрацию и «раздевание» вирусов) — противовирусное действие проявляется даже при заражении клеток инфекционными РНК. ИФН не проникают в клетки, а взаимодействуют со специфическими мембранными рецепторами (ганглиозиды или аналогичные структуры, содержащие олигосахара). По связыванию ИФН с рецептором и реализации его эффектов механизм активности напоминает действие некоторых гликопептидных гормонов. ИФН активирует гены, некоторые из которых кодируют образование продуктов с прямым антивирусным действием — протеинкиназы и олигоаденилат синтетазы. ИФН II (b-ИФН) также способны проявлять антивирусный эффект. Он связан с несколькими механизмами. Во-первых, активация интерфероном NO-синтетазы приводит к повышению внутриклеточного содержания оксида азота, ингибирующего размножение вирусов. Во-вторых, ИФН активирует эффекторные функции NK-клеток, Т-лимфоцитов, моноцитов, тканевых макрофагов и гранулоцитов, проявляющих антителозависимую и антителонезависимую цитотоксичность. Кроме того, ИФН блокирует депротеинизацию («раздевание») вирусов, высвобождение зрелых вирусных частиц из клетки, а также нарушает метилирование вирусной РНК. В смешанных культурах ИФН-чувствительных и ИФН-резистентных клеток «антивирусное состояние» чувствительных клеток распространяется и на популяции резистентных клеток. ЕСТЕСТВЕННЫЕ АТ Естественные АТ («антигеннезависимые», «неспецифические» АТ) составляют до 7% общего количества иммуноглобулинов в сыворотке крови неиммунизированных людей и животных. Их происхождение связывают с ответом иммунной системы на Аг нормальной микрофлоры. В эту же группу входят АТ, длительно циркулирующие после выздоровления от инфекционного заболевания. Часть пула подобных АТ синтезируется параллельно с образованием специфических АТ. Эти АТ низкоспецифичны, но способны перекрёстно реагировать с широким спектром Аг. Вызывают агглютинацию микробов, их разрушение (в присутствии комплемента), нейтрализуют вирусы и токсины, стимулируют фагоцитарные реакции (через опсонизацию возбудителей). ЕСТЕСТВЕННЫЕ КИЛЛЕРЫ Помимо фагоцитирующих клеток, важную роль в быстром реагировании организма на чужеродные Аг играют естественные киллеры (NK-клетки). Эту популяцию составляют большие зернистые лимфоциты, элиминирующие ауто-, алло- и ксеногенные опухолевые клетки; клетки, инфицированные вирусами и бактериями, а также простейшими. NK-клетки не имеют основных маркёров лимфоцитов (поэтому их также называют нулевые лимфоциты), но экспрессируют дифференцировочные CD2, CD56 и CD16 (рецептор Fc-фрагмента АТ) Аг. · ИММУНОПАТОЛОГИЧЕСКИЕ СОСТОЯНИЯ И РЕАКЦИИ
|
|||||||||
|
Последнее изменение этой страницы: 2017-02-10; просмотров: 425; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.135.217.228 (0.068 с.) |