
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Химические свойства металлов.
1. Взаимодействие с неметаллами: 2Na+Cl2→2NaCl 2Mg+O2→2MgO 2. Взаимодействие с водой: 2Na+2H2O→2NaOH+H2 Mg+2H2O→Mg(OH)2+H2 С водой с образованием основания и водорода взаимодействуют только активные металлы (стоящие в ряду напряжений до алюминия). 3. Взаимодействие с кислотами: 2Na+H2SO4→2Na2SO4+H2 Mg+2HCl→MgCl2+H2 Водород из кислот вытесняют металлы, стоящие в ряду напряжений до водорода. 4. Взаимодействие с растворами солей Zn+CuSO4 →Cu+ZnSO4 Fe+2AgNO3→2Ag+Fe(NO3)2 Более активный металл (стоящий в ряду напряжений левее) вытесняет менее активный металл из раствора его соли. Неметаллы, их положение в периодической системе химических элементов Д. И. Менделеева, строение их атомов. Неметаллы в периодической системе расположены в правой верхней части, справа от диагонали «бор – астат». Это элементы главных подгрупп III, IV, V, VI, VII и VIII групп. К неметаллам относятся: бор, углерод, кремний, азот, фосфор, мышьяк, кислород, сера, селен, теллур, водород, фтор, хлор, бром, йод, астат. К неметаллам также относятся благородные газы: гелий, неон, аргон, криптон, ксенон, радон. На внешнем электронном слое у атомов неметаллов находится большое число электронов – от 4 до 8, поэтому для атомов неметаллов более характерной является способность присоединять электроны для завершения электронного слоя. В периодах неметаллические свойства увеличиваются слева направо, в группах – уменьшаются сверху вниз. Самый неметаллический элемент – фтор. Неметаллы – окислители. Благородные газы имеют завершённый электронный слой и соединений почти не имеют. Классификация химических реакций в неорганической и органической химии. Химические реакции можно классифицировать по следующим признакам: По изменению степени окисления. Процессы, в результате которых происходит изменение степени окисления, называют окислительно-восстановительными реакциями. 2Feо + Cl2о → 2Fe+3Cl3-1 По числу и составу исходных и образующихся веществ. а. Реакции разложения - реакции, в результате которых из одного вещества образуются несколько других веществ: АВ→А+В Cu(OH)2→CuO+H2O CH4→C+2H2 б. Реакции соединения - реакции, в результате которых из двух или нескольких веществ образуется одно новое вещество: А+В→АВ
СаО+Н2О→Са(ОН)2 СН2=СН2+Н2→СН3-СН3 а. Реакции замещения - реакции, при которых атомы простого вещества замещают атомы одного из элементов в сложном веществе: АВ+С→СВ+А. Реакции замещения всегда идут с изменением степеней окисления. 2AgNO3 + Fe → Fe(NO3)2 + 2Ag Fe + 2HCl → FeCl2 + H2 В органической химии реакции замещения понимаются шире: CH4+Cl2→CH3Cl+HCl б. Реакции обмена - реакции, протекающие между двумя сложными веществами, при которых их составные части обмениваются местами: АВ+СD→CB+AD Na2SO4 + BaCl2 → BaSO4 NaOH+CH3COOH→CH3COONa+H2O По тепловому эффекту. Химические реакции по тепловому эффекту подразделяются на две группы: а.Экзотермическими называют реакции, которые протекают с выделением теплоты: 2H2 + О2 → 2H2О + Q б. Эндотермическими называют реакции, которые протекают с поглощением теплоты. 2CH4→C2H2+3H2 - Q По признаку обратимости. а. Необратимыми называют такие реакции, которые протекают до конца, то есть до полного израсходования одного из реагирующих веществ. AlCl3 + 3AgNO3 → 3AgCl б. Обратимые химические реакции протекают при данных условиях во взаимно противоположных направлениях. N2 + 3H2 N2 + O2
|
|||||
|
Последнее изменение этой страницы: 2017-02-10; просмотров: 224; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.141.192.219 (0.004 с.) |
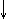 + 2NaCl
+ 2NaCl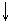 + Al(NO3)3
+ Al(NO3)3 2NH3 + Q
2NH3 + Q


