
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Основное уравнение молекулярно-кинетической теории идеального газа
Для упрощения рассмотрения процессов в газах можно пренебречь взаимодействием молекул газа, т.к. оно не оказывает существенного влияния на поведение молекул. Немецкий физик Клаузиус ввел понятие идеального газа, в котором: · Объемом всех молекул газа можно пренебречь по сравнению с объемом сосуда, в котором этот газ находится. · Время столкновения молекул друг с другом пренебрежимо мало по сравнению со временем между двумя столкновениями (т.е. со временем свободного пробега молекул). · Молекулы взаимодействуют между собой только при непосредственном соприкосновении, при этом они отталкиваются. · Силы притяжения между молекулами идеального газа ничтожно малы, и ими можно пренебречь. Реальный газ при нормальном давлении очень близок по свойствам к идеальному газу. Значительное повышение давления газа приводит к существенному уменьшению среднего расстояния между молекулами и поэтому реальный газ уже нельзя считать идеальным. Так при давлении 500 МПа объем молекул составит половину занимаемого газом объема. Давление газа. Молекулы газа, ударяясь о поверхность тела (например, о стенку сосуда), оказывают на нее давление. Давление Единица измерения давления в системе СИ:
Существуют и другие единицы измерения давления. Наиболее распространенными из них являются атмосфера и миллиметр ртутного столба. Техническая атмосфера - давление, оказываемое силой 1 кгс на площадь 1 Миллиметр ртутного столба ( Прибор для измерения давления называется манометром.
 (рисунок 2). В каждой единице объема куба содержится (рисунок 2). В каждой единице объема куба содержится  одинаковых молекул газа. Общее число молекул в кубе одинаковых молекул газа. Общее число молекул в кубе  . Будем считать удары молекул о стенки сосудов абсолютно упругими. Каждая молекула обладает количеством движения (импульсом) p= . Будем считать удары молекул о стенки сосудов абсолютно упругими. Каждая молекула обладает количеством движения (импульсом) p=  , где , где 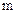 - масса молекулы, а - масса молекулы, а  - скорость её движения. В процессе удара импульс меняется на величину - скорость её движения. В процессе удара импульс меняется на величину 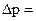 2 2  , и, следовательно, стенка получает импульс силы , и, следовательно, стенка получает импульс силы  =2 =2  . .
Средняя сила воздействия одной молекулы на стенку равна: Отсюда: Сила давления газа на стенку куба равна сумме сил ударов
Величина Отсюда:
Отсюда: Поскольку:
 , отсюда: - - основное уравнение молекулярно-кинетической теории газов: давление газа прямо пропорционально средней кинетической энергии поступательного движения его молекул и числу молекул в единице объема. , отсюда: - - основное уравнение молекулярно-кинетической теории газов: давление газа прямо пропорционально средней кинетической энергии поступательного движения его молекул и числу молекул в единице объема.
Поскольку Контрольные вопросы: 1. Что такое идеальный газ? 2. Что такое давление газа и какие единицы измерения давления Вам известны? 3. Изложите основное уравнение молекулярно-кинетической теории газа (без вывода).
|
|||||||||||
|
Последнее изменение этой страницы: 2017-02-09; просмотров: 286; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.129.249.105 (0.007 с.) |
 , где
, где  – сила давления,
– сила давления,  – площадь поверхности тела.
– площадь поверхности тела.
 . 1
. 1  .
. ) – это давление, оказываемое столбом ртути высотой 1мм. на горизонтальную поверхность. Давление внутри жидкости на глубине h:
) – это давление, оказываемое столбом ртути высотой 1мм. на горизонтальную поверхность. Давление внутри жидкости на глубине h:  . 1мм.рт.ст. =
. 1мм.рт.ст. =  =133 Па
=133 Па

 со скоростью
со скоростью 
 , где
, где  - время движения молекулы от одной стенки к другой и обратно.
- время движения молекулы от одной стенки к другой и обратно.  .
.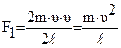 .
. отдельных молекул об эту стенку:
отдельных молекул об эту стенку: .
. - называется среднеквадратической скоростью
- называется среднеквадратической скоростью  .
. и
и 
 где:
где: общего числа молекул.
общего числа молекул.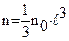 и тогда:
и тогда: 
 , а средняя кинетическая энергия поступательного движения молекулы
, а средняя кинетическая энергия поступательного движения молекулы
 - плотность газа, то
- плотность газа, то  - уравнение Клаузиуса.
- уравнение Клаузиуса.


