
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Характеристика свойств элемента и его соединений по электронной формуле и по положению в периодической системе элементов.Стр 1 из 6Следующая ⇒
Экзаменационный билет №1 Характеристика свойств элемента и его соединений по электронной формуле и по положению в периодической системе элементов.
2. Найдите константу равновесия системы, в которой протекает процесс: 2Fe3+ + Sn2+ D 2Fe2+ + Sn4+, если известно: j0(Fe3+/Fe2+) = +0,77 В; j0(Sn4+/Sn2+) = +0,15 В Сравнивая величины стандартных окислительно-восстановительных потенциалов, видим, что Fe3+ — более сильный окислитель, чем Sn4+. Поэтому в системе будут идти следующие процессы: Fe3+ + e– ® Fe2+ — восстановление Sn2+ – 2e– ® Sn4+ — окисление Суммарная схема процесса: 2Fe3+ + Sn2+ D 2Fe2+ + Sn4+ Вычисляем ЭДС. E = j0(Fe3+/Fe2+) – j0(Sn4+/Sn2+) = 0,77 – 0,15 = 0,62 В. Вычисляем константу равновесия. lg K = nE / 0,059 n — наименьшее общее кратное чисел электронов в полуреакциях окисления и восстановления. lg K = 2 · 0,62 / 0,059 = 21,0 K = 1021. 3. Определите изменение внутренней энергии системы при испарении 250 г воды при 290 К, допуская, что пары воды подчиняются законам идеальных газов. Удельная теплота парообразования воды при этой температуре составляет 2451 Дж/К Изменение внутренней энергии ΔU = Q – W, где Q — теплота, подведенная к системе, W — работа. Определяем теплоту испарения 0,250 кг воды. Q = m · Lисп = 0,250 · 2451 = 612,75 кДж. Испарение происходит при постоянном давлении, поэтому работа испарения равна: W = p(V2 – V1) V2 — объем газообразной фазы, V1 — объем жидкой фазы. Объемом жидкой фазы пренебрегаем, так как объем жидкости при температурах, далеких от критической, значительно меньше объема пара. Объем газообразной фазы определяем по закону идеального газообразного состояния: V2 = nRT / p Здесь T — нормальная температура кипения, равная для воды 373,15 К. Найдем количество воды, учитывая молярную массу, равную 18,01 г/моль. n = m(H2O) / M(H2O) = 250 / 18,01 = 13,88 моль. W = pnRT / p = nRT = 13,88 · 8,314 · 373,15 = 43061 Дж = 43,06 кДж. Изменение внутренней энергии: ΔU = Q – W = 612,75 – 43,06 = 569,69 кДж. Экзаменационный билет №2 1. Ковалентная химическая связь. Механизмы её образования, характеристика ковалентной связи.
Экзаменационный билет №3 Экзаменационный билет №4 Экзаменационный билет №5 Термодинамические функции состояния системы. Термодинамические законы и расчёты.
2. Какая масса NaOH необходима для полного растворения 6,54 г цинка в водном растворе? Сколько литров H2(г) выделяется при этом (условия нормальные)?
Уравнение реакции: Zn + 2NaOH + 2H2O = H2 + Na2[Zn(OH)4] Zn + 2OH– + 2H2O = H2 + [Zn(OH)4]2– Найдем количество цинка. n(Zn) = m(Zn) / M(Zn) = 6,54 / 65,4 = 0,1 моль. По уравнению реакции щёлочи нужно вдвое больше, т. е. 0,2 моль. Её масса: m(NaOH) = n(NaOH) · M(NaOH) = 0,2 · 40 = 8 г. Количество выделяемого водорода 0,1 моль, его объём: V(H2) = n(H2) · Vм = 0,1 моль · 22,4 л/моль = 2,24 л. Напишите электронную формулу и приведите электронно-графическую схему атома хлора в максимальной степени возбуждения. Какие значения может иметь положительная степень окисления хлора? Электронная схема атома хлора: 17Cl 1s22s22p63s23p5 Электронно-графическая схема атома хлора:
При возбуждении часть электронов переходят на 3d-подуровень: 17Cl* 1s22s22p63s13p33d3 Электронно-графическая схема атома хлора в возбужденном состоянии:
Для хлора характерны положительные степени окисления от +1 до +7, из них наиболее устойчивы +1, +3, +5 и +7. Экзаменационный билет №6 Экзаменационный билет №7 Экзаменационный билет №8 Экзаменационный билет №9 За 10 минут из раствора нитрата платины ток силой 5 А выделил 1,517 г Pt. Определите эквивалентную массу платины. Какой газ и в каком количестве при этом выделяется на аноде, приведите схему электролиза и процессы Согласно законам Фарадея, масса (объем) вещества, выделяющегося на электроде, равна: m = MЭ × I × t / F, или V = VЭ × I × t / F MЭ – молярная масса эквивалента, VЭ – молярный объем эквивалента, F – число Фарадея, I – сила тока (А), t – время электролиза (с). По условию m = 1,517 г; I = 5 A; t = 10 · 60 = 600 с. Вычисляем молярную массу эквивалента платины. MЭ = m · F / (I · t) = 1,517 · 96487 / (5 · 600) = 48,79 г/моль. Молярная масса платины 195,1 г/моль. Значит, валентность платины в нитрате равна 195,1 / 48,79 = 4. Катодный процесс: Pt4+ + 4e– ® Pt0. Нитрат-ионы на аноде не разряжаются. Вместо них окисляются молекулы воды:
2H2O – 4e– ® O2 + 4H+ Вычисляем объем кислорода, учитывая, что молярный объем эквивалента кислорода равен 5,6 л/моль. V(O2) = 5,6 · 5 · 600 / 96487 = 0,174 л. Схема электролиза: Pt(NO3)4 + 2H2O = Pt + O2 + 4HNO3 Экзаменационный билет №10 Привести запись гальванического элемента, возникающего на посеребрённой стальной поверхности при нарушении целостности покрытия. Записать процессы коррозии во влажной атмосфере, указать продукты коррозии Запишем величины стандартных окислительно-восстановительных потенциалов металлов. E0(Fe2+/Fe) = –0,44 В E0(Ag+/Ag) = +0,80 В E0(Fe2+/Fe) < E0(Ag+/Ag), поэтому железо будет анодом, а серебро — катодом. Коррозия во влажном воздухе: катод: 2H2O + O2 + 4e– ® 4OH– (восстановление) анод: Fe0 – 2e– ® Fe2+ (окисление) Схема процесса: 2Fe + 2H2O + O2 = 2Fe(OH)2 На воздухе Fe(OH)2 подвергается дальнейшему окислению: 4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3 Таким образом, продукт коррозии — ржавчина Fe3O4, образуемая при высыхании гидроксидов железа. Схема гальванического элемента: (–) Fe | O2, H2O | Ag (+) Экзаменационный билет №11 Экзаменационный билет №12 Экзаменационный билет №13 1. Ионное произведение воды. Водородный и гидроксильный показатель. Условие образования осадка, произведение растворимости.
Экзаменационный билет №14 При какой температуре начинается процесс разложения карбоната кальция на оксиды? В какую сторону (увеличения или уменьшения) надо сдвинуть температуру, чтобы процесс протекал только в прямом направлении? Уравнение реакции: CaCO3 = CaO + CO2 Рассчитаем тепловой эффект этой реакции. DH0 = DH0(CaO) + DH0(CO2) – DH0(CaCO3) DH0(CaO) = –635,5 кДж/моль DH0(CO2) = –393,51 кДж/моль DH0(CaCO3) = –1206,9 кДж/моль DH0 = –635,5 + (–393,51) – (–1206,9) = 177,89 кДж. Рассчитаем изменение энтропии. DS0 = S0(CaO) + S0(CO2) – S0(CaCO3) S0(CaO) = 39,7 Дж/(моль×К) S0(CO2) = 213,68 Дж/(моль×К) S0(CaCO3) = 92,9 Дж/(моль×К) DS0 = 39,7 + 213,68 – 92,9 = 160,48 Дж/К Вычислим изменение энергии Гиббса при 298 К. DG0 = DH0 – TDS0 = 177,89 – 298 × 0,16048 = 130,07 кДж. При стандартных условиях DG0 > 0 и реакция разложения не идёт. Рассчитаем температуру начала реакции. В этом случае DG0 = 0. DH0 = TDS0 T = DH0 / DS0 = 177,89 / 0,16048 = 1108 К. При температуре выше 1108 К процесс разложения карбоната кальция идет в прямом направлении. Экзаменационный билет №15 Экзаменационный билет №16 1. Классификация окислительно-восстановительных процессов (на примерах). Условие самопроизвольного протекания и направленность этих процессов
Экзаменационный билет №17 Экзаменационный билет №18 Экзаменационный билет №19 Экзаменационный билет №20 1. Характеристика свойств
2. При взаимодействии метана и сероводорода образуется CS2(г) и H2(г). Вычислите изменение энтальпии и энтропии процесса в стандартных условиях. Определите ориентировочную температуру начала процесса Уравнение реакции: CH4(г) + 2H2S(г) = CS2(г) + 4H2(г) Найдем DH0 по следствию из закона Гесса. DH0 = DH0(CS2, г) – DH0(CH4, г) – 2DH0(H2S, г) DH0(CS2, г) = 88,7 кДж/моль DH0(CH4, г) = –74,85 кДж/моль DH0(H2S, г) = –21,0 кДж/моль DH0 = 88,7 – (–74,85) – 2 · (–21,0) = 205,55 кДж Найдем DS0. DS0 = S0(CS2, г) + 4S0(H2, г) – S0(CH4, г) – 2S0(H2S, г) S0(CS2, г) = 151,0 Дж/моль×К S0(H2, г) = 130,52 кДж/моль S0(CH4, г) = 186,19 кДж/моль S0(H2S, г) = 205,7 кДж/моль DS0 = 151,0 + 4 · 130,52 – 186,19 – 2 · 205,7 = 75,49 Дж/К.
DG0 = DH0 – TDS0 В состоянии равновесия DG0 = 0. DH0 = TDS0 T = DH0 / DS0 = 205,55 / 0,07549 = 2722,9 К. Ориентировочная температура начала реакции 2723 К. 3. Энергия активации реакции O3(г) + NO(г) ® O2(г) + NO2(г) равна 10 кДж/моль. Каково значение температурного коэффициента процесса в интервале температур 300…310 К? Процесс подчиняется правилу Вант – Гоффа Уравнение реакции: O3(г) + NO(г) ® O2(г) + NO2(г) Энергия активации связана с константами скорости процесса при двух температурах:
По условию T1 = 300 К; T2 = 310 К
Известно, что отношение скоростей (и констант скоростей) при двух температурах связано с температурным коэффициентом скорости g:
Вычисляем g.
Экзаменационный билет №1 Характеристика свойств элемента и его соединений по электронной формуле и по положению в периодической системе элементов.
2. Найдите константу равновесия системы, в которой протекает процесс: 2Fe3+ + Sn2+ D 2Fe2+ + Sn4+, если известно: j0(Fe3+/Fe2+) = +0,77 В; j0(Sn4+/Sn2+) = +0,15 В Сравнивая величины стандартных окислительно-восстановительных потенциалов, видим, что Fe3+ — более сильный окислитель, чем Sn4+. Поэтому в системе будут идти следующие процессы: Fe3+ + e– ® Fe2+ — восстановление Sn2+ – 2e– ® Sn4+ — окисление Суммарная схема процесса: 2Fe3+ + Sn2+ D 2Fe2+ + Sn4+ Вычисляем ЭДС. E = j0(Fe3+/Fe2+) – j0(Sn4+/Sn2+) = 0,77 – 0,15 = 0,62 В. Вычисляем константу равновесия. lg K = nE / 0,059 n — наименьшее общее кратное чисел электронов в полуреакциях окисления и восстановления. lg K = 2 · 0,62 / 0,059 = 21,0 K = 1021. 3. Определите изменение внутренней энергии системы при испарении 250 г воды при 290 К, допуская, что пары воды подчиняются законам идеальных газов. Удельная теплота парообразования воды при этой температуре составляет 2451 Дж/К Изменение внутренней энергии ΔU = Q – W, где Q — теплота, подведенная к системе, W — работа. Определяем теплоту испарения 0,250 кг воды. Q = m · Lисп = 0,250 · 2451 = 612,75 кДж. Испарение происходит при постоянном давлении, поэтому работа испарения равна: W = p(V2 – V1) V2 — объем газообразной фазы, V1 — объем жидкой фазы. Объемом жидкой фазы пренебрегаем, так как объем жидкости при температурах, далеких от критической, значительно меньше объема пара. Объем газообразной фазы определяем по закону идеального газообразного состояния: V2 = nRT / p Здесь T — нормальная температура кипения, равная для воды 373,15 К. Найдем количество воды, учитывая молярную массу, равную 18,01 г/моль.
n = m(H2O) / M(H2O) = 250 / 18,01 = 13,88 моль. W = pnRT / p = nRT = 13,88 · 8,314 · 373,15 = 43061 Дж = 43,06 кДж. Изменение внутренней энергии: ΔU = Q – W = 612,75 – 43,06 = 569,69 кДж. Экзаменационный билет №2 1. Ковалентная химическая связь. Механизмы её образования, характеристика ковалентной связи.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-09; просмотров: 289; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.223.0.53 (0.057 с.) |
 Приведите процессы окисления, восстановления.
Приведите процессы окисления, восстановления.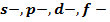 элементов и их соединений: комплексообразующих, кислотно-основных, окислительно-восстановительных
элементов и их соединений: комплексообразующих, кислотно-основных, окислительно-восстановительных
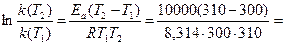 0,1293
0,1293 1,1381.
1,1381.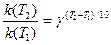
 1,1381.
1,1381.


