
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Кинетика восстановления организма после тотального облучения
Восстановление организма после острого лучевого поражения в приближении можно свести к пролиферации клеток, сохранивших жизнеспособность, вследствие которой восполняется убыль популяции клеток критических органов и восстанавливается их функциональная активность. Недавно считали, что источником пострадиационного восстановления являются лишь непораженные клеточные элементы. Однако это не так. Резервом пролиферации клеток критических тканей и органов, очевидно, могут быть не только непораженные клетки, но и клетки, пораженные обратимо и восстановившие жизнеспособность, точнее свою способность к неограниченному размножению. В облученной популяции следует различать два типа пострадиационного восстановления: пролиферацию клеточных элементов и восстановление на клеточном уровне. Процессы восстановления в организме животного и человека после облучения протекают с различной скоростью: наивысшей в активно пролиферирующих тканях и минимальной в тканях с низким уровнем физиологической регенерации. Распространенный метод количественной оценки пострадиационного восстановления организма состоит в изучении его чувствительности к повторному облучению, производимому в разные сроки после первоначального радиационного воздействия. Этот метод и положенная в его основу теория восстановления организма впервые были выдвинуты Г.А. Блэром (1955), а затем развиты Тогда в соответствии с теорией «чистое» поражение (эффективную дозу) можно выразить следующей формулой:
где f – необратимая часть поражения; (1 – f) – доля обратимого лучевого повреждения; b – скорость восстановления в сутки, %; Т – число суток;
Если повторное облучение и определение ЛД50/100 производить через разные промежутки времени, то по разнице между величинами ЛД50/100 однократного и повторного облучений можно определить изменение во времени величины остаточного радиационного поражения (его необратимую компоненту), темп восстановления радиорезистентности организма и период полувосстановления (время, необходимое для восстановления организма от лучевого поражения на 50%). Период полувосстановления (T1/2) практически является константой, как правило, увеличивающейся с продолжительностью жизни животного. По данным разных авторов, он равен (в сутках) для мыши 2–8; для крысы 6–9, для собаки 14–18, для осла 20–28. У человека T1/2, согласно расчетам, составляет 25–45 суток; в среднем его принимают за 28 суток при скорости восстановления – 0,1 %. Американскими исследователями была предложена формула для вычисления эффективной (остаточной) дозы для человека с расчетом, что 10% поражения остается необратимым:
Dэф = 0,1D + 0,9D × 0,95t–4, (3.2)
где D – доза при однократном облучении, t – число суток, прошедших после облучения. Позднее была предложена упрощенная формула:
Dэф = D (КВ), (3.3)
где KB–коэффициент времени – часть поражения, накопленного (оставшегося) к каждому данному моменту времени, прошедшему после первого облучения. В последующем была подтверждена справедливость концепции Блэра–Дэвидсона в ее общем виде, особенно в области ориентировочного прогнозирования тяжести поражения и планирования мер по противолучевой защите человека. В то же время сравнительно рано начали накапливаться факты, противоречащие ей и имеющие большое принципиальное научное значение, важное для экспериментальной и клинической радиобиологии. Прежде всего, стало известно, что для процесса пострадиационного поражения организма характерна фазовая периодичность, сопровождающаяся переменой знака радиочувствительности. Вначале были получены данные о возможности уменьшения чувствительности мышей к повторному облучению, индуцируемому предварительным не летальным облучением. В последующем аналогичные результаты наблюдались на крысах, собаках и овцах.
В опытах И.Г. Акоева на мышах, подвергнутых повторному облучению, установлено, что наибольший темп восстановления наблюдается после первоначального воздействия в дозе 4 Гр. Темп восстановления, по мнению автора работы, связан соответственно с возрастанием тяжести поражения или с недостаточной мобилизацией репарационных механизмов из-за слабой степени альтерирующего воздействия. Отмечено также, что чувствительность организма к повторному облучению не совпадает с клиническими признаками болезни, так как определяемое таким способом восстановление может опережать развитие разнообразных проявлений лучевого синдрома. Все эти данные послужили основой для критики приведенных теоретических принципов восстановления. В специальных работах В.А. Резонтова (1965), посвященных анализу этого вопроса, справедливо указывается на неправомерность такого подхода для универсальной оценки состояния облученного организма по следующим соображениям: 1) возможно несоответствие между интенсивностью временных процессов при первом и повторном облучениях; 2) не исключена несопоставимость общепринятых оценочных тестов при первом и повторном облучениях; 3) принципиально невозможно равенство биологической эффективности доз первого и второго облучения в любом их сочетании; 4) отсутствие достаточных оснований полностью распространять все выявленные закономерности на дозы, не вызывающие гибель. Все это, однако, не снижает ценности количественных принципов Блэра, а лишь свидетельствует о необходимости внесения соответствующих корректив при построении и анализе конкретных экспериментов с учетом постоянно накапливающейся информации. Поэтому при рассмотрении клеточных аспектов пострадиационного восстановления организма необходимо (при известной ограниченности такого подхода) выделить наиболее ответственное звено в цепи развивающихся событий, поражение и восстановление которого поддается количественному учету. Самый рациональный путь решения данного вопроса–в цитокинетическом и функциональном изучении критических органов, определяющих течение и исход лучевого поражения организма в соответствующих доз. 3.11.2. Фазное изменение радиорезистентности Фазовое изменение радиочувствительности для изолированных клеток наблюдается не только в относительно отдаленные сроки, но и в первые часы после облучения. Вначале (первые 5–8 ч) происходит повышение радиорезистентности, затем (через 9–12 ч) – кратковременное ее снижение, после чего она снова монотонно повышается. Аналогичное явление обнаружено и при изучении выживаемости животных после облучения в дозах, вызывающих гибель при явлениях костномозгового и кишечного синдромов. Начальный период повышения радиорезистентности клеток связывают с восстановлением их от сублетальных повреждений, фазу повышения радиочувствительности–с частичной синхронизацией пула на наиболее радиочувствительной стадии клеточного цикла, а последующее монотонное снижение чувствительности объясняют следствием начавшейся клеточной регенерации. Изменение радиочувствительности организма, происходящее в первые часы после облучения в данном диапазоне доз, целиком определяется состоянием кроветворных клеток. Если это так, то снижение чувствительности, наблюдающееся через 18 и 24 ч после первой дозы (3 Гр), легко объясняется начавшейся регенерацией кроветворных клеток, которая при данном уровне радиационного воздействия уже хорошо обнаруживается. Однако для результатов, полученных в более ранние сроки, в частности через 3 и 6 ч, такое объяснение неприемлемо, так как в это время митотическая активность костного мозга почти полностью угнетена. Между тем выживаемость мышей в эти сроки увеличивается на 20–50%.
Есть все основания рассматривать наблюдаемое явление как результат восстановления жизнеспособности части клеток костного мозга, элиминировавших сублетальные повреждения, нанесенные первой дозой. Вследствие этого к моменту повторного облучения увеличивается фонд жизнеспособных клеток. Анализ костного мозга через трое суток (период максимальной аплазии) после двукратного облучения с 3-часовым интервалом действительно показал, что число кариоцитов более чем на 30%.превышает уровень, имеющий место у контрольных животных, подвергнутых однократному облучению в той же суммарной дозе. Доля клеток, выживших после первого облучения, должна быть представлена наиболее радиорезистентной частью асинхронной популяции костного мозга. Поэтому при отсутствии восстановления увеличение интервала между повторными облучениями должно сопровождаться снижением резистентности вследствие продвижения клеток по циклу в сторону более чувствительной стадии. На самом деле увеличение этого интервала до нескольких часов приводит к увеличению числа выживших клеток, что однозначно свидетельствует о наличии истинного восстановления жизнеспособности у части клеток. Данная точка зрения получила подтверждение в экспериментах на синхронизированных клеточных культурах. О наличии восстановления свидетельствует и тот факт, что в период снижения резистентности (10–12 ч после облучения), несмотря на синхронизацию кроветворных клеток в наиболее радиочувствительной стадии, эффект двукратного облучения ни по гибели клеток, ни по летальности животных никогда не превышает наблюдающегося при однократном облучении. Изменение радиочувствительности организма в первые же часы после облучения наблюдается и при более высоких дозах, вызывающих «кишечную» гибель. При рентгеновском двукратном облучении мышей в суммарной дозе 12 Гр также наблюдается фазное изменение радиорезистентности организма, тестируемое по интенсивности «кишечной» гибели – числу мышей, погибших к четвертому дню. В этом случае существование истинного восстановления подтверждается отсутствием различий между эффектами однократного и повторного облучения нейтронами, вызывающими труднорепарируемые или вовсе нерепарируемые повреждения клеток.
Повышение радиорезистентности в ранние сроки после облучения наблюдалось на различных объектах (колониеобразующих клетках костного мозга, кишечника и кожи) и у животных разных видов (мыши, крысы, хомяки, бараны).
Раздел 4 (лекции № 8) АСПЕКТЫ
|
||||||||||
|
Последнее изменение этой страницы: 2017-02-08; просмотров: 647; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.146.105.194 (0.011 с.) |
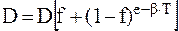 , (3.1)
, (3.1)


