Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Характеристика атомного ядра
Атом – мельчайшая частица вещества, являющаяся носителем его свойств. Молекула – мельчайшая частица сложного вещества состоит из атомов. Раньше считалось, что атом неделим. Позже выяснилось, что он является сложной системой. Атом любого элемента можно разделить на субатомные (элементарные) частицы (рис. 3). Атомы всех элементов, входящих в периодическую систему, состоят из электронов, протонов и нейтронов. Один элемент отличается от другого только числом и расположением этих частиц. В зависимости от уровня энергии, которая удерживает электроны вокруг ядра, они группируются на том или ином уровне. Электронные уровни (слои) создают оболочку атома. Количество электронов в каждом слое строго определено.
Рис. 3. Строение атома. Электрон – устойчивая элементарная частица с массой покоя, равной 0,000548 а.е. м., или 9,1*10-28 г. Энергетический эквивалент электрона составляет 0,511 МэВ. Электрон несёт один элементарный отрицательный заряд. В атоме количество электронов всегда равно сумме протонов. В силу равенства положительных и отрицательных зарядов атом представляет собой электронейтральную систему. При сообщении электронам извне дополнительной энергии они могут переходить с одного энергетического уровня на другой или покидать пределы данного атома. Если воздействие будет слабее энергии связи электрона с ядром, то электрон перейдёт на вышележащий уровень. Такой атом останется нейтральным, но будет отличаться избытком энергии. Атомы, обладающие избытком энергии, называются возбуждёнными, а сам процесс перехода – возбуждением. Поскольку в природе всякая система стремиться перейти в положение с минимумом энергии, то и атом из возбуждённого состояния переходит в нормальное, что сопровождается выделением избыточной энергии. Переход электронов с внешних орбит на внутренние сопровождается рентгеновским излучением с длиной волны, характерной для каждого энергетического уровня данного атома. Переходы в пределах внешних орбит дают оптический спектр, который состоит из ультрафиолетовых, световых и инфракрасных лучей. При сильных электрических воздействиях электроны вырываются из ядра и удаляются из него. Атом, лишившийся электронов, превращается в положительно заряженный ион, а присоединивший к себе электроны – в отрицательный. Процесс образования ионов называется ионизацией. Атом в состоянии иона существует непродолжительное время. Вакантное место заполняется свободным электроном и атом снова становиться электронейтральным. Этот процесс носит название рекомбинации ионов или деионизации и сопровождается выделением энергии.
Ядро атома состоит из двух типов частиц: протонов и нейтронов, которые имеют общее название нуклон (рис. 4.).
Рис. 4. Строение атома. Протон – устойчивая элементарная частица, которая в 1840 раз тяжелее электрона, имеет положительный заряд, равный заряду электрона. Также протон часто определяют как ядро атома водорода. Количество протонов в ядре называется атомным номером или зарядовым числом (Z); оно соответствует порядковому номеру элемента периодической системе. Нейтрон – электрически нейтральная частица, масса которой равна 1,00898 а. е. м. Сам по себе нейтрон нестабилен. Находясь в свободном состоянии, он испускает электрон и антинейтрино и превращается в протон. Нейтроны, находящиеся в ядре дают основном только физическую характеристику элемента, так как в разных ядрах одного и того же элемента может быть разное количество нейтронов (1-10). В ядрах лёгких устойчивых элементов число протонов и нейтронов относится друг к другу как 1:1. Чем дальше элемент в таблице Д.И. Менделеева, тем больше в его атомах число нейтронов по сравнению с протонами. Диаметр ядра равен примерно 10–13–10–12 см, но практически вся масса сосредоточена в нём. Масса электронной оболочки незначительна, поэтому масса ядра совпадает с массой атома. Сумма протонов и нейтронов в ядре называется массовым числом и обозначается буквой А (или М). Число нейтронов N в ядре равно разности между массовым числом и атомным номером элемента N = A – Z. При обозначении атомов обычно используют символ элемента, которому принадлежит атом, и указывают слева вверху массовое число, а внизу – порядковый номер в виде индекса: Большинство химических элементов в природе представляет собой определённые смеси атомов с различным числом нейтронов в ядрах. Атомы, однотипные по количеству протонов (с одинаковым зарядом), но различные по количеству нейтронов, называются изотопами. Такие элементы имеют одинаковый порядковый номер, но разное массовое число
В природе существуют ядра разных элементов с одинаковым массовым числом, но разным атомным номером. Такие атомы называют изобарами (например, и). Атомные ядра разных элементов с равным количеством нейтронов называют изотонами (и; в ядре первого 6 протонов и 7 нейтронов, а в ядре второго 7 протонов и тоже 7 нейтронов).
Ядерные силы, дефект массы Казалось бы, что согласно закону Кулона, положительные протоны должны были бы отталкиваться. Однако, в действительности ядра атомов достаточно прочные образования. Считают, что наиболее вероятно ядерные силы возникают в процессе непрерывного обмена между нуклонами Чтобы разделить ядро на протоны и нейтроны и удалить их из поля действия ядерных сил нужно затратить энергию. Эта энергия называется энергией связи ядра. При образовании ядра эта энергия выделяется. Если рассчитать массу ядра по формуле: mя =mn Nn + mp Np (1.1) то она окажется меньше массы её составляющих на какую- то величину. Разница между массой ядра расчетной и массой ядра фактической называется дефектом массы: Dm = mрасч – mфакт (1.2) Дефект массы показывает, насколько прочно связаны частицы в ядре, а также сколько энергии выделилось при образовании ядра из отдельных нуклонов. Этот расчёт можно произвести на основании уравнения Эйнштейна: E = mc2 (1.3) Любому изменению массы соответствует эквивалентное изменение энергии. Средняя энергия связи, приходящаяся на один нуклон, называется удельной энергией связи. Например, энергия ядра дейтерия составляет Радиоактивность – это свойство ядер определённых элементов самопроизвольно (т.е. без каких-то внешних воздействий) превращаться в ядра других элементов с испусканием особого рода излучения, называемого радиоактивным распадом. Самопроизвольный распад ядра изображен на рис. 6.
Рис. 6. Схема деления ядра.
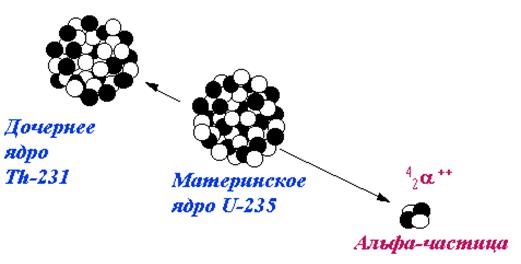
Радиоактивность является исключительно свойством атомного ядра и зависит только от его внутреннего состояния. На скорость течения радиоактивных превращений не оказывают влияния изменения температуры и давления, наличие электрического и магнитного полей, вид химического соединения данного радиоактивного элемента и его агрегатное состояние. Типы ядерных превращений Если в ядре слишком много протонов или нейтронов, то такие ядра не устойчивы и претерпевают самопроизвольные превращения, в результате которых изменяется состав ядра, и, следовательно, ядро атома одного элемента превращается в ядро другого элемента. При этом процессе ядра, испускают радиоактивные излучения. Существуют следующие виды ядерных превращений: альфа-распад, бета-распад (электронный и позитронный), электронный захват, внутренняя конверсия. Альфа-распад – состоит в самопроизвольном превращении ядра с испусканием α-частицы (см. рис. 7).
Рис. 7. Схема образования альфа-излучения.
В общем виде альфа-распад представляется таким образом: где X и Υ – символы соответственно материнского и дочернего ядер. ® + (1.4)
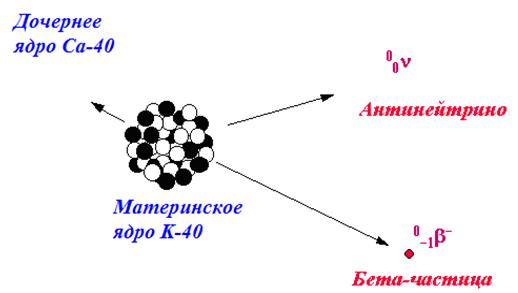
Бета-распад – заключается во внутриядерном взаимном превращении нейтрона и протона. Если в ядре имеется излишек нейтронов, то происходит электронный распад, при котором один из нейтронов превращается в протон, а ядро испускается электрон и антинейтрино (cм. рис. 8).
Рис. 8. Схема образования бета-излучения.
При этом распаде заряд ядра и соответственно атомный номер элемента увеличивается на единицу.
® + β + ν–, (1.5) где ν– – антинейтрино, а b – электрон. При позитронном распаде ядро испускает частицу такой же массы, как и электрон, но имеющую заряд +1, и нейтрино, а один из протонов превращается в нейтрон:
® + β+ + ν, (1.6) где ν – нейтрино, b+ – позитрон. Позитрон, вылетев из ядра, срывает с оболочки атома «лишний» электрон или взаимодействует со свободным электроном, образую пару «позитрон-электрон», которая мгновенно превращается в два гамма-кванта с энергией, эквивалентной массе частицы (e+ + e–). Процесс превращения пары «электрон-позитрон» в два гамма-кванта получил название аннигиляции. Т.о. при позитронном распаде в конечном итоге за пределы ядра вылетают не две частицы, а два гамма-кванта, каждый из которых обладает энергией, равной 0,511МэВ.
Электронный захват – один из протонов ядра забирает электрон с одной из оболочек атома, чаще всего с ближайшего к нему слоя и превращается в нейтрон. Схема электронного захвата:
+ β ® + ν (1.7)
Освободившееся место заполняется электроном из более отдалённых от ядра слоёв оболочки атома. Избыток энергии испускается атомом в виде характеристического рентгеновского излучения. Взависимости от того, с какой внутренней оболочки захватывается электрон, иногда различают К-захват, L-захват и т.д. Внутренняя конверсия – переход возбуждённого ядра в состояние с меньшей энергией может происходить путём внутренней конверсии, или конверсии с образованием электронно-позитронных пар. Ядро передаёт энергию возбуждения одному из электронов внутренних слоёв, который в результате этого удаляется за пределы атома. Такие электроны получили название электронов внутренней конверсии.
|
|||||||||||
|
Последнее изменение этой страницы: 2017-02-08; просмотров: 951; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.225.255.134 (0.018 с.) |


 . Порядковый номер иногда опускают.
. Порядковый номер иногда опускают. Атомы элементов с одинаковым массовым числом, но ядра которых находятся в различном энергетическом состоянии, называют изомерами. Они обладают разным периодом полураспада, энергией и видом излучения. Про изомер с избытком энергии говорят, что он находиться в метастабильном состоянии. Символически такое состояние обозначаю латинской буквой «m», поставленной рядом с массовым числом (80mBr). Отдавая излишек энергии, метастабильный изомер переходит в основное состояние.
Атомы элементов с одинаковым массовым числом, но ядра которых находятся в различном энергетическом состоянии, называют изомерами. Они обладают разным периодом полураспада, энергией и видом излучения. Про изомер с избытком энергии говорят, что он находиться в метастабильном состоянии. Символически такое состояние обозначаю латинской буквой «m», поставленной рядом с массовым числом (80mBr). Отдавая излишек энергии, метастабильный изомер переходит в основное состояние.