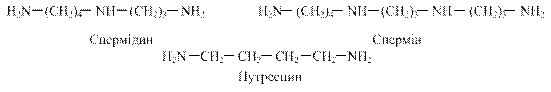Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Обмін сірковмісних амінокислот.
6.4.2.1. Обмін цистеїну та цистину. Обмін цистеїну може відбуватися кількома шляхами. Окиснюючись, цистеїн перетворюється на цистеїнову кислоту: при цьому сірка з двовалентної перетворюється на шестивалентну. Проміжними продуктами окиснення виступають цистеїнсульфенова і цистеїнсульфінова кислоти (рис. 6.10).
Рис. 6.10. Схема обміну цистеїну та цистину Цистеїнсульфінова кислота в реакції трансамінування з α-кетоглутаратом може перетворюватись на β-сульфінілпіруват, а потім на піруват. Остання використовується для біосинтезу глікогену або піддається окиснювальному декарбоксилуванню до ацетил-КоА, який, в свою чергу, обмінюється в циклі трикарбонових кислот до Н2О і СО2 або включається в біосинтез вищих жирних кислот, стероїдних гормонів та інших речовин. Цистеїнова та цистеїнсульфінова кислоти в печінці декарбоксилуються, перетворюються на таурин, який, поряд із гліцином, використовується в організмі для утворення кон'югованих форм жовчних кислот — глікохолевої та таурохолевої. Таурин знижує рівень холестерину в крові при атеросклерозі, підвищує синтез жовчних кислот в печінці. Його можна застосувати з лікувальною метою при захворюваннях серця, печінки при атеросклерозі, алкогольних інтоксикаціях і хімічних отруєннях. Він також виявляє протипроменеву лікувальну дію, сприяючи нормалізації обміну речовин. Таким чином, обмін цистеїну виступає одним із ланцюгів взаємозв’язку обміну білків з обміном вуглеводів і ліпідів. 6.4.2.2. Обмін метіоніну. Метіонін — незамінна амінокислота, що бере участь у внутрішньоклітинному метаболізмі і є донором метильної (–СН3) групи в численних реакціях метилування. Метіонін синтезується в організмі з амінокислоти гомоцистеїну: донором метильної групи в цій реакції є N5–метилтетрагідрофолат:
Фермент, що каталізує цю реакцію — гомоцистеїнметилтрансфераза; коензимом в цій реакції (проміжним переносником метильної групи) є коферментна форма вітаміну В12 — метилкобаламін. Біохімічно активною формою метіоніну, тобто безпосереднім донором СН3- групи в реакціях трансметилування, є S-аденозилметионін, який синтезується в організмі людини з метіоніну при дії ферменту метіонінаденозилтрансферази за участі АТФ:
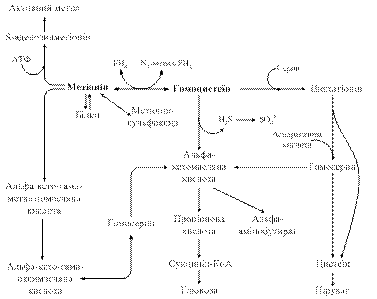
Перенесення метильної групи метіоніну на різні субстрати обумовлює утворення багатьох біологічно активних сполук. Метіонін виступає джерелом метильних груп креатинфосфату — важливої макроергічної сполуки м’язів, гормону мозкової речовини наднирників — адреналіну, кінцевого продукту обміну нікотинової кислоти — N-метилнікотинаміду, гормону епіфізу — мелатоніну і ряду інших сполук. Метіонін є також донором метильних груп для азотистих основ деяких нуклеотидів, зокрема тиміну. Віддавши метильну групу, метіонін перетворюється в гомоцистеїн, а останній може бути донором сірки для синтезу цистеїну і цистину. S-аденозилметіонін, що втрачає активну метильну групу в реакціях метилування біомолекул, перетворюється на S-адинозилгомоцистеїн, а далі на гомоцистеїн і знову на метіонін. Оскільки відбувається втрата метіоніну в карболітичних реакціях (через утворення сукциніл-КоА), функціонування цього циклу активного метилу (рис. 6.11) залежить від постійного надходження метіоніну як незамінної амінокислоти з їжею.
Рис.6.11. Цикл активного метилу
При конденсації гомоцистеїну з серином утворюється цистатіонін, який гідролізується на гомосерин і цистеїн. В організмі людини гомоцистеїн синтезуватися не може, внаслідок цього не може утворюватися і метіонін, оскільки гомоцистеїн перетворюється в метіонін за рахунок приєднання метильної групи (рис. 6.12).
Рис.6.13. Схема обміну метіоніну та гомоцистеїну
Окиснюючись, гомоцистеїн перетворюється на гомоцистин або гомоцистеїнову кислоту. Втрачаючи сірку і дезамінуючись, гомоцистин перетворюється в кетомасляну кислоту; при цьому утворюється сірководень і аміак. Сірководень далі окиснюється до сульфатної кислоти, аміак використовується для синтезу сечовини або включається в інші реакції. Крім цього, гомоцистеїн може знову метилюватися з утворенням метіоніну. При дезамінуванні шляхом переамінування з a-кетаглутаровою кислотою метіонін перетворюється в метилтіомасляну кислоту, з якої може утворюватися метилмеркаптан (СН3-SН). В підвищених кількостях метилмеркаптан утворюється і виділяється зсечею та видихається з повітрям при деяких захворюваннях печінки.
Дослідами з метіоніном, міченим за вуглецем СН3-групи, встановлено, що частина його метильних груп окиснюється до СО2 і Н2О. 6.4.2.3. Глутатіон – синтез і біологічні функції. Глутатіон — трипептид g–глутамініл–цистеїніл–гліцин, що в своєму складі містить вільну сульфгідрильну групу.
У першій реакції за участі γ-глутамілцистеїнсинтетази, іонів магнію і калію глутамату утворюється γ-глутамілцистеїн. Друга реакція відбувається за участі ферменту глутатіонсинтетази амінокислоти гліцину, іонів магнію і АТФ.
Глутатіон може перетворюватися з відновленої (Г–SН) на окиснену (Г–S–S–Г) форму, відіграючи роль буфера SН–груп. Його біохімічна функція в організмі пов'язана з відновленням і детоксикацією органічних пероксидів — похідних пероксиду водню, у молекулі якого один (гідропероксиди, R-O-O-H) або обидва атоми водню (алкіл пероксиди, R-O-O-R) заміщені на алкільні радикали: Гідроксиди та алкілпероксиди утворюються внаслідок діоксигеназних реакцій безпосереднього включення атома кисню в біомолекули, внаслідок вільнорадикальних реакцій, субстратом яких є ненасичені жирні кислоти мембранних фосфоліпідів. Активація цих процесів спостерігається при дії на організм іонізуючої радіації, чужорідних сполук – ксенобіотиків. До сполук, що протидіють цим процесам, крім глутатіону, відносять вітамін Е, аскорбінову кислоту, урати, каротини. При взаємодії глутатіону з гідропероксидом утворюються нешкідливі органічні спирти, які підлягають подальшому окисненню:
Реакція каталізується ферментом глутатіонпероксидазою, яка містить в активному центрі атом селену (Sе). Цей ензим присутній у всіх органах і тканинах людини.
Наявність в організмі двох форм глутатіону відновленої та окисненої створює найважливішу редокс-систему, яка захищає його від токсичної дії різноманітних пероксидів, у тому числі і від пероксиду водню. Найактивніше цей процес відбувається в еритроцитах. Внутрішньоклітинна концентрація відновленого глутатіону в ссавців знаходиться в межах 0,5 – 10 ммоль, тоді як для плазми (сироватки) крові характерна мкмолярна концентрація. Відновлювальний цикл глутатіону відіграє роль і в інших метаболічних і фізіологічних функціях: синтезі і розпаді білків, активації та інактивації ферментів, відновленні цистину і дегідроаскорбінової кислоти, стабілізації клітинної мембрани.
Відновлений глутатіон є головним джерелом відновлених еквівалентів для регуляції окиснювального статусу всередині клітини. Аскорбінова кислота є другим за значенням цитозольним відновником. Її окиснення призводить до утворення дегідроаскорбінової кислоти, яка є сильним цитотоксином. Ферментативне її відновлення глутатіонаскорбатредуктазою до аскорбінової кислоти відбувається за участі відновленого глутатіону.
Відновлений глутатіон є субстратом глутатіонредуктази, глутатіонпероксидази, глутатіонтрансферази. Непряма участь відновленого глутатіону в ферментативному каталізі зумовлена підтриманням у відновленому стані сульфгідрильних груп цих ферментів. Відновлений глутатіон реагує з багатьма ксенобіотиками з утворенням глутатіонових кон'югатів. Процес відбувається в декілька етапів. Перший етап глутатіонової кон'югації відбувається в печінці, наступні – в нирках. Швидкість утворення глутатіонових кон'югатів визначається активністю глутатіотрансферази і залежить від рівня в організмі відновленого глутатіону. Глутатіотрансферази виявлені у всіх клітинах організму, в основному, в їх цитозолі та в незначних кількостях – у мікросомах і мітохондріях. Глутатіонова кон'югація пов'язана не тільки з детоксикацією ксенобіотиків, але й з ендогенними метаболітами, які мають електрофільні центри. Виявлена глутатіонова кон'югація естрадіолу, простагландинів, лейкотрієнів, білірубіну, етанолу. Під дією радіації спостерігається окиснення тіолових груп клітин, зниження рівня внутрішноьклітинної концентрації відновленого глутатіону. Радіоактивність клітин організму залежить, в першу чергу, від рівня відновленого глутатіону. Стимулюючи біосинтез відновленого глутатіону лікарськими речовинами або використовуючи екзогенний глутатіон, можна викликати захист клітин від іонізуючого опромінення. При порушенні обміну глутатіону, дефіциті активності глутатіонредуктази чи глутатіонпероксидази порушується відновлений потенціл еритроцита і знешкодження пероосидів. Утворені при окисненні гемоглобіну його деривати формують гранули, відомі під назвою тілець Гейца, що в подальшому призводить до підвищення проникності мембрани еритроцита, яке спричинює зростання кількості іонів натрію і води в еритроциті та його гемоліз. Еритроцитарні ензимопатії, які повязані з обміном глутатіону, утворюють загальну групу близьких за клінічною картиною захворювань, головним чином, хронічну несфероцитарну гемолітичну анемію та гостру гемолітичну медикаментозну анемію.
6.4.2.4. Синтез і біологічна роль креатину. Креатин — азотиста сполука, яка у вигляді креатинфосфату має важливе значення в енергозабезпеченні функції м'язів. Біосинтез креатину відбувається за участю амінокислот гліцину, аргініну та метіоніну. Процес синтезу складається з двох стадій: 1-ша стадія відбувається в нирках і полягає в утворенні глікоціаміну (гуанідинацетату) із аргініну та гліцину (каталізує реакцію фермент гліцинамідинотрансфераза).
2-а стадія відбувається в печінці, куди глікоціамін надходить з плином крові, і полягає в метилуванні глікоціаміну до креатину за участю S-аденозилметіоніну (каталізує реакцію фермент гуанідинацетатметилтрансфераза) (рис. 6.16):
У формі креатиніну з організму людини виділяється із сечею значна частина азоту амінокислот; у здорової людини виділення креатиніну пропорційне масі м'язової тканини і значно збільшується за умов травматичних пошкоджень м'язів. У плазмі крові в невеликих кількостях міститься креатин і креатинін (50 – 80 мкмоль/л). У печінці, нирках, підшлунковій залозі, які синтезують креатин, вміст його невеликий (0,1 – 0,4 г/кг). Найбільша його кількість - у скелетних м' язах (25 – 55 г/кг), у серці (15 – 30 г/кг), у тканині головного мозку (10 – 15 г/кг). З сечею виділяється креатин тільки у дітей, у дорослих екскретується з сечею креатинін (за добу біля 4,4 – 17,6 ммоль), причому існує пряма залежність між розвитком мускулатури людини і виділенням креатиніну. Виділення з сечею креатину свідчить про патологію. Для багатьох форм патології м'язової тканини характерно порушення метаболізму креатину і його посилене виділення з сечею (креатинурія). Креатинурія у хворих з міопатією є результатом порушення у скелетних м'язах фіксації креатину та його фосфорилування. Якщо порушений процес синтезу креатинфосфату, то не утворюється і креатинін, вміст останнього у сечі різко знижується. У результаті креатинурії і порушення синтезу креатиніну різко зростає креатиніновий показник (креатин/креатинін у нормі становить 1,1) сечі.
(1) трансамінування до відповідних a-кетокислот з розгалуженим ланцюгом; реакція каталізується амінотрансферазою, яка може трансамінувати будь-яку з розгалужених амінокислот;
(2) окиснювальне декарбоксилування з утворенням ацил-КоА-тіоефірів; реакція каталізується мультиферментним комплексом мітохондрій дегідрогеназою розгалужених a–кетокислот; дегідрогеназний комплекс за структурою та молекулярними механізмами каталітичної дії є аналогічним мітохондріальним дегідрогеназам піровиноградної та a–кетоглутарової кислот; (3) дегідрогенування з утворенням a,b–ненасичених тіоефірів ацил-КоА; реакція каталізується ферментом (або ферментами), подібними до ФАД-залежної ацил-КоА дегідрогенази лінійних жирних кислот. Участь коферментних форм вітаміну Н і В12 у метаболізмі амінокислот. А мінокислоти валін, ізолейцин та метіонін включаються в цикл Кребса через проміжний метаболіт - сукциніл-КоА, попередником якого є пропіоніл-КоА:
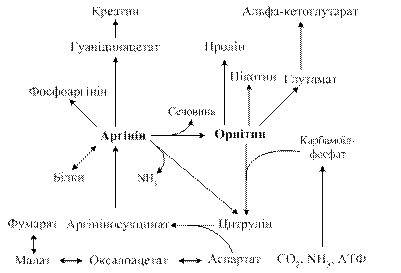
Першу реакцію каталізує пропіоніл- КоА-карбоксилаза – вітамін Н-залежний фермент, подібно до дії карбоксилаз в реакціях утворення малоніл-КоА (з СО2 та ацетил-КоА) та оксалоацетату (з пірувату). Друга реакція відбувається за участі ферменту метилмалоніл-КоА-мутази, коферментом якого є дезоксіаденозилкобаламін (коферментна форма вітаміну В12). Вітамін В12 утворює дві коферментні форми: метилкобаламін та дезоксіаденозилкобаламін, що беруть участь у двох ферментних реакціях: 1) метилуванні гомоцистеїну з утворенням метіоніну – кофермент метилкобаламін як перенощик метильної групи в реакції метіоніну з N5-метил- Н4 –фолатом. 2) ізомеризації метил-малоніл-КоА до сукциніл-КоА з участю дезоксіаденозилкобаламіну як коферменту метилмалоніл-КоА-мутази, механізм реакції полягає у внутрішньомолекулярному обміні хімічних груп біля двох сусідніх атомів вуглецю. Хвороба кленового сиропу (лейциноз) — спадкова ензимопатія метаболізму амінокислот із розгалуженим ланцюгом. Захворювання спричинюється дефектом гена, який контролює синтез дегідрогенази розгалужених a–кетокислот. У зв'язку з блоком ферментної реакції (2) окиснювального декарбоксилування лейцину, валіну та ізолейцину ці амінокислоти та відповідні їм a–кетокислоти накопичуються в крові та внутрішніх органах хворих (інша назва ензимопатії — кетоацидурія кислот із розгалуженим ланцюгом); сеча хворих має специфічний запах кленового сиропу (maple syrup urine disease). Якщо хвора дитина з раннього віку не буде переведена на спеціальну дієту з низьким вмістом розгалужених амінокислот, патологія призводить до затримки загального розвитку, важких психічних порушень. 6.4.4. Обмін аргініну, біологічна роль оксиду азоту, NO-синтаз. Аргінін належить до діаміномонокарбонових кислот і разом із лізином слугує структурним елементом ядерних білків пістонів і протамінів, тобто білків хроматину ядер клітин. Він синтезується з орнітину, але у молодому віці у недостатній кількості, тому його вважають лише частково замінною амінокислотою (рис.6.18).
Рис. 6.18. Схема метаболізму аргініну Гідроліз аргініну під дією аргінази дає орнітин і сечовину. При генетичному дефекті аргінази мають місце аргінінемія, порушення розумового розвитку. Орнітин в організмі перетворюється на глутамінову кислоту, яка може включатися в процеси трансамінування і дезамінування, перетворюватись на α-кетоглутарову кислоту з подальшим окисненням до СО2 і Н2О. З нього синтезуються спермідин і спермін. Реакція проходить під дією орнітиндекарбоксилази в присутності піридоксальфосфату. Спермін, спермідин і путресцин виявлені в ядрах клітин всіх органів людини.
За рахунок позитивного заряду вони зв'язуються з від'ємно зарядженими молекулами ДНК і РНК, входять до складу хроматину, беруть участь у реплікації ДНК, стимулюють транскрипцію і трансляцію. Іх концентрація зростає при проліферації тканин. Аргінін необхідний також для синтезу важливого субстрату м’язів — креатину, причому цей процес незворотний. При введенні тваринам креатину, міченого по азоту, останній в молекулі аргініну не виявляється. В останні роки значну увагу привернула метаболічна роль аргініну як попередника в генерації оксиду азоту (NО) — короткоживучої молекули, яка виконує функцію внутрішньоклітинного месенджера сигналів фізіологічно активних сполук. Утворення оксиду азоту відбувається у всіх клітинах і тканинах організму з аргініну за участі складної Са2+-залежної NO–синтази (NOS):
Ідентифіковано три ізоформи NO–синтази, які названі за типом клітин, де вони були вперше виявлені: NOS-1 — нейрональна або мозкова, NOS-2 — макрофагальна або конститутивна, NOS-3 — ендотеліальна ізоформа. Оксид азоту – важлива сигнальна молекула, здатна активувати гемвмісну розчинну гуанілатциклазу, що каталізує утворення цГМФ, який, в свою чергу, стимулює протеїнкінази певних ферментів та інактивується специфічною фосфодіестеразою. Він також активує АДФ-рибозилтрансферазу, утворює пероксинітрит-цитотоксичний агент, може нітрувати залишки тирозину в білках. Біологічна роль NO в організмі реалізується шляхом його участі в модуляції таких фізіологічних функцій, як регуляція тонусу гладких м'язів, зокрема вазодилятація, імунні процеси, зменшує силу серцевих скорочень, виступає внутрішньоклітинним месенджером для нейронів мозку, впливає на синтез шаперонів, гальмує агрегацію тромбоцитів, проявляє антиканцерогенну активність. Оксид азоту може зв'язуватися з іонами заліза гемових та негемових ферментів, а також з іонами міді у складі ферментів, що призводить до порушення їх активності. Оксид азоту може окиснюватися в нітрити, які утворюють мутагенні N-нітрозаміни.
|
|||||||||
|
Последнее изменение этой страницы: 2017-02-17; просмотров: 407; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.223.32.230 (0.032 с.) |

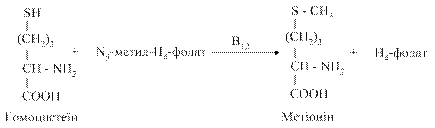


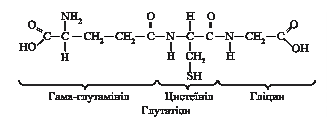 Синтез глутатіону відбувається в цитоплазмі кожної клітини, хоча головним постачальником для організму людини є печінка. Цей процес включає дві реакції і вимагає трьох амінокислот (глутамату, цистеїну і гліцину), двох ферментів, іонів магнію та калію, а також енергії у вигляді АТФ (рис. 6.14)
Синтез глутатіону відбувається в цитоплазмі кожної клітини, хоча головним постачальником для організму людини є печінка. Цей процес включає дві реакції і вимагає трьох амінокислот (глутамату, цистеїну і гліцину), двох ферментів, іонів магнію та калію, а також енергії у вигляді АТФ (рис. 6.14) В органах, тканинах і біологічних рідинах глутатіон знаходиться у двох формах: відновленій та окисненій. Приблизно 97-99 % загального глутатіону припадає на його відновлену форму.
В органах, тканинах і біологічних рідинах глутатіон знаходиться у двох формах: відновленій та окисненій. Приблизно 97-99 % загального глутатіону припадає на його відновлену форму.
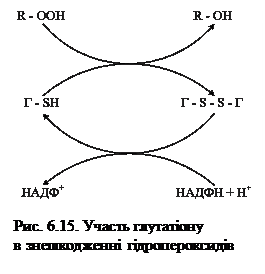 Зворотне відновлення Г–S–S–Г до Г–SН каталізується НАДФН–залежною глутатіонpедуктазою. Цей процес спряжений з окисненням глюкозо–6–фосфату та 6–фосфоглюконату в пентозофосфатному циклі, що, в свою чергу, забезпечує утворення НАДФН, необхідного для відновлення окисненого глутатіону вказаним ферментом.. Весь процес – це так званий відновлювальний цикл глутатіону (рис. 6.15)
Зворотне відновлення Г–S–S–Г до Г–SН каталізується НАДФН–залежною глутатіонpедуктазою. Цей процес спряжений з окисненням глюкозо–6–фосфату та 6–фосфоглюконату в пентозофосфатному циклі, що, в свою чергу, забезпечує утворення НАДФН, необхідного для відновлення окисненого глутатіону вказаним ферментом.. Весь процес – це так званий відновлювальний цикл глутатіону (рис. 6.15)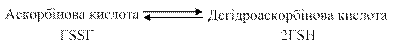

 Фосфорилування креатину при дії креатинфосфокінази генерує креатинфосфат — джерело термінової регенерації АТФ при м'язовому скороченні. Незворотня неферментативна дегідратація і дефосфорилювання креатинфосфату призводить до утворення ангідриду креатину — креатиніну.
Фосфорилування креатину при дії креатинфосфокінази генерує креатинфосфат — джерело термінової регенерації АТФ при м'язовому скороченні. Незворотня неферментативна дегідратація і дефосфорилювання креатинфосфату призводить до утворення ангідриду креатину — креатиніну. 6.4.3. Обмін амінокислот з розгалуженими ланцюгами. Відповідно до структурної подібності амінокислот валіну, лейцину та ізолейцину, перші етапи їх катаболізму відбуваються за подібними шляхами і мають спільні механізми. Як випливає зі схеми на рис. 6.17, загальними реакціями для перетворення амінокислот з розгалуженими ланцюгами є:
6.4.3. Обмін амінокислот з розгалуженими ланцюгами. Відповідно до структурної подібності амінокислот валіну, лейцину та ізолейцину, перші етапи їх катаболізму відбуваються за подібними шляхами і мають спільні механізми. Як випливає зі схеми на рис. 6.17, загальними реакціями для перетворення амінокислот з розгалуженими ланцюгами є: