Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Біологічні функції білків і пептидів, їх хімічна будоваСтр 1 из 8Следующая ⇒
РОЗДІЛ 6. ОБМІН АМІНОКИСЛОТ Основою структури всіх живих організмів є білки. Білки — високомолекулярні органічні речовини, молекули яких побудовані із залишків амінокислот. Назва протеїни (від грец. protos — перший, найважливіший), очевидно, найбільш точно відображає першочергове біологічне значення цього класу речовин. Вони зустрічаються в усіх живих організмах і є основою їх життєдіяльності. Добова потреба в білках для дорослої людини і дітей неоднакова, що пов'язано з фізіологічними особливостями функціонування їх організмів. Для дорослої людини поступлення в організм за добу 1,5–2 г білків на 1кг маси вважається нормою, тоді як для дітей потрібно 5–6 г. В останні роки значну увагу привернула метаболічна роль аргініну як попередника в генерації оксиду азоту (NО) — короткоживучої молекули, яка виконує функцію внутрішньоклітинного месенджера сигналів фізіологічно активних сполук. Утворення оксиду азоту відбувається у всіх клітинах і тканинах організму з аргініну за участі складної Са2+-залежної NO–синтази (NOS):
Ідентифіковано три ізоформи NO–синтази, які названі за типом клітин, де вони були вперше виявлені: NOS-1 — нейрональна або мозкова, NOS-2 — макрофагальна або конститутивна, NOS-3 — ендотеліальна ізоформа. Оксид азоту – важлива сигнальна молекула, здатна активувати гемвмісну розчинну гуанілатциклазу, що каталізує утворення цГМФ, який, в свою чергу, стимулює протеїнкінази певних ферментів та інактивується специфічною фосфодіестеразою. Він також активує АДФ-рибозилтрансферазу, утворює пероксинітрит-цитотоксичний агент, може нітрувати залишки тирозину в білках. Біологічна роль NO в організмі реалізується шляхом його участі в модуляції таких фізіологічних функцій, як регуляція тонусу гладких м'язів, зокрема вазодилятація, імунні процеси, зменшує силу серцевих скорочень, виступає внутрішньоклітинним месенджером для нейронів мозку, впливає на синтез шаперонів, гальмує агрегацію тромбоцитів, проявляє антиканцерогенну активність. Оксид азоту може зв'язуватися з іонами заліза гемових та негемових ферментів, а також з іонами міді у складі ферментів, що призводить до порушення їх активності. Оксид азоту може окиснюватися в нітрити, які утворюють мутагенні N-нітрозаміни.
Патологія білкового обміну Одним з порушень азотистого обміну є білкова недостатність, яка є наслідком не тільки дефіциту білків, але й деяких важких захворювань навіть при достатньому надходженні білка з їжею. Білкова недостатність у людини розвивається як при повному і частковому голодуванні, так і при вживанні одноманітного білкового харчування, коли в дієті переважають білки рослинного походження, біологічна цінність яких нижча, ніж білків тваринного походження. У результаті цього розвивається негативний азотистий баланс, гіпопротеїнемія і порушується колоїдно-осмотичний і водно-сольовий обмін (розвиток набряків). При тяжких формах харчових дистрофій (наприклад, квашіоркорі) спостерігають глибокі ураження печінки, зупинку росту, різке зниження опірності організму до інфекцій, набряки, атонію м'язів. Хвороба часто закінчується летально. Одним із проявів патології азотистого обміну є аміноацидурія – виділення у великій кількості амінокислот із сечею. Гіпераміноацидурію поділяють на ниркову і позаниркову, пов'язану із збільшенням концентрації всіх або окремих амінокислот у крові. Так, при хронічних нефритах із сечею виділяється більше проліну, лізину, аргініну і цитруліну (ниркова аміноацидурія). Причиною цього є порушення зворотного всмоктування окремих амінокислот. Ниркова аміноацидурія буває спадковою і набутою (у результаті дії на епітеліальні клітини нирок різних отрут). Цистинурія – спадкова ниркова аміноацидурія: метаболічний дефект супроводжується виведенням з сечею у 50 разів вище норми 4 амінокислот: цистеїну, лізину, аргініну й орнітину. Хворі цією патологією мають підвищений ризик утворення каменів у сечовивідних шляхах. При спадковій хворобі Вільсона – Коновалова (гепатоцеребральній дистрофії) поряд із загальною гіпераміноацидурією простежується зниження вмісту мідьвмісного білка – церулоплазміну в сироватці крові і відкладання міді в головному мозку, печінці, нирках. Генетичний дефект пов'язаний з порушенням синтезу церулоплазміну. Цистиноз – порушення реабсорбції майже всіх амінокислот (за винятком циклічних) у ниркових канальцях. Наслідком цього є збільшення у 5 – 10 разів екскреції амінокислот, у 20 - 30 разів – цистину і цистеїну і відкладання цистину в ретикулярних клітинах кісткового мозку, селезінки, печінки, клітинах рогівки ока. При цистинозі ниркові камені майже не утворюються.
РОЗДІЛ 6. ОБМІН АМІНОКИСЛОТ Основою структури всіх живих організмів є білки. Білки — високомолекулярні органічні речовини, молекули яких побудовані із залишків амінокислот. Назва протеїни (від грец. protos — перший, найважливіший), очевидно, найбільш точно відображає першочергове біологічне значення цього класу речовин. Вони зустрічаються в усіх живих організмах і є основою їх життєдіяльності. Добова потреба в білках для дорослої людини і дітей неоднакова, що пов'язано з фізіологічними особливостями функціонування їх організмів. Для дорослої людини поступлення в організм за добу 1,5–2 г білків на 1кг маси вважається нормою, тоді як для дітей потрібно 5–6 г. Біологічні функції білків і пептидів, їх хімічна будова В організмі білки виконують різні функції, серед яких найважливішими є: Структурна — 18 – 21 % загальної сирої маси, та 45 – 50 % сухої маси організму людини і тварин становлять білки; вони беруть участь в утворенні структурної основи клітин та їх органел, формуванні покривних, сполучних тканин тощо; Каталітична — понад 2000 білків ферментативноактивні. Всі ферменти є білками. В порівнянні з іншими каталізаторами вони характеризуються високою ефективністю і найбільш тонкою вибірковістю cубстратною специфічністю; Рецепторна — за участю білків здійснюється передача та прийняття сигналів поверхнею клітин, забезпечується міжклітинна взаємодія; Транспортна — за допомогою білків забезпечується активний транспорт речовин та іонів крізь клітинні мембрани та між органами й тканинами організму; транспорт фармакологічних препаратів; Захисна — білкову природу мають антитіла та імуноглобуліни, що забезпечують імунні реакції організму; процеси зсідання крові (фібриноген, тромбін тощо). Завдяки багаточисленних функціональних груп білки можуть зв’язувати токсичні сполуки (важкі метали, алкалоїди, токсини) і знешкоджувати їх; Механохімічна або скоротлива — за допомогою білків забезпечується рух, скорочення, розслаблення м'язів, робота внутрішніх органів: в цьому числі екскурсія легень, робота серця, рух сперматозоїдів та інші; Субстратно-енергетична — за допомогою білків організм одержує 10 – 15 % енергії, цю функцію виконують резервні білки; Регуляторна — обмін речовин в організмі регулюється різними гормонами білкової природи. Деякі білки відіграють роль інгібіторів активності ферментів і таким шляхом регулюють їх дію. Відома група білків-регуляторів генома. Когенетична функція виконується складними білками — нуклеопротеїдами. Білки не є генетичним матеріалом, але допомагають нуклеїновим кислотам реалізувати здатність до відтворення і перенесення інформації. До важливих функцій білків відносять також їх здатність підтримувати онкотичний тиск в клітинах і крові; буферні властивості, що підтримують гомеостатичне значення рН внутрішнього середовища, тощо. Високу специфічність дії мають також білки, які становлять молекулярну основу таких процесів, як диференціювання і поділ клітин, розвиток живих організмів, що забезпечує їх біологічну індивідуальність. Маючи високу хімічну спорідненість, прості білки-протеїни можуть з'єднуватися з різними органічними сполуками, в результаті цього утворюються - складні білки — протеїди. Саме такі складні білки є основою будови клітин і субцелюлярних структур. Наприклад, хроматин ядра складається основним чином із нуклеопротеїдів, у склад яких входить ДНК. Рибосоми складаються із нуклеопротеїдів, у склад яких входить РНК, а біологічні мембрани містять ліпопротеїди. Сполучна тканина характеризується високим вмістом глікопротеїдів.
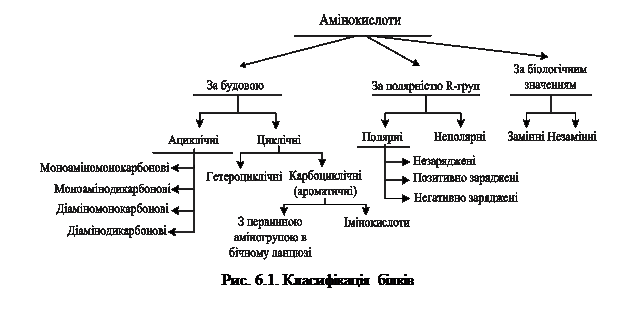
Більшість білків добре розчинні у воді. Однак деякі органічні речовини, виділені із хрящів, волосся, нігтів, рогів, кісткової тканини — нерозчинні в воді — також були віднесені до білків, оскільки за своїм хімічним складом виявилися близькими до білків м'язової тканини, сироватки крові. Для вивчення хімічного складу, будови і властивостей білків їх виділяють із тканин або органів, наприклад, із сироватки крові, молока, м'язів, печінки, шкіри, волосся, шерсті. У результаті досліджень встановлено, що до складу білків входять такі елементи (%): вуглець 50-55, водень - 6,5-7,3, азот - 15-17, кисень 21-23, сірка - 0,3-2,5. У складі білків виявлено також фосфор, залізо, марганець, магній, йод та інші. Оскільки в складі білків стабільним є вміст азоту (16%), то за його кількістю можна визначити вміст білків у тканинах і рідинах організму. Для цього отриману в результаті аналізу кількість азоту множать на коефіцієнт перерахунку (6,25), який одержують, виходячи з того, що масова частка азоту в більшості білків становить 16%; 100:16 = 6,25, тобто 6,25 - маса білка, що відповідає 1г азоту. При повному кислотному, лужному або ферментативному гідролізі білків утворюються вільні амінокислоти. Їх класифікують в залежності від ознаки, яка лежить в основі їх поділу на групи. Прийнято три класифікації амінокислот: структурна – за будовою бічного радикала, електрохімічна – за кислотно-основними властивостями амінокислот, біологічна – за ступенем незамінності амінокислот для організму (рис. 6.1).
Вiдомо, що в природi зустрiчається приблизно 300 амiнокислот. Багато з них характерні лише для певних органiзмів. Повний амiнокислотний склад бiлкiв був розшифрований в 30-х роках ХХ ст. Велика заслуга в цьому належить роботам М.Любавiна, який у 1871 роцi встановив, що пiд дiєю ферментiв травних сокiв бiлки розщеплються на амінокислоти, на підставі чого було зроблено два важливих висновки:
1) у склад бiлкiв входять амiнокислоти; 2) методами гiдролiзу може бути вивчений хiмiчний, зокрема амiнокислотний склад бiлкiв. Хімічна структура і назви амінокислот представлені в таблиці 6.1. Таблиця 6.1. Класифікація амінокислот
Чим ближче амінокислотний склад білків їжі до амінокислотного складу білків організму, тим більша його біологічна цінність. Біологічна цінність білків тісно пов’язана із вмістом у них незамінних амінокислот. В організмі людини синтезується тільки 10 із 20 необхідних амінокислот. Вони можуть синтезуватись з продуктів обміну вуглеводів і ліпідів. Останні 10 амінокислот (лізин, лейцин, ізолейцин, треонін, фенілаланін, триптофан, метіонін, аргінін, гістидин, валін) не синтезуються в організмі, тому були названі есенціальними або незамінними.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-17; просмотров: 169; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.226.105 (0.014 с.) |