Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Я. Основы хлоридных методов производства металлов
Хлор обладает большим химическим сродством к металлам и при определенных условиях может вытеснить кислород из 746 оксидов с образованием хлоридов. Процесс значительно облегчается в присутствии углерода, так как в этом случае кислород соединяется с углеродом. Например, применительно к двухвалентному металлу возможны следующие процессы: 1) МеО + С12 = МеС12 + l/20a - Q,; 2) МеО + Cl2 + С = МеС12 + СО - Q2. При этом Q2 < Q, (по абсолютному значению), и даже в некоторых случаях процесс, протекающий по второй реакции, экзотермичен. Следует подчеркнуть, что и реакции первого типа протекают при более низких температурах, чем аналогичные реакции восстановления оксидов углеродом. Важным обстоятельством является то, что хлориды обычно образуются в газообразном состоянии, легко уводятся из процесса, а процесс производства карбидообразующих металлов хлорид-ным методом в отличие от восстановления углеродом обеспечивает получение малоуглеродистого продукта. В некоторых случаях хлориды находятся в недрах земли или в соленых водоемах. Из хлоридов металлы получают восстановлением или же электролизом из расплавов. ПРОИЗВОДСТВО МАГНИЯ Магний широко применяют в виде сплавов с алюминием, цинком и марганцем для изготовления деталей авиационных и автомобильных двигателей. Магниевые сплавы обладают хорошими литейными свойствами, что дает возможность получать из них сложные отливки. Сплавы легко поддаются свариванию и обработке резанием. Основными видами сырья для получения магния являются магнезит, доломит, карналлит и бишофит. Главной составляющей магнезита является MgCOa, а доломита СаСОэ ■ MgCOj. Карналлит — это природный хлорид магния и калия MgCl2 • КС1 • 6Н20. Бишофит (MgCl2 • 6Н20) получается при переработке карналлита или выпаривается из воды соленых озер и морей. Наиболее распространен в настоящее время электролитический способ получения магния, при этом магний в процессе электролиза получается из вводимого в электролит хлорида MgCI2. Технология получения магния этим способом включает три стадии: получение безводного хлорида магния MgCl2, электролиз с выделением из хлорида жидкого магния, рафинирование магния.
Применяют также термические способы получения магния с использованием в качестве восстановителя С, Si или СаС2. Из них проще силикотермический способ, при котором пользуются специальными ретортами из хромоникелевой жаропрочной стали, помещаемыми в электропечь, отапливаемую газообразным топливом. В качестве сырья лучше всего брать доломит MgC03 • СаСОэ, а в качестве восстановителя— кремний ферросилиция. Магний получается высокой чистоты. ПРОИЗВОДСТВО ТИТАНА Титан отличается высокой механической прочностью, коррозионной стойкостью, жаропрочностью (гпл = 1660 °С) и малой плотностью (4,51 г/см3). Его применяют как конструкционный материал в самолетостроении, а также при постройке сосудов, предназначенных для транспортирования концентрированной азотной и разбавленной серной кислот. Применяют также диоксид ТЮ2 для производства титановых белил и эмали. Наиболее распространенным сырьем для получения титана и диоксида титана служит ильменитовый концентрат, выделяемый при обогащении титаномагнетитовых железных руд, в котором содержится, %: 40-60 Ti02, ~30FeO, ~20Fe2O3 и 5—7 пустой породы (CaO, MgO, А12Оэ, SiOz), причем титан в виде минерала ильменита FeO • TiOz. Технологический процесс производства титана из ильме-нитового концентрата состоит из следующих основных стадий: получение титанового шлака восстановительной плавкой, получение тетрахлорида титана хлорированием титановых шлаков, получение титана (губки, порошка) восстановлением из тетрахлорида. Кроме того, зачастую проводят рафинирование полученного титана и иногда переплав для получения титана в виде слитков. Восстановительная плавка ильменитового концентрата имеет целью перевести ТЮ2 в шлак и отделить оксиды железа путем их восстановления. Плавку проводят в электродуговых печах. В, печь загружают концентрат и восстановитель (кокс, антрацит), их нагревают до ~ 1650 °С. Основной реакцией является: FeO • Ti02 + С = Fe + Ti02 + CO. Из восстановленного и науглероживающегося железа образуется чугун, а оксид титана переходит в шлак, который содержит 82—90% Ti02 (титановый шлак).
Получение тетрахлорида титана TiCl4 осуществляют воз сырьем при этом является титановый шлак. Хлорирование осуществляют в шахтных хлораторах непрерывного действия или в солевых хлораторах. Шахтный хлоратор — это футерованный цилиндр диаметром до 2 и высотой до 10 м, в который сверху загружают брикеты из измельченного титанового шлака и снизу вдувают газ магниевых электролизеров, содержащий 65—70 % С12. Взаимодействие Ti02 брикетов и хлора идет с выделением тепла, обеспечивающего необходимые для процесса температуры (~ 950 °С в зоне реагирования). Образующийся в хлораторе газообразный TiCl4 отводят через верх, остаток шлака от хлорирования непрерывно выгружают снизу. Солевой хлоратор представляет собой футерованную шамотом камеру, наполовину заполненную отработанным электролитом магниевых электролизеров, содержащим хлориды калия, натрия, магния и кальция. Сверху в расплав загружают измельченные титановый шлак и кокс, а снизу вдувают хлор. Температура 800—850 °С, необходимая для интенсивного протекания хлорирования титанового шлака в расплаве, обеспечивается за счет тепла протекающих экзотермических реакций хлорирования. Газообразный TiCl4 из верха хлоратора отводят на очистку от примесей, отработанный электролит периодически заменяют. Основное преимущество солевых хлораторов состоит в том, что не требуется дорогостоящее брикетирование шихты. Отводимый из хлораторов газообразный TiCl4 содержит пыль и примеси газов — СО, С02 и различные хлориды, поэтому его подвергают сложной, проводимой в несколько стадий очистке.
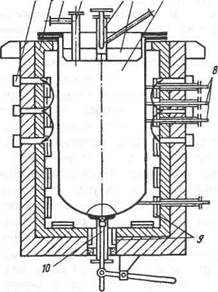
Металлатермическое восстановление титана из тетрахло-рида TiCl4 проводят магнием или натрием. Для восстановления магнием служат аппараты, представляющие собой (рис. 252) помещенную в печь герметичную реторту высотой 2—3 м из хромо-никелевой стали. После ввода в разогретую до ~ 750 °С реторту магния в нее подают тетрахлорид титана. Восстановление титана магнием TiCl4 + 2Mg = Ti + + 2MgCl2 идет с выделением тепла, поэтому электронагрев печи отключают и реторту обдувают воздухом, поддерживая температуру в пределах 800—900 °С; ее регулируют также скоростью подачи тетрахлорида титана. За один цикл восстановления длительностью 30—50 ч получают 1—4 т титана в виде губки (твердые частицы титана спекаются в пористую массу— губку). Жидкий MgCl2 из реторты периодически выпускают. Титановая губка впитывает много MgCl2 и магния, поэтому после окончания цикла восстановления проводят вакуумную отгонку примесей. Реторту после нагрева до ~ 1000 °С и создания в ней вакуума выдерживают в течение 35—50 ч; за это время примеси испаряются. Иногда отгонку примесей
12 3 4 5 S 7
Рис. 252. Аппарат для восстановления тетрахлорида магнием: 1 — коллектор для подачи и отвода воздуха; 2 — печь; 3 — штуцер для вакуумирования; 4 — патрубок для заливки магния; 5 — узел подачи тетрахлорида; б — крышка; 7 — реторта; 8 — термопары; 9 — нагреватель; 10 — устройство для слива
из губки проводят после ее извлечения из реторты. Восстановление натрием проводят в аппаратах, схожих с применяемыми для магниетермического восстановления. В реторте после подачи TiCl4 и жидкого натрия идет реакция восстановления титана: TiCl4 + 4Na = Ti + 4NaCl. Температура в 800—880 °С поддерживается за счет выделяющегося при восстановлении тепла. Полученную твердую массу, содержащую 17 % Ti и 83 % NaCl извлекают из реактора, измельчают и выщелачивают из нее NaCl водой, получая титановый порошок. Рафинирование титана. Для получения титана высокой чистоты применяют так называемый иодидный способ, при котором используется реакция Ti + 2I2 T=^ Til4. При температуре 100—200 °С реакция протекает в направлении образования Til4, а при температуре 1300—1400 °С— в обратном направлении. Титановую губку (порошок) загружают в специальную реторту, помещаемую в термостат, где температура должна быть на уровне 100—200 °С, и внутри нее спеиальным приспособлением разбивают ампулу с иодом. Через несколько натянутых в реторте титановых проволок пропускают ток, в результате чего они накаливаются до 1300—1400 °С. Пары иода реагируют с титаном губки по реакции Ti + + 212 —** Til4. Полученный Til4 разлагается на раскаленной титановой проволоке, образуя кристаллы чистого титана и освобождая иод: Til4 — *• Ti + 2I2. Пары иода вновь вступают во взаимодействие с рафинируемым титаном, а на проволоке постепенно наращивается слой кристаллизующегося чистого титана. Процесс заканчивают при толщине получаемого прутка титана 25—30 мм. Получаемый металл содержит 99,9—99,99 % Ti, в одном аппарате получают ~ 10 кг чистого титана в сутки. Получение титановых слитков. Для получения ковкого титана в виде слитков губку переплавляют в вакуумной дуговой печи. Расходуемый (плавящийся) электрод получают прессованием губки и титановых отходов. Жидкий титан затвердевает в печи в водоохлаждаемом кристаллизаторе.
|
||||||||
|
Последнее изменение этой страницы: 2017-02-17; просмотров: 194; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.143.0.157 (0.011 с.) |
 частиц электролита и шлама. Рафинирование возгонкой осуществляют путем испарения магния в вакууме при 900 °С. Испаряющийся чистый магний осаждается в конденсаторе. Электролитическое рафинирование магния схоже с аналогичным процессом рафинирования алюминия по трехслойному методу (см. § 5 гл. 4). В электролизере внизу у анода находится слой рафинируемого магния, выше — слой электролита, а над ним у катода накапливается чистый магний.
частиц электролита и шлама. Рафинирование возгонкой осуществляют путем испарения магния в вакууме при 900 °С. Испаряющийся чистый магний осаждается в конденсаторе. Электролитическое рафинирование магния схоже с аналогичным процессом рафинирования алюминия по трехслойному методу (см. § 5 гл. 4). В электролизере внизу у анода находится слой рафинируемого магния, выше — слой электролита, а над ним у катода накапливается чистый магний.