Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
В чем различие между дозиметрией внешнего облучения и дозиметрией внутреннего облучения?Стр 1 из 5Следующая ⇒
Аннотация
В Пособии изложены основные принципы расчетных и инструментальных методов дозиметрии излучения радиофармпрепаратов (РФП), используемых в экспериментальных исследованиях с лабораторными животными. Эти методы предназначены для регистрации кинетики накопления и выведения препаратов различными тканями, органами и системами организма, определения лучевых нагрузок на злокачественные опухоли и нормальные ткани, обеспечение радиационной безопасности персонала и прогнозирования дозовых характеристик при использовании РФП в клинических условиях. Пособие предназначено для студентов и аспирантов, обучающихся по специальностям, связанным с ядерной медициной, медицинской физикой, радиофармацевтикой, дозиметрией внутреннего облучения и радиационной экологией. Пособие также может быть полезно для специалистов, занимающихся вопросами биологического действия инкорпорированных радионуклидов и разработкой новых радиофармпрепаратов.
Учебное пособие
Дозиметрическое сопровождение создания радиофармацевтических препаратов для радионуклидной диагностики и терапии
В.Ф.Степаненко, В.М.Петриев, В.Г.Скворцов, Е.К.Яськова, М.Ю.Орлов, И.Г.Крюкова, В.А.Соколов, Н.Б.Борышева, А.Ф.Цыб
ФГБУ Медицинский радиологический научный центр Минздравсоцразвития России
г.Обнинск 2011 г. Содержание
Введение
Аннотация
1. В чем различие между дозиметрией внешнего облучения и дозиметрией внутреннего облучения?
2. Основное уравнение для расчетов доз внутреннего облучения 3. Кинетические модели 4. Расчет величин Ns при экспериментальных исследованиях и доклинических испытаниях новых радиофармпрепаратов 5. Расчет величины DF (T←S) 6. Пример оценки доз внутреннего облучения организма в экспериментальных исследованиях нового препарата на основе 103Pd и микросфер альбумина для радионуклидной терапии
7. Примеры неопределенностей при экспериментально-расчетной оценке доз внутреннего облучения лабораторных животных
8. Рекомендуемая литература.
9. Полезные определения, термины и величины (глоссарий).
Введение
Ядерная медицина, как самостоятельный раздел медицины, возникла на рубеже 50-60 годов двадцатого века и включает в себя два основных направления – радионуклидная диагностика и радионуклидная терапия онкологических и неонкологических заболеваний человека.
Преимущества, а в ряде случаев и незаменимость, методов ядерной медицины обусловили в течение последних десятилетий ее стремительное развитие и превращение в неотъемлемую часть клинической практики в развитых странах. В основе ядерно-медицинских технологий лежит применение так называемых радиофармацевтических препаратов (РФП) – химических соединений, содержащих определенный радионуклид, связанный с носителем (органическая молекула, белковая микросфера, антитело и др.), обеспечивающим избирательное накопление РФП в очаге патологического процесса. К числу основных требований, предъявляемых к РФП, можно отнести следующие: - минимизация радиационной нагрузки на больного и медицинский персонал; - оптимальные для клинического применения энергетические характеристики излучения радионуклида и период его полураспада; - безопасность для пациента в химическом отношении как самого РФП, так и продуктов его биотрансформации в организме. Применяемые в медицине радионуклиды получают на реакторах, циклотронах и генераторах. В связи с тем, что злокачественные новообразования продолжают оставаться в числе лидеров причин смертности населения промышленно–развитых стран они могут быть по праву отнесены к категории наиболее значимых заболеваний с медицинской, экономической и социальной точек зрения, и разработка методов диагностики и лечения онкологических заболеваний является актуальной задачей ядерной медицины. Особая актуальность этой задачи для России обусловлена тем, что в стране сложилось неудовлетворительное положение в области развития и применения современных медицинских радионуклидных технологий. При этом количество диагностических и терапевтических процедур в мире постоянно возрастает. Так, число радиодиагностических процедур в США составляет 102 пациента на 1 тыс. населения в год, в Японии – 48, в Канаде – 47, в Великобритании – 39. В России этот показатель не превышает 7. В радиотерапевтических процедурах потребность населения России удовлетворяется не более чем на 1-3%. По прогнозам аналитиков к 2010 г. потребление РФП в США возрастет до 2,0 млрд. долл. [Костылев В.А., Глухов С.Б., Наркевич Б.Я. Медицинская физика, 2006, № 2, 39-46].
В процессе разработки и биологических испытаний новых диагностических и терапевтических РФП в первую очередь необходимы сведения о создаваемых ими дозах облучения опухоли, органов и тканей, всего организма. В последние годы разрабатываются новые РФП, весьма перспективные с точки зрения терапевтического применения за счет относительно коротких периодов полураспада и высокого локального энерговыделения. Это существенно усложняет задачи дозиметрического сопровождения исследований. Инструментальные измерения доз внутреннего облучения органов и тканей могут быть осуществлены далеко не во всех случаях. Поэтому применение расчетных методов является более универсальным подходом, поскольку при этом используются так называемые «математические фантомы», т.е. модели с той или иной степенью детальности описывающие пространственные, геометрические и физические характеристики реальных организмов и/или их частей. Пособие основано на результатах многолетних исследований, проводимых в Лаборатории медико-экологической дозиметрии и радиационной безопасности и Лаборатории экспериментальной ядерной медицины ФГБУ МРНЦ Минздавсоцразвития России в г.Обнинске. Эти исследования ведутся в тесном контакте с отделением радионуклидной диагностики и отделением радиохирургического лечения открытыми радионуклидами клинического сектора Центра, что открывает путь к быстрой клинической апробации новых препаратов. В тексте пособия приведены упражнения для самостоятельного выполнения. Приведен также глоссарий, содержащий полезные термины, определения и величины. Пособие предназначено для студентов и аспирантов, обучающихся по специальностям, связанным с ядерной медициной, медицинской физикой, радиофармацевтикой, дозиметрией внутреннего облучения и радиационной экологией. Пособие также может быть полезно для специалистов, занимающихся вопросами биологического действия инкорпорированных радионуклидов и разработкой новых радиофармпрепаратов.
Кинетические модели Динамику радиофармпрепаратов в органах и тканях часто описывают с помощью математических моделей, которые, как правило, представляют собой сумму экспоненциальных функций (так называемые ”кинетические модели”):
A(t) = ∑αj e-λjt , (3) где: A(t) – содержание РФП в органе или ткани как функция времени t; a j – содержание РФП в органе или ткани, ассоциированное с j-й экспонентой; l j – константа, которая характеризует скорость выведения или накопления РФП, ассоциированная с j-й экспонентой. Сумма в выражении (3) суммирует все компоненты экспоненциальных функций по индексу j.
Для того, чтобы уравнение (3) было более понятным, проиллюстрируем его на конкретном примере. Рассмотрим случай введения в организм (“во все тело”) РФП в виде йодида натрия. Предположим, что согласно кинетической модели 72,9% йодида натрия выводится из всего тела с биологическим периодом полувыведения 6,08 часа, а 27,1% этого соединения выводится из всего тела с биологическим периодом полувыведения 1560 часов. Соотношение между биологическим периодом полувыведения (T1/2) и константой l следующее: T1/2 = 0,693/l. Следовательно, величины l равны 0,693/6 = 0,114 час-1 и 0,693/1560 = 0.000444 час-1,соответственоо. Итак, если мы предположим, что в организм было введено условное количество в одну условную единицу (в данном случае неважно – какова эта единица) йодида натрия, то кинетическая модель, описывающая биологическое выведение этого РФП из организма будет иметь следующий вид:
А(t) = 0,729e-0.114t + 0,271-0.000444 (4) Итак, мы видим, что 0,729 условных единиц йодида натрия было выведено из организма в соответствии с первой экспонентой и 0,271 условных единиц йодида натрия было выведено из организма в соответствии со второй экспонентой. Но… (что важно!) это - только БИОЛОГИЧЕСКОЕ выведение. Мы можем перейти к реальной активности и числу распадов N для любого радиоактивного изотопа йода в составе йодида натрия. Например, для того, чтобы рассчитать полное число распадов (N) 131I мы должны проинтегрировать уравнение (4) с учетом периода ФИЗИЧЕСКОГО полураспада рассматриваемого радионуклида. Если мы интегрируем по времени от нуля до бесконечности, то получим следующее простое соотношение:
N = α1/(λ1+λP) + α2/(/(λ2+λP), (5) где: l p – константа ФИЗИЧЕСКОГО полураспада 131I = 0,693/(8 суток×24 час/сутки) = 0,0036 час-1. Остальные обозначения – те же, что и выше, см. (4). После этого, для того, чтобы перейти к реалиям, достаточно умножить результат на реально введенную в организм активность РФП. Если есть необходимость интегрировать не до бесконечности, а до какого-то времени t, то достаточно умножить каждое слагаемое в (5) на соответствующие этим слагаемым величины (1-e-(l1+lp) t) и (1-e-(l2+lp) t), соответственно. Ниже, в качестве примера, приведена табл. 1 с величинами параметров уравнения (3) для различных органов и всего тела (случай однократного введения йодида натрия в организм взрослого человека). Таблица 1
Упражнение 1. Используя данные табл. 1 применительно к 131I, вычислить число распадов в каждом органе-источнике, исходя из того, что в организм была введена активность 1 Бк (для справки – 1 распад/сек = 1 Бк):
Тонкий кишечник: ……..(?) распадов
Упражнение 2. Пользуясь справочными данными о периодах полураспада радионуклидов, оцените следующее: При начальной активности источника с 32P, равной 9,25 МБк, какова будет его активность через 43 дня?
Упражнение 3. Аналогичные вычисления выполните для источника с 14С, исходя из того, что его начальная активность была равна 37 МБк.
4. Расчет величин Ns при экспериментальных исследованиях и доклинических испытаниях новых радиофармпрепаратов При экспериментальных исследованиях возможно получение прямых данных о величинах активности органов и тканей экспериментальных животных (например, крыс или мышей). Эти данные получаются методами радиометрии или спектрометрии активности выделенных для исследований органов или тканей. При этом регистрируются следующие данные: измеренная активность в расчете на единицу массы биологического образца, масса измеренного образца, процентная доля массы органа или ткани, из которого был отобран образец, по отношению к массе всего тела экспериментального животного, дата введения РФП в организм животного, способ введения, дата и час измерения активности биологического образца, длительность измерения активности биологического образца. В результате должна быть создана следующая протокольная таблица для каждого исследованного лабораторного животного, включенного в эксперимент (см. таблицу ниже). По данным таких таблиц, способом численного интегрирования, без построения кинетических моделей, возможен расчет величин Ns.
Протокольная таблица Заголовок: название РФП, название радионуклида, физическая форма РФП (например, микросферы альбумина с указанием их среднего диаметра), дата и час (минуты) введения и способ (путь) введения радионуклида в организм экспериментального животного, общий объем инъекции (если необходимо, то указать по порциям), масса всего тела животного, дата выделения органов и тканей. Число животных, органов и тканей (от каждого животного), использованных в эксперименте, и ссылки на соответствующие протоколы измерений активности органов и тканей у группы лабораторных животных, включенных в эксперимент. ФИО ответственного за эксперимент лица. Тип и основные характеристики применяемого для измерений активности прибора, продолжительность одного измерения, дата измерений.
Наиболее простой способ численного интегрирования таблично заданной активности органа или ткани по времени (а также всего тела)– это метод численного интегрирования по формуле трапеций [Самарский А.А., Гулин А.В. Численные методы. Учебное пособие для вузов. – М. Наука. Гл. ред. Физ-мат.лит., 1989.]:
Ns = ∫A(t)dt ≈ 0,5×∑[a(ti-1) + a(ti)] × (ti-ti-1) × m, (6) Где ∫A(t)dt – интеграл по времени от момента времени t0=0 (начало введения РФП в организм) до некоторого момента времени tn, когда измерения были закончены, от предполагаемой аналитической функции A(t), описывающей динамику активности; A(t), активность, содержащаяся в том или ином органе или ткани (или же во всем теле) в зависимости от времени t; ∑ – сумма по индексу i от момента времени t0=0 (начало введения РФП в организм) до некоторого момента времени tn, когда измерения были закончены; a(ti) – удельная активность,(Бк/г), РФП, измеренная в определенный момент времени ti после введения РФП в организм; ti , ti-1 – i-й и, соответственно, предыдущий момент времени измерения активности РФП, измеренной после введения РФП в организм, в том или ином органе, ткани (или во всем теле), сек. m – полная масса измеренного органа или ткани (или всего тела), г.
5. Расчет величины DF (T←S) Величина DF(T←S) = к × ∑ fi Ei fi(T←S) Qi / mT определена в соотношениях (1) и (2). Фактически – это величина эквивалентной дозы в органе-мишени, Зв, приходящаяся на один распад рассматриваемого радионуклида в органах-источниках, или же (что то же) на Бк×с. Значения к, fi , Ei, Qi могут быть получены из справочных материалов. Величины mT определяются экспериментально (для организма экспериментальных животных) или же табулированы в соответствующих справочниках для стандартных математических фантомов. Остается понять, что же такое величина fi(T←S). Это не что иное, как доля полной энергии ионизирующего излучения i (альфа, электронного, бета, фотонного), излученной органом-источником S и поглощенной в органе-мишени Т. Как правило, расчет величин fi(T←S) осуществляется с применением метода стохастического моделирования процессов взаимодействия ионизирующего излучения с веществом (метод Монте-Карло). При этом необходимо наличие соответствующих математических фантомов органов и всего тела экспериментальных животных или человека.
Далее приводится пример результатов, полученных при использовании метода стохастического моделирования в задаче оценок поглощенных доз внутреннего облучения в организме лабораторных животных. 6. Пример оценки дозы внутреннего облучения организма в экспериментальных исследованиях нового препарата на основе 103Pd и микросфер альбумина для радионуклидной терапии
Здесь в качестве примера представлены результаты оценок доз внутреннего облучения организма экспериментальных животных при испытаниях терапевтического РФП на основе микросфер альбумина (МСА), меченных 103Pd. Для получения солидного варианта аденокарциномы Эрлиха в заднюю конечность экспериментальных животных (мышей) подкожно вводили 0,1 мл взвеси клеток опухоли (3,5×106 клеток), полученных от мышей-доноров на 8 – 10 сутки роста. Масса опухоли через 7 суток после перевивки достигала в среднем 1,15 г ±0,15 г). Фармакокинетические исследования 103Pd-МСА проводились на беспородных белых мышах, самках, с массой тела 25 – 40 г (средняя масса 30,6 г±2,3 г – без учета массы опухоли). Всего было использовано 35 животных. Исследования фармакокинетики 103Pd-микросфер альбумина (103Pd-МСА) диаметром 20-40 мкм (средний диаметр 30±6 мкм) проводили для оценки накопления и удержания активности опухолевой тканью при внутриопухолевом введении и соответствующей оценки поглощенных доз внутреннего облучения. Исходный препарат - объем 5 мл, удельная активность радиоактивного раствора -– 1,85 МБк/мл, концентрация микросфер альбумина в растворе – 5 мг/мл. Каждому животному внутриопухолево вводили по 0,1 мл с активностью 0,185 МБк, при содержании МСА – 0,5 мг на мышь. Распределение 103Pd в МСА предполагалось равномерным по объему микросферы. Через определенные интервалы времени животных (по пять животных на каждый срок исследования) забивали декапитацией, выделяли образцы крови, легких, печени, селезенки, почек, желудка, кишечника, мышцы бедра и опухоли. Все выделенные органы и ткани помещали в пластиковые пробирки, взвешивали на аналитических электронных весах фирмы Sartorius (Germany) и проводили измерение активности 103Pd. Измерение активности проб проводили с помощью автоматического гамма спектрометра “Wizard” версии 2480 фирмы «PerkinElmer/Wallac», Финляндия. Спектрометр имеет многоканальный анализатор с 2048 каналами, калиброванный по энергиям гамма-излучения в диапазоне 15–2000 кэВ с максимальным мертвым временем 2,5 микросекунды. Измерения активности 103Pd проводили по гамма-излучению с энергией 20–23 кэВ. По данным радиометрии рассчитывали содержание меченого препарата во всем органе или ткани и в 1 г массы ткани в процентах от введенного количества. Интегрирование зависимостей активности РФП от времени проводилось численно по методу трапеций. Радионуклид 103Pd (T1/2=16,99 суток) распадается по схеме электронного захвата с образованием дочернего радионуклида 103mRh (T1/2=57 мин) с вероятностью 0,9992 на один распад 103Pd. В таблицах 2 и 3 представлены данные о характеристиках излучений 103Pd и 103mRh.
Таблица 2 Характеристики излучения 103Pd
Таблица 3 Характеристики излучения 103mRh
Упражнение 4. Пользуясь справочными данными, опишите тип и схему распада 60Co, тип и энергетические характеристики соответствующих излучений.
Упражнение 5. Как известно, в результате аварии на Чернобыльской АЭС в окружающую среду было выброшено большое количество радионуклида 137Cs. Пользуясь справочными данными, опишите тип и схему распада 137Cs, тип и энергетические характеристики соответствующих излучений.
Упражнение 6. В лаборатории используется закрытый источник 18F. Будет ли при этом иметь место какое-либо гамма-излучение от этого источника?
Расчет “долей поглощенной энергии” fi(T←S), т.е. долей полной энергии ионизирующего излучения i излученной органом-источником S и поглощенной в органе-мишени Т, был проведен с применением метода стохастического моделирования взаимодействия ионизирующего излучения с веществом, (метод Монте-Карло) применимого для биоструктур любых форм, имеющих различную плотность и элементный состав. Расчеты методом Монте-Карло проводятся либо c помощью программ для ЭВМ, составленных пользователями и ориентированных на решение конкретных задач, либо с помощью коммерческих программ, предназначенных для решения широкого круга задач. В частности, используются различные версии программы МСNP [4]. Для выполнения расчетов методом Монте-Карло по программе MCNP необходимы следующие характеристики сред, для которых проводятся расчеты взаимодействия излучения с веществом: - геометрические параметры сред и источников излучения (координаты, форма, границы), а также их элементный состав и плотность; - параметры взаимодействия излучения с веществами, из которых состоят исследуемые среды. В качестве параметров взаимодействия фотонов и электронов с веществом использованы данные библиотеки констант ENDF/B-VI, имеющейся в пакете MCNP (поточечное задание параметров взаимодействия в диапазоне энергий 3 кэВ – 14 МэВ). В таблице 4 приведены элементные составы и плотности сред, для которых рассчитывалось взаимодействие квантового излучения с тканями организма животного. Таблица 4 Элементный состав различных биологических тканей (% на единицу массы ткани).
Упражнение 7. Что собой представляет тип радиоактивного распада по схеме электронного захвата? Что такое электроны внутренней конверсии? Что такое Ожэ-электроны? Что такое характеристическое излучение?
Как отмечено выше, предметом расчета является так называемая “доля энергии ионизирующего излучения, поглощенная органом-мишенью по отношению ко всей энергии, излученной органом-источником” – fi(T←S) (см. выше соотношения (1) и (2)). Остальные величины, представленные в (1) и (2) – это справочные данные, а также экспериментальные данные, получаемые в результате исследования фармакокинетики РФП. Для вычисления накопленной дозы в органе-мишени (HT – см. выше соотношение (1)) необходим обязательный учет физического распада радионуклида, его фармакокинетики, а также вклад в облучение органа-мишени от других источников излучения в организме (NS). В данном случае величина HT в (1)была выражена в единицах Гр, поскольку фактор качества для рассматриваемых видов излучения равен единице, а NS – в числе распадов радионуклида в органах-источниках S (1 распад равен 1 Бк×сек), произошедших с момента введения радионуклида в организм до заданного момента накопления дозы (при внутреннем облучении открытыми источниками радионуклидов, как правило, период практически полного накопления дозы равен 5-7 периодам эффективного половинного уменьшения активности источника), fi – доли излучения с энергией Ei, излученного на один распад радионуклида, выражены в относительных единицах; Ei – (энергия ионизирующего излучения) в Мэв, fi(T←S) – (доля энергии, поглощенной в органе-мишени (T) по отношению ко всей энергии ионизирующего излучения, излученной органом-источником (S)), выражена в безразмерных единицах; Qi – так называемый “фактор качества”, Зв/Гр, – как было отмечено выше, для рассматриваемых видов излучений величина этого фактора равна единице; mT – (масса органа-мишени), в г, РФП с 103Pd представляет собой микросферы альбумина с радионуклидом, распределенным в ее объеме. Распределение активности внутри микросферы равномерно. Средний диаметр микросфер равен 30 мкм. В таблицах 5 и 6 представлены величины fi - поглощенных долей энергии внутри микросфер альбумина (МСА) диаметром 30 мкм для электронов различной энергии (Ei), излучаемых радионуклидами 103Pd и 103mRh равномерно распределенными по объему микросфер. Там же приведены величины X99 - радиусы сфер 99% поглощения энергии электронов вокруг точечных источников в тканеэквивалентной среде, мкм.
Таблица 5
Поглощенные доли энергии (fi) внутри МСА диаметром 30 мкм для электронов различной энергии (Ei), излучаемых атомами 103Pd, равномерно распределенными по объему МСА, и величины X99 (радиус сферы 99% процентного поглощения энергии электронов вокруг точечного источника в водной среде), мкм.
Таблица 6
Поглощенные доли энергии (fi) внутри МСА диаметром 30 мкм для электронов различной энергии (Ei), излучаемых атомами 103mRh равномерно распределенными по объему МСА, и величины X99 (радиус сферы 99% процентного поглощения энергии электронов вокруг точечного источника в водной среде), мкм.
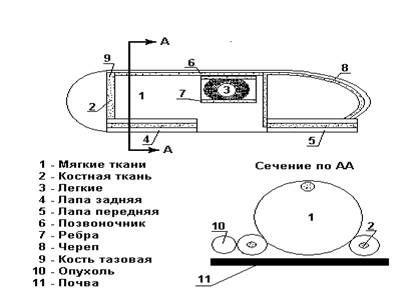
Как следует из табл. 5 и 6, в диапазоне энергий конверсионных электронов и электронов Ожэ от 38% до 99,9 % их энергии поглощается внутри микросфер. Остальная энергия электронов излучается вне микросфер, так что поглощенная доза в клетках опухоли, находящихся вблизи микросфер может быть значимой. Поэтому в наших расчетах была учтена доза облучения опухоли за счет электронов, излучаемых вне микросфер. При этом учитывали вклад в поглощенную дозу в опухоли только тех электронов, которые излучают вне микросфер более 10% своей энергии (от 16% до 62%) и имеют пробег в ткани более 1 мкм (от 6 мкм до 27 мкм) – см. таблицы 5 и 6. Значение фактора ∑fi EiФi(TS) в соотношении (1) для этих электронов равно 0,0200 МэВ (здесь в качестве источника S рассматривается микросферы альбумина, а в качестве мишени T – клетки опухоли, окружающие микросферы). Не учитывали вклад в поглощенную дозу в опухоли от LMM и MXY Ожэ-электронов, которые хотя и имеют интенсивные линии излучения, но их пробег в ткани существенно меньше 1 мкм (от 0,02 мкм до 0,18 мкм), поскольку эти электроны в силу малости пробега не достигают цитоплазмы и ядра окружающих микросфер клеток опухоли. Что касается квантового излучения, средняя энергия которого равна 0,0181 МэВ (с учетом излучения дочернего 103mRh), то его ослабление в материале микросфер диаметром 30 мкм пренебрежимо мало, то есть при расчете поглощенной дозы в тканях и органах активность можно считать равномерно распределенной по объему опухоли. Как отмечено выше, при расчетах доз внутреннего облучения организма используются так называемые “математические фантомы”. Элементный состав тканей фантома предполагается аналогичным составу биологических тканей (табл. 4). Расчеты проводились для расположенного в воздушной среде фантома лабораторной мыши с опухолью, привитой на задней конечности (рис. 1). Предполагалось, что животное находится в клетке, расположенной на стеллаже. В качестве радионуклидов рассматривались 103Pd с дочерним 103mRh.
Рис. 1. Фантом мыши, используемый в расчетах
Масса всего тела фантома – 30,6 г (без учета массы опухоли, шерсти), сферическая опухоль массой 1,15 г расположена на поверхности задней конечности животного, масса бедра животного, на котором перевита опухоль – 1,3 г. В табл. 7 приведены данные о массе органов и тканей экспериментальных животных (в процентах по отношению к массе всего тела).
Таблица 7
Масса органов и тканей экспериментальных животных (в процентах по отношению к массе всего тела)
В табл. 8 представлены рассчитанные поглощенные дозы в мишенях на единицу распада активности в источнике.
Расчеты дозы для бедра задней конечности проведены в связи с тем, что это – ближайшая к опухоли (источнику излучения) часть тела и, тем самым, является наиболее облучаемой частью всего тела за счет активности, содержащейся в опухоли, и за счет внутреннего облучения радионуклидами, попавшими в мышечную ткань. Таким образом, доза облучения мышечной ткани бедра задней конечности является максимально возможным пределом облучения всего тела. Расчеты для почек были проведены потому, что, как было установлено (см. ниже таблицу 9), почки являются основным органом, ответственным за выведение активности из организма, то есть – критическим органом в отношении уровня облучения. Учет вклада электронов в дозу облучения почек и бедра произведен потому, что поступивший в организм 103Pd (включая дочерний 103mRh) за счет “утечки” из опухоли находился в свободном виде (то есть, без МСА) и тем самым окружающие радионуклид клетки тканей подвергались электронному облучению от атомов 103Pd и дочернего 103mRh, находящихся в межклеточном пространстве. При этом учитывался вклад в поглощенную дозу в ткани только тех электронов, которые имеют пробег в ткани более 1 мкм (от 6 мкм до 27 мкм) – см. табл. 5 и 6. Значение фактора ∑fi Eifi(TS) в соотношении (1) для этих электронов равно 0,0384 МэВ (величины fi(TS) для точечных источников электронов в ткани равны единице). Не учитывали вклад в поглощенную дозу в тканях от LMM и MXY Ожэ-электронов, которые хотя и имеют интенсивные линии излучения, но их пробег в ткани существенно меньше 1 мкм (от 0,02 мкм до 0,18 мкм), поскольку эти электроны в силу малости пробега при излучении их из межклеточного пространства не достигают цитоплазмы и ядер клеток тканей. Следует отметить, что эффект облучения этими короткопробежными электронами может быть очень существенным при условии локализации источников их излучения в ядрах клетки, что достижимо только при условии использования специальных носителей, способных присоединить радионуклид к внутриядерным микроструктурам клетки (например, к ДНК хромосом).
Таблица 9
Результаты оценки доз в мишенях на единицу распада в источнике а)
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-17; просмотров: 93; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.188.61.223 (0.096 с.) |