
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Диссоциация кислот, оснований и солейСтр 1 из 2Следующая ⇒
С позиций теории электролитической диссоциации к кислотам относятся вещества, способные диссоциировать в растворе с образованием ионов водорода, а к основаниям вещества, которые при диссоциации дают гидроксид-ионы. Наличие в молекулах кислот ионов водорода определяет важнейшие общие свойства этого класса соединений: 1.Способность взаимодействовать с основаниями с образованием солей. 2.Способность выделять водород при взаимодействии с активными металлами (Zn, Fe, Mg, Al и др.). 3.Изменение окраски индикаторов. 4. Кислый вкус. Сильные кислоты полностью диссоциированы на ионы:
НNO3 → Н+ + NО3-. Слабые кислоты диссоциируют частично:
СН3СООH ↔ H+ + CH3COO-,
Слабые многоосновные кислоты диссоциируют ступенчато:
Н2СО3 ↔ Н+ + НСО3- НСО3- ↔ Н+ + СО32- Наличие в молекулах оснований гидроксид-ионов обусловливают следующие общие свойства этих соединений: 1.способность взаимодействовать с кислотами с образованием солей; 2. водные растворы оснований изменяют окраску индикаторов; 3. растворы оснований имеют горький вкус и скользкие на ощупь. Щелочи диссоциируют в водных растворах полностью:
NaOH → Na+ + ОН-. Слабые основания диссоциируют частично:
NH4OH ↔ NH4+ + ОН-,
Слабые многокислотные основания диссоциируют ступенчато:
Mg(ОН)2 ↔ MgОН+ + ОН- MgОН+ ↔ Mg2++ OH- В растворах многоосновных кислот, а также оснований, содержащих несколько гидроксильных групп, устанавливаются ступенчатые равновесия, отвечающие последовательным стадиям диссоциации. Так, диссоциация ортоборной кислоты протекает в три ступени: 1. H3BO3 ↔ H+ + H2BO-3; 2. H2BO3- ↔ H+ + HBO2-3; 3. HBO32- ↔ H+ +BO3-3; Поскольку Кдисс1 >Кдисс2 > Кдисс3, то в наибольшей степени диссоциация протекает по первой ступени a1 > a2 > a3. Суммарный процесс диссоциации H3BO3
H3BO3 ↔ 3H+ + BO3-3 характеризуется полной константой диссоциации:
Перемножив правые и левые части равенств (1) – (3), получим:
откуда видно, что полная константа диссоциации численно равна произведению ступенчатых констант:
Амфотерные гидроксиды проявляют кислотно-основную двойственность. При взаимодействии с кислотой амфотерный гидроксид является донором гидроксогрупп: Cr(OH)3 + 3HCl ↔ CrCl3 + 3H2O
Cr(OH)3 + 3H+ ↔ Cr3+ + 3H2O, а при взаимодействии с основанием - их акцептором:
Cr(OH)3 + 3КОН ↔ К3[Сr(ОН)6], Cr(OH)3 + 3ОН- ↔ [Сr(ОН6)]3-. Соли диссоциируют с образованием катионов металла и анионов кислотного остатка:
NaNO3 → Na+ + NO3-. При диссоциации кислых солей образуются катионы металла и гидроанионы, которые частично диссоциируют с образованием ионов водорода:
NaHCO3 → Na+ +HCO3-; HCO3- ↔ H+ + CO32-. Молекулы основных солей диссоциируют в растворе на гидроксокатионы и анионы кислотного остатка:
FeOHSO4 → FeOH2+ + SO42-. Гидроксокатионы частично диссоциируют с образованием катионов металла и гидроксид-ионов:
FeOH2+ ↔ Fe3+ + OH-.
|
|||||
|
Последнее изменение этой страницы: 2017-02-17; просмотров: 137; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.239.123 (0.008 с.) |
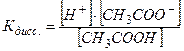 .
. .
. (1)
(1) (2)
(2) (3)
(3) .
. ,
, .
.


