
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Теория электролитической диссоциации. ⇐ ПредыдущаяСтр 2 из 2
ГИДРОЛИЗ СОЛЕЙ. Учебное пособие для самостоятельной работы студентов по учебной дисциплине «Общая и неорганическая химия» Екатеринбург
Пособие для самостоятельной работы студентов по общей и неорганической химии / сост. преподаватель химии, кандидат химических наук А.И. Серебрякова. – Екатеринбург; Фармацевтический филиал ГБОУ СПО «СОМК», 2012. – 34 с.
Рецензент: С.К. Котовская старший научный сотрудник кафедры органической химии УГТУ - УПИ, кандидат химических наук
Учебное пособие предназначено для самостоятельной работы студентов при изучении тем «Растворы» и «Теория электролитической диссоциации». В нем отражены вопросы, которые знакомят студентов с понятиями электролитов и неэлектролитов, механизмом диссоциации, с правилами написания уравнений диссоциации, гидролиза; дано понятие о кислотах и основаниях согласно протолитической теории Бренстеда-Лоури. Материал тесно связан с профессиональной направленностью: анализом лекарственных веществ в растворах, приготовлением и хранением лекарственных форм.
Учебное пособие рассмотрено на заседании кафедры химии и фармацевтической технологии (протокол № 2 от 07 сентября 2012 года)
СОДЕРЖАНИЕ
7. Реакции обмена в водных растворах электролитов.
ВВЕДЕНИЕ
Значительное количество лекарственных средств готовят в виде растворов, настоек, суспензий, эмульсий. Растворы, приготовленные из неорганических соединений, подвергаются распаду на ионы. Ионы взаимодействуют друг с другом, образуют новые соединения. Также, взаимодействуя с водой вещества, растворенные в ней часто гидролизуются, то есть, разлагаются. В связи с этим фармацевтам необходимо понимать все процессы, происходящие с веществами в водных растворах для того, чтобы правильно готовить лекарственные формы, учитывать совместимость веществ в растворе с химической точки зрения. Важно учитывать условия хранения многих веществ (температурный режим, влажность воздуха), подвергающихся гидролизу.
Большое значение для многих процессов, протекающих в кислой, щелочной или нейтральной среде, для стабилизации среды имеет изучение величины рН (водородного показателя), поэтому в пособии выделен раздел, изучающий выведение рН. В отдельную часть выделен раздел о кислотно-основных свойствах соединений согласно теории Бренстеда-Лоури. Изучение свойств соединений третичного атома азота, а также большинства органических гетероциклических соединений необходимы для их анализа и установления подлинности. В конце пособия даны упражнения и задания по темам, рассматриваемым в данном пособии.
I. ЭЛЕКТРОЛИТЫ И НЕЭЛЕКТРОЛИТЫ
Вещества, растворы и расплавы которых проводят электрический ток в растворах или расплавах, называют электролитами. Мы будем говорить только о веществах - электролитах, подразумевая их нахождение в растворах.
Вещества
Электролиты Неэлектролиты растворы солей, кислот сахар, бензин, бензол, хлороформ оснований глицерин спирт, газы.
К ним относятся вещества с ионной и полярной ковалентной связью (KCl, NiSO4, HCl, H2SO4, NaOH, Ba(OH)2, KOH и др.). Сами электролиты еще делятся на сильные, слабые, средние электролиты. Особенно важна такая классификация для кислот. Если отнесение солей и оснований к сильным электролитам можно приблизительно сделать по растворимости, то для кислот необходимо рассмотрение многих факторов по составу, строению. Классификация электролитов по силе приведена таблице (приложение 1). Сухие соли и основания, безводные кислоты электрический ток не проводят. Это говорит о том, что при растворении в воде такие вещества претерпевают серьезные изменения. Электропроводность растворов этих веществ объясняет теория электролитической диссоциации (ТЭД), начала которой положил Сванте Август Аррениус в 1887 году.
II. ДИССОЦИАЦИЯ ЭЛЕКТРОЛИТОВ. ОКРАСКА ИНДИКАТОРОВ В РАЗЛИЧНЫХ СРЕДАХ
Процесс распада веществ электролитов на ионы пол действием растворителя или в расплаве называется электролитической диссоциацией. Это обратимый процесс и обозначается стрелочками обратимости *: ионизация
моляризация Сколько молекул распадается на ионы, столько молекул и образуется.
* некоторые авторы процессы диссоциации сильных электролитов изображают стрелкой, направленной вперед, а слабых электролитов - обратимыми стредками. Однако, это только символ в помощь для графического различия процессов у разных по природе веществ.
Основные положения ТЭД
1. Электролиты при растворении в воде диссоциируют на ионы: катионы и анионы. Количество катионов и анионов может быть различным, но суммарный заряд всех катионов всегда равен суммарному заряду всех анионов, поэтому, весь раствор в целом остается электрически нейтральным. Ионы – это атомы или группы атомов, имеющие положительный или отрицательный заряд. Простые ионы: Сl-, F-, S2-, Na+, Mg2+ и др. Сложные ионы: PO43-, NH4+, SO42- и др.
2. При пропускании электрического тока через раствор электролита ионы приобретают направленное движение: катионы движутся к отрицательно заряженному катоду, а анионы к положительно заряженному аноду.
а) б)
в) Рис. 1. Хаотическое движение ионов (электрический ток отсутствует) а); направленное движение ионов в растворе электролита под действием электрического тока б), в).
3. Диссоциация – это обратимый процесс, поэтому с течением времени наступает химическое равновесие. При этом число молекул распавшихся на ионы (диссоциация) равно числу вновь образовавшихся из ионов.
Свойства ионов отличаются от свойств соответствующих атомов, так как строение их различно, например атом хлора (простое вещество – хлор Сl2) и ион Сl- (хлорид-анион): +17 Сl))) +17 Сl -))) 2 8 7 2 8 8 Хлор – газ, молекула которого состоит из двух атомов хлора ядовит, сильный окислитель, анион хлора входит в состав поваренной соли, поступает в организм с пищей, не ядовит, в реакциях может быть только восстановителем. Механизм диссоциации
В основе механизма диссоциации лежит гидратная теория растворов Д.И.Менделеева, развитая И.А.Каблуковым. Основную роль при диссоциации электролитов в растворах воды играет полярное строение молекул воды:
При растворении вещества с ионной связью в воде полярные молекулы воды ориентируются вокруг ионов вещества:
Рис. 2. Схема электролитической диссоциации электролита с ионной связью (хлорида натрия) в водном растворе.
Возникают силы взаимодействия между ионами веществ и молекуляами воды.В результате ослабевает притяжение между ионами в электролите в 81 раз (для растворителя – воды). Электролит распадается на гидратированные ионы, то есть, окруженные молекулами воды. При диссоциации кислот происходит не просто распад на ионы, а каждый катион водорода удерживает молекулу воды и образуется гидрат постоянного состава. Такой гидратированный протон изображают:
Н+ + Н2О = Н3О+ ион гидроксония
Процесс электролитической диссоциации хлороводорода (вещество с полярной ковалентной связью) с учетом гидратации можно представить так:
Рис. 3. Схема электролитической диссоциации электролита с полярной ковалентной связью (хлороводорода) в водном растворе.
При растворении в воде происходит ориентация диполей воды и возникают междипольные связи. В результате диполь-дипольного взаимодействия изменяется характер химической связи в молекуле НCl. Связь «дополяризуется» и затем становится ионной. Она легко разрывается с образованием гидратированных ионов. В образовании гидратированных ионов большую роль играют донорно-акцепторныое, диполь-дипольное и ион-дипольное взамодействия, водородные связи. Роль донорно-акцепторного взаимодействия (см. раздел 5) в образовании, например, иона H3О+ можно показать следующей схемой:
Диссоциация кислот
Кислотами называются электролиты, которые в водных растворах диссоциируют с образованием только одного вида катионов – катионов водорода. HNO3 ßà H+ + NO3 - (нитрат-анион) HCl ßà H+ + Cl- (хлорид-анион)
Многоосновные кислоты диссоциируют ступенчато: H2SO4 ßà H+ + HSO4- (гидросульфат-ион) HSO4- ßà H+ + SO42- (сульфат-анион)
Легче диссоциация протекает по 1-ой ступени, по 2- ой и 3-ей ступени диссоциация протекает очень трудно, так как положительная частица отрывается от отрицательно-заряженной частицы, которая хорошо притягивает катион водорода: H 3PO4 ßà H+ + H2 РO4 - (дигидрофосфат-анион) H 2 РO4 - ß à H+ + H РO4 2- (гидрофосфат-анион) H РO4 2- ßà H+ + РO4 3- (фосфат-анион)
Диссоциация оснований
Основания – Это электролиты, которые в водных растворах диссоциируют с образованием только одного вида анионов - гидроксид - анионов. Их принято называть гидроксидами, хотя кислородосодержащие кислоты тоже относятся к гидроксидам (кислотным).
NaOH ßà Na+ + OH—
Многокислотные основания диссоциируют ступенчато: Са(ОН)2 ßà СаОН+ + ОН- СаOH+ ßà Ca2+ + OH- катион гидроксокальция или гидроксокатион кальция
Диссоциация амфотерных гидроксидов
Диссоциируют очень слабо двояко: и как основания и как кислоты а) в кислой среде, как основания:
Zn(ОН)2 ßà Zn2+ + 2ОН- (суммарно)
или: Zn(ОН)2 ßà ZnОН+ + ОН- ZnOH + ßà Zn2+ + OH- катион гидроксоцинка или гидроксокатион цинка
б) в щелочной среде: Zn(ОН)2 ß à2H+ + ZnO 22- (суммарно)
или Zn(OH)2 ß à H+ + HZnO2— гидроксоцинкат-анион HZnO2— ßà H+ + ZnO22- цинкат-анион
Диссоциация солей
Средние соли – это электролиты, которые в водных растворах диссоциируют на катионы металла (или аммония) и кислотный остаток.
CaCl2 ßà Ca2+ + Cl- хлорид кальция Na2SO4 ßà 2Na+ + SO42— сульфат натрия
Кислые соли – диссоциируют на катионы металла и кислотный остаток, содержащий в своем составе водород.
В небольшой степени этот водород также отщепляется в виде катиона.
NaHCO3 ßà Na+ + HCO3— гидрокарбонат натрия
Основные соли – диссоциируют на кислотный остаток и катион, содержащий гидроксо-группу.
CaOHCl ßà CaOH+ + Cl- гидроксохлорид кальция (ZnOH)2SO4 ßà 2 ZnOH+ + SO42- гидроксосульфат цинка
В небольшой степени гидроксо-группа также отщепляется в виде аниона. Таким образом, наличие катиона водорода (Н+) или гидроксид-аниона (ОН-) отвечает, соответственно, за кислую и щелочную среду растворов и окраску индикаторов.
Окраска индикаторов
III. СТЕПЕНЬ ДИССОЦИАЦИИ. КОНСТАНТА ДИССОЦИАЦИИ. Количественными характеристиками силы электролитов являются степень диссоциации и константа диссоциации. Степень диссоциация Степень диссоциации - это отношение числа молекул, распавшихся на ионы к общему числу растворенных молекул электролита. Выражается в долях и в процентах. с1
с a – степень диссоциации с1 – концентрация молекул электролита, распавшегося на ионы; с – общая концентрация молекул электролита.
Например, из 0,05 моль H2SO3, растворенных в воде, на ионы распалось 0,01 моль. Найти степень диссоциации H2SO3. 0,01
0,05 Это означает, что из 100 молекул сернистой кислоты на ионы распалось только 20. Степень диссоциации зависит: 1) от природы растворителя; например, СоCl2 – синего цвета, а гидратированные ионы Со2+ - розового цвета. Если хлорид кобальта растворить в воде, то раствор становится розовым, образуется много ионов. Большинство молекул распались на ионы. Если растворить эту же соль в спирте, то раствор имеет синий цвет, т.к. в растворе в основном находятся молекулы. При растворении в воде сила притяжения в между ионами Со2+ и Сl- ослабевает в 81 раз по сравнению с вакуумом, а в спирте, - только в 27,8 раз. Поэтому в воде больше молекул распадаются на ионы. Таким образом, чем больше диэлектриическая проницаемость - ε (величина постоянная) растворителя, тем больше степень диссоциации электролита в нем;
2) от концентрации (разбавления раствора) разб. р-р
зеленый конц. р-р голубой р-р
При разбавлении равновесие сместилось вправо, т.к. при разбавлении увеличилось число катионов, а гидратированные катионы меди (+2) окрашены в голубой цвет. Таким образом, чем больше концентрация, тем меньше степень диссоциации, а чем меньше концентрация, тем больше степень диссоциации. 3) от природы электролита: цинк реагирует с равными объемами кислот одинаковой концентрации, а реакция идет с разными скоростями: Zn + 2 HCl = ZnCl2 + H2↑ соляная кислота (сильная)
Zn + 2CН3COOH = (CH3COO)2 Zn + H2 ↑ уксусная кислота (слабая)
Реакция с соляной кислотой протекает бурно и быстрее, чем с уксусной кислотой, так как последняя образует меньще ионов при диссоциации, чем соляная кислота. 4) от добавления к раствору первого электролита электролита № 2 с одноименным ионом первому электролиту; степень диссоциации 1-го электролита уменьшается. Опыт: В пробирку нальем 1 мл раствора воды и добавим по 2 капли растворов NH4OH и фенолфталеина. Раствор окрасится в малиновый цвет (среда щелочная).
Затем добавим электролит с одноименным ионом NH4Cl – хлорид аммония (содержит катион аммония NH4+), при этом раствор обесцвечивается:
NH4Clßà NH4+ + Cl—
C увеличением числа одноименных ионов NH4+ при добавлении хлорида аммония равновесие смещается влево (по принципу Ле Шателье), так как катионы аммония связывают почти все гидроксид-ионы в молекулы NH4OH и ранее малиновый раствор обесцвечивается; 5) от температуры: при ее повышении степень диссоциации увеличивается для слабых электролитов (эндотермическая реакция); 6) от числа атомов кислорода в молекуле кислородосодержащих кислот: чем больше атомов кислорода в молекуле кислот, тем больше степень ее диссоциации; например HСlO -хлорноватистая кислота практически не распадается на ионы, она слабее угольной(<0,17 %); сравните: • HСlO3 (хлорноватая) a =90 % • HClO4 (Хлорная) a = 95 % 7) от радиуса аниона (поляризуемости) в безкислородных кислотах: сила кислот увеличивается в ряду: HF HCl HBr HI; связь Н – Гал ослабевает, так как радиус и поляризуемость йодид- аниона увеличиваются. По силе электролиты делят на: А) сильные (d> 30%); к ним относят • все растворы солей кроме роданида железа(Ш), хлорида ртути(П), хлората ртути (П); • кислоты: соляная – 98%; серная – 58%; азотная – 91%; бромоводородная – 92%; • основания: КОН –84%; NaОН - 84%; Ва(ОН)2 – 92 %; Б) средней силы (a= 2-30%): • фосфорная кислота –26%; азотистая кислота– 6,5%; H2F2 –8.5% В) слабые (a < 2 5): уксусная кислота – 1,3 %; гидроксид аммония – 1,3 %; угольная кислота –0,17 %; сероводородная –0,07 %; HCN- 0,01%; к ним относятся также основания не щелочных и не щелочноземельных металлов, примеры приведены в таблице (приложение 1).
Константа диссоциации
Процесс диссоциации обратимый, и с течением времени устанавливается химическое равновесие: CH3COOH ßà H+ + CH3COO— уксусная кислота ацетат-анион
Применив к нему закон действующих (действия) масс*, получим:
[H+] [CH3COO-]
[ CH3COOH]
*Закон действующих масс для слабых электролитов и газов в реакциях говорит о том, что скорость реакции прямопропорциональна произведению равновесных концентраций веществ, взятых в степенях, равных их стехиометрическим коэффициентам. Например, аA + bB ßà d D + fF
В момент равновесия скорости прямой и обратной реакций будут равны:
V прямой реакции = V обратной реакции → ← k ∙[A] a∙ [B] b = k ∙ [D] d ∙ [F] f
Тогда из математической пропорции можно записать: → k [D] d ∙ [F] f
← k [A] a∙ [B] b
K равновесия - константа равновесия. В случае диссоциации электролитов она называется константой диссоциации электролита (К.Д.Э.) К.Д.Э. – это отношение произведения концентрации ионов к концентрации недиссоциированных молекул слабого электролита, взятых в степенях, равных стехиометрическим коэффициентам в уравнении диссоциации. По ее величине можно судить о силе электролита. Чем больше константа диссоциации, тем больше концентрация ионов и сильнее электролит. Константа диссоциации зависит от тех же факторов, что и степень диссоциации.
IV. ДИССОЦИАЦИЯ ВОДЫ. ИОННОЕ ПРОИЗВЕДЕНИЕ ВОДЫ. ВЕЛИЧИНА рН (ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ).
Вода - очень слабый электролит и диссоциирует на ионы в незначительной степени: 2Н2О ßà H3O+3 + OH- или
НОН ßà H+ + OH—
[H+] ∙ [ OH--]
[ HOH] Константа равновесия или диссоциации воды очень незначительна, тогда концентрацию недиссоциированных молекул воды можно принять за величину постоянную и равную для объема воды равного одному литру (1 л):
m (H2O) 1000г
M (HOH) 18 г/моль
Это значение велико по сравнению с Кдисс. Домножим левую и правую часть выражения для константы диссоциации на [HOH], тогда произведение Кдисс.∙ [HOH] = [H+]∙ [OH-] = 1,8 • 10—16 ∙ 55,5= 10—14
Кдисс.∙ [HOH] - ионное произведение воды - Кw
Кw = [H+] ∙ [OH-] = 10—14 - величина постоянная.
Отсюда следует: как бы не изменялась концентрация водородных и гидроксильных ионов в воде или в разбавленном водном растворе слабого электролита, их произведение всегда равно ионному произведению воды. Так как [H+] = [OH-] в воде, то [H+] ∙ [OH-] = [ H+] 2 = [OH-] 2 = 10—14,
Если к чистой воде добавить кислоты, то увеличится концентрация ионов Н+; допустим концентрация увеличилась от 10—7 до 10-4, тогда Кw 10-14
[H+] 10—4
Если к чистой воде добавить щелочи. То увеличится концентрация ионов ОН- допустим от 10-7 до 10-3, тогда
Кw 10-14
[ОH-] 10—3
Таким образом, в водных растворах с различной средой (кислотной, нейтральной, щелочной) всегда присутствуют ионы Н+ и ОН—
В нейтральной среде: [H+]=[OH-]= 10-7 В кислой среде: [H+] > 10-7 (например, 10-5, 10-3 , 10-1) В щелочной среде: [H+] < 10-7 (например, 10-9, 10-11 , 10-13)
Концентрация ионов водорода выражается очень малыми величинами и пользоваться ими при расчете неудобно. Более удобная форма выражение концентраций через водородный показатель, который численно равен отрицательному логарифму концентрации водородных ионов:
рН = - lg [H+]
Отсюда рН = lg [H+] = -lg 10—7 = 7 (нейтральная среда) рН = -lg 10—5 = 5 (кислая среда) рН = -lg 10—10 = 10 (щелочная среда)
Для упрощенного расчета рН необходимо выполнить следующий алгоритм действий: 1) -пусть [Н+] = 10-6, тогда рН равен степени с противоположным знаком, т.е. 6; -пусть [Н+] = 10-4,7, тогда рН равен 4,7; 2) -пусть известна [OH-], тогда рН равен: 14 минус показатель степени концентрации этих ионов; например, [ОН-] = 10-4,, тогда рН равен 14 – 4 = 10;
Шкала значений водородного показателя и концентрации катионов водорода
рН 1 2 3 4 5 6 7 8 9 10 11 12 13 14 [H+]10-1 10-2 10-3 10-4 10-5 10-6 10-7 10- 8 10-9 10-10 10-11 10-12 10-13 10-14
слабо-кислая сильно-щелочная
нейтральная V. ПРОТОЛИТИЧЕСКАЯ ТЕОРИЯ БРЕНСТЕДА-ЛОУРИ
Протолитическая теория кислот и оснований, предложена в 1923 году датским ученым Бренстедом и английским ученым Лоури. Согласно этой теории: кислотами (основаниями) являются вещества, молекулы или ионы, которые отдают (соотвественно, присоединяют) протоны. Как те, так и другие получили название протолитов. Под протоном понимают положительный ион водорода (катион водорода Н+). Реакции отщепления протонов изображаются уравнением:
кислотаßà основание + Н+ Например: HCl ßà + H+ + Cl- где Сl- - основание, сопряженное кислоте HCl.
Свободные протоны в растворах самостоятельно не существуют. Они переходят от кислоты к какому-либо основанию, поэтому в растворе всегда протекают два процесса:
CH3COOH ßà CH3COO-- + H+ к-та 1 осн-ие 1
NH3 + H+ ßà NH4+ осн-ие 2 к-та 2 Равновесие между ними изображают:
кислота 1 + основание 2 ßà Основание 1 + кислота 2
сопряженные кислота и сопряженные кислота и основание №1 основание № 2 Таким образом, из кислоты и основания всегда получаются новые сопряженные кислота и основание. Теория расширила круг кислот и оснований – ими могут быть ионы. Одно и то же вещество в зависимости от того, с чем оно реагирует, может быть либо кислотой или основанием. Льюис предложил общее определение: кислота – это вещество, которое акцептирует электронную пару; основание - это вещество, которое предоставляет электронную пару. Исходя из этого определения, взаимодействие между кислотами и основаниями сводится к формированию ковалентной связи по донорно-акцепторному механизму:
: NH3 + H+ à NH4+ Из представлений Бренстеда-Лоури вода обладает амфотерными свойствами, так как способна отдавать и присоединять протоны. В присутствии более сильных оснований вода ведет себя как кислота, а в присутствии более сильных кислот, как основание:
H2O + NH3 ßà NH4+ + OH— к-та осн..
HCl + H2O ßà H3O+ + Cl- к-та осн. Теория вскрыла относительность понятий о кислотах и основаниях и показала, что продукты их взаимодействия следует рассматривать как новые кислоты и основания.
VI. РЕАКЦИИ ОБМЕНА В ВОДНЫХ РАСТВОРАХ ЭЛЕКТРОЛИТОВ. ИОННЫЕ РЕАКЦИИ И УРАВНЕНИЯ Электролиты в водных растворах находятся в виде ионов или частично в виде ионов (сильные электролиты), а в основном в виде молекул (слабые электролиты). Реакции между водными растворами электролитов – это реакции, в которых участвуют ионы. Такие реакции называются ионными. Реакции такого типа возможны, если ионы одного вещества взаимодействуют с ионами другого вещества, связываются между собой и образуют:
А) нерастворимое вещество (осадок, в уравнении обозначают ↓) Б) газообразное вещество (в уравнении обозначают ↑) В) малодиссоциирующее вещество (слабый электролит, например, вода) Г) комплексные соединения
Если в реакциях химические элементы не изменяют степени окисления, то реакции называются реакциями ионного обмена. Реакции будут необратимы и протекают до конца, если выполняются условия, обозначенные в пунктах а,б,в,г.
Случай 1. Реакция обмена с образованием осадка, например, между ортофосфорной кислотой и нитратом серебра:
Запишем уравнение реакции в молекулярной, полной ионной и сокращенной ионной форме:
1) молекулярная форма:
H3PO4 + 3AgNO3 à Ag3PO4 ¯ + 3НNO3
2) переписываем уравнение, изобразив хорошо диссоциирующие вещества в виде ионов, а уходящие из сферы реакции – в виде молекул:
3H+ + PO4 3- + 3Ag+ + 3NO3 -à Ag3PO4 ¯ + 3Н+ + 3NO3+ - это полное ионное уравнение;
3) исключаем из обеих частей равенства одинаковые ионы, т.е. ионы, не участвующие в образовании малодиссоциирующего вещества:
4) выписываем оставшиеся ионы, участвующие в образовании малодиссоциирующего вещества:
3Ag+ + PO4 3- à Ag3PO4↓
- это сокращенное ионное уравнение
Случай 2. Реакция обмена с образованием газообразного вещества, например, между хлоридом аммония и известковой водой (гидроксидом кальция): 1) 2 NH4Cl + Ca(OH)2 à CaCl2 + 2 NH3↑ + 2 H2O
2) 2 NH4+ + 2 Cl - + Ca2+ + 2OH- à Ca2+ +2 Cl- + 2 NH3↑ + 2 H2O
4) 2 NH4+ + 2OH- à 2 NH3↑ + 2 H2O
Случай 3. Реакция обмена с образованием воды (реакция нейтрализации):
1) NaOH + HCl à NaCl + H2O
2) Na+ + OH- + H+ + Cl- à Na+ + Cl- + H2O
3) Na+ + OH- + H+ + Cl- à Na+ + Cl- + H2O
4) H+ + OH- à H2O
Случай 4. Реакция с образованием комплексных ионов:
1) 2AgNO3 + 6NH3 +2 Н2O = 2[Ag(NH3)2]OH + 2NH 4NO3 Диамминсеребра (+1) гидроксид
2) 2Ag++ 2NO3 - + 6NH3 +2 Н2O = 2[Ag(NH3)2]+ + 2OH- + 2NH4+ + 2 NO3 -
4) 2Ag++ 6NH3 +2 Н2O = 2[Ag(NH3)2]+ + 2OH- + 2NH4+
При невыполнении таких условий реакции являются обратимыми и не протекают до конца, так как ионы не связываются и не выводятся из сферы реакции.
VII. ГИДРОЛИЗ СОЛЕЙ Гидролиз соли – взаимодействие ионов соли и воды, приводящее к образованию слабого электролита. Причина гидролиза – образование слабого электролита, следствие – в более частых случаях изменение рН среды. «Hydro” – вода «Lysis” – разложение.
Для того, чтобы определить подвергается соль гидролизу или нет необходимо знать какие основания и кислоты образуют данную соль в реакциях нейтрализации: сильные или слабые электролиты.
Типы гидролиза 1. Гидролиз по аниону (соль образована катионами сильных оснований и анионами слабых кислот); 2. Гидролиз по катиону (соль образована катионами слабых оснований и анионами сильных кислот); 3. Гидролиз смешанный – по катиону и аниону (соль образована катионами слабых оснований и анионами слабых кислот);
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-17; просмотров: 135; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.141.47.221 (0.404 с.) |
 1. Введение 4
1. Введение 4 2. Электролиты и неэлектролиты 5
2. Электролиты и неэлектролиты 5 3. Диссоциация электролитов 5
3. Диссоциация электролитов 5 4. Степень диссоциации. Константа диссоциации 11
4. Степень диссоциации. Константа диссоциации 11 5. Диссоциация воды. Ионное произведение воды. Величина рН 15
5. Диссоциация воды. Ионное произведение воды. Величина рН 15 6. Протолитическая терория Бренстеда – Лоури 17
6. Протолитическая терория Бренстеда – Лоури 17 Ионные реакции и уравнения 18
Ионные реакции и уравнения 18 8. Гидролиз 20
8. Гидролиз 20 9. Задания для самостоятельной работы 26
9. Задания для самостоятельной работы 26 10. Приложения 30
10. Приложения 30 11. Список рекомендуемой литературы 34
11. Список рекомендуемой литературы 34

 Na Cl Na+ + Cl-
Na Cl Na+ + Cl-
 В обычных условиях ионы (без тока) совершают беспорядочное движение:
В обычных условиях ионы (без тока) совершают беспорядочное движение: К(-) А (+)
К(-) А (+)







 + __ + + + + + __
+ __ + + + + + __





 __ + __ __ + + __ __
__ + __ __ + + __ __ __
__




 . + __ + + __ __
. + __ + + __ __
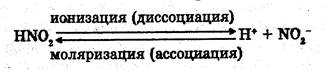
 О _
О _
 Н Н + диполь
Н Н + диполь


 a = ∙ 100 %
a = ∙ 100 % a = ∙ 100% = 20 %
a = ∙ 100% = 20 %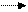
 СuСl2 Cu2+ + 2Cl—
СuСl2 Cu2+ + 2Cl—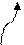 NH4OH ßà NH4+ + OH—
NH4OH ßà NH4+ + OH— создает щелочную среду
создает щелочную среду K дисс. = = 1,86. 10—5
K дисс. = = 1,86. 10—5
 = = K равновесия
= = K равновесия K дисс = = 1,8 • 10—16
K дисс = = 1,8 • 10—16
 [HOH] = = = 55,5 моль\л
[HOH] = = = 55,5 моль\л


 тогда [H+] = [OH-] = Кw = 10—14 = 10—7,
тогда [H+] = [OH-] = Кw = 10—14 = 10—7,
 [ OH-] = = = 10-10
[ OH-] = = = 10-10


 сильно-кислая слабо-щелочная
сильно-кислая слабо-щелочная
 увеличение кислотности увеличение щелочности
увеличение кислотности увеличение щелочности СH3COOH +:NH3 CH3COO- + NH4+
СH3COOH +:NH3 CH3COO- + NH4+





 3H + + PO4 3- + 3Ag+ + 3NO3 - à Ag3PO4 ¯ + 3Н+ + 3NO 3-
3H + + PO4 3- + 3Ag+ + 3NO3 - à Ag3PO4 ¯ + 3Н+ + 3NO 3-




 3) 2 NH4+ + 2 Cl - + Ca2+ + 2OH- à Ca2+ +2 Cl- + 2 NH3↑ + 2 H2O
3) 2 NH4+ + 2 Cl - + Ca2+ + 2OH- à Ca2+ +2 Cl- + 2 NH3↑ + 2 H2O


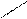
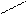 3) 2Ag++ 2NO3 - + 6NH3 +2 Н2O = 2[Ag(NH3)2]+ + 2OH- + 2NH4+ + 2 NO3 -
3) 2Ag++ 2NO3 - + 6NH3 +2 Н2O = 2[Ag(NH3)2]+ + 2OH- + 2NH4+ + 2 NO3 -


