
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
По мдк 02. 02 Контроль качества органических лекарственных средствСтр 1 из 9Следующая ⇒
Рабочая тетрадь По МДК 02.02 Контроль качества органических лекарственных средств Лекции (для студентов очной формы обучения)
г. Екатеринбург 2014 – 2015 уч.г. Составитель: Возякова Л.А. – преподаватель фармацевтической химии Рецензент: Щипанова Е.В. – преподаватель фармацевтической химии, заслуженный учитель России, зам. директора по УР.
Настоящее пособие составлено согласно требованиям ФГОС СПО в соответствии с учебным планом по МДК 02.02 «Контроль качества лекарственных средств» в рамках ПМ 02. «Изготовление лекарственных форм и проведение обязательных видов внутриаптечного контроля» и предназначено для самостоятельной работы студентов очно-заочной (вечерней) формы обучения на лекционных занятиях. В пособии представлены «шаблоны» лекций по анализу лекарственных средств: латинские и химические названия ЛС; молекулярная и структурная формула ЛС; подлинность (идентификация); чистота (определение примесей); количественное определение; применение; хранение. При этомрусское и латинское название, формула лекарственного средства, уравнения реакций в качественном и количественном анализе – уже напечатаны. Остальное (свойства, эффекты реакций, методики анализа, применение, условия хранения лекарственных средств) студенты записывают в тетрадях самостоятельно во время лекционного занятия, либо при работе со справочной литературой Работа в таких тетрадях экономит время, позволяет четко структурировать записи, избегать ошибок при записывании громоздких формул органических лекарственных средств, способствует более четкой организации труда.
Рассмотрено и одобрено на заседании кафедры химии и фармацевтической технологии
Протокол № ___ от «___»____________20г. СОДЕРЖАНИЕ
Спирт этиловый
Spiritus aethylicus Spiritus Vini C2H5OH этанол Свойства
Подлинность 1.
C2H5OH + CH3СОOH → CH3СОOC2H5 + Н2О 2.
C2H5OH + 4 I2 + 6 NaOH → CHI3↓ + HCOONa + 5 NaI + 5 H2O
3.
O // 3C2H5OH + K2Cr2O7 + 3 H2SO4 → 3CH3–C–H + Cr2(SO4)3 + K2SO4 + 7 H2O
Количественное определение 1. 2. 3. Метод основан на O // 3C2H5OH+2K2Cr2O7 +14HNO3→3CH3–C–OH + 4Cr(NO3)3+ 4KNO3 + 11H2O моль • = экв. K2Cr2O7 + 6 KI + 14 HNO3 → 3 I2 + 2 Cr(NO3)3 + 8 KNO3 + 7 H2O
I2 + 2 Nа2S2О3 → 2 NаI + Nа2S4О6
I2 + 2 е → 2 I- 2 S2О3 2- - 2 е → 2 S4О62- fэкв .= M1/z = Применение 1. 70%-ый спирт –
2. 40%-ый спирт – 3. 95%-ый спирт – 4. Для получения
Хранение
N.B.! Хранение спирта в аптеке регламентирует приказ № Отпуск спирта из аптеки регламентирует приказ № Анализ спирта в аптеке регламентирует приказ № (полный химический контроль проводят при приготовлении )
Раствор формальдегида Формалин Solutio Formaldehydi Formalinum O // муравьиный альдегид H – C – H метаналь Свойства
Подлинность 1. Реакции окисления (за счет альдегидной группы) а)
О О // t0 // Н – C – Н + 2[Ag(NH3)2]OH → Н – C – ONH4 + 2Ag ↓ + H2O + 3NH3↑ б)
СООNa СООNa в)
О О // // Н – С – Н + К2[HgI4] + 3КОН → Н – С – ОК + Hg↓ 4КI + 2 Н2О
2.
HOOC – – H || H – – COOH к. H2SO4 + H – C – H + → HO OH
→ → HO OH
HOOC – – CH= – COOH → HO O
3.
+ Н – C = O → + H2O | H R R
Количественное определение Метод, способ ( ГФ) Метод основан на Методика:
О О // // Н – С – Н + I2 + 3 NaОН → Н – С – ОNa + 2 NaI+ Н2О моль экв. I2 + 2 Nа2S2О3 → 2 NаI + Nа2S4О6 I2 + 2 е → 2 I- 2 S2О3 2- - 2 е → 2 S4О62- fэкв. = M1/z = Применение
Хранение
Метенамин* Гексаметилентетрамин Уротропин Methenaminum* Hexamethylentetraminum Urotropinum
CH2 CH2 CH2 N N —CH2 CH2--N (CH2)6N4 CH2 Свойства
Подлинность 1. t0 (CH2)6N4 + 2 H2SO4 + 6 H2O → 6 HCOH↑ + 2 (NH4)2SO4 (NH4)2SO4 + 2 NaOH → 2 NH3↑ + 2 H2O + Na2SO4
2. Реакция на остаток формальдегида –
t0 (CH2)6N4 + 2 H2SO4 + 6 H2O → 6 HCOH↑ + 2 (NH4)2SO4
HOOC – – H || H – – COOH к. H2SO4 + H – C – H + → HO OH HOOC – – CH2 – – COOH к.H2SO4 → → HO OH HOOC – – CH = – COOH → НО О 3. Реакции на третичный атом азота: А) - - Б) - 2 (CH2)6N4 • 3 AgNO3↓ - (CH2)6N4 • CaCl2↓ Количественное определение По ГФ Метод, вариант, способ Метод основан на Методика:
t0 (CH2)6N4 + 2 H2SO4 + 6 H2O → 6 HCOH↑ + 2 (NH4)2SO4 моль • = экв. H2SO4 + 2 NaOH → 2 H2O + Na2SO4 fэкв . = M1/z = Экспресс-анализ Метод, способ Метод основан на Методика:
(CH2)6N4 + HCl → (CH2)6N4•HCl моль экв. fэкв. = M1/z =
Применение
Хранение
Глюкоза Glucosum Глюкоза безводная Glucosum anhydricum C6H12O6 CH2OH
H C
H – C – OH HO OH H OH | HO – C – H | H OH H – C – OH | H – C – OH | CH2 – OH Свойства
Подлинность а)
С t0 Н Н –С –О (СНОН)4 +2 Сu + NaОН Cu2О + Н –С –О СН2ОН СООNa
С ОNa Н –С –ОН + (СНОН)4 + 2 Н –С –ОН СН2ОН СООNa б) в)
R - C + 2[Ag(NH3)2]OH ® RCOONH4 + 2Ag ↓ + H2O + 3NH3↑ Н г) С реактивом Несслера (щелочной раствор тетрайодомеркурат (II) калия) – осадок темно-серого цвета.
RС + К2[HgI4] + 3КОН ® RС + Hg↓ 4КI + 2Н2О Н ОК д) С концентрированной серной кислотой и тимолом – темно-красное окрашивание
Количественное определение ГФ – не дает 2. Экспресс-анализ проводят в зависимости от концентрации глюкозы в растворе: А) Если массовая доля глюкозы менее 5% Метод, способ Метод основан на
Методика:
.
R - С + I2 + 3NaОН → R - С + 2 NaI+ 2Н2О моль Н экв. ОNa
I2 + 2 Nа2S2О3 = 2 NаI + Nа2S4О6
I2 + 2 е → 2 I- 2 S2О3 2- - 2 е → 2 S4О62-
fэкв .= M1/z = Б) Если массовая доля глюкозы 5% и более - метод Применение
Хранение N.B.! В растворахглюкоза за счет альдегидной группы открытой формы способна окисляться, поэтому все растворы глюкозы для инъекций стабилизируют!!! В качестве стабилизатора применяют стабилизатор Вейбеля, который добавляют в количестве 5% от объема ЛФ, независимо от концентрации раствора. Состав стабилизатора Вейбеля: - натрия хлорида 5,2 - кислоты хлористоводородной 8,3% - 4,4 мл - воды для инъекций до 1000 мл
Если объем раствора глюкозы для инъекций 1 л и более – для стабилизации отдельно добавляют – на 1 л раствора глюкозы для инъекций: натрия хлорид – 0,26; раствор хлористоводородной кислоты 0,1М – 5 мл
Согласно требованиям Приказа № МЗ РФ все растворы для инъекций, приготовленные в аптеке подвергаются химическому контролю.
Димедрол Diphenhydramine Hydrochloride * Dimedrolum C6H5 CH3 \ / CH – O – CH2 – CH2 –N • HCl / \ C6H5 CH3 ß – диметиламиноэтилового эфира бензгидрола гидрохлорид Свойства
Подлинность 1. 2. 3. 4.
C6H5 CH3 C6H5 CH3
CH – O – CH2 – CH2 –N + H2SO4 → CH – O – CH2 – CH2 –N HSO4- / \ / | \ C6H5 CH3 C6H5 H CH3 Желтое окрашивание
\ + + / → CH – O – CH2 – CH2 –N SO42- / | / \ C6H5 H H CH3 Кирпично-красное окрашивание
5. На хлорид-ион –
R3N • HCl + AgNO3 → AgCl↓ + R3N •HNO3
6. За счет третичного атома азота: - - - Количественное определение По ГФ Метод Метод основан на Методика:
O //
\ / \ \ +/ // // CH – O – CH2 – CH2 –N • HCl + HClO4 + O → CH – O – CH2 – CH2 –N ClO4 + CH3 – C +CH3 – C / \ / / / \ \ \ C6H5 CH3 CH3 – C C6H5 H CH3 Cl ОН моль экв. \\ O
fэкв. = M1/z =
Экспресс-анализ А) Метод, вариант Метод основан на Методика:
R3N • HCl + NaOH → NaCl + R3N + H2O моль экв. fэкв . = M1/z =
Б) Метод Метод основан на Методика:
R3N • HCl + AgNO3 → AgCl↓ + R3N •HNO3 моль экв. fэкв . = M1/z =
Применение
Хранение Список Кальция глюконат Calcii gluconas
\\ / C | H – C – OH | HO – C – H Ca2+ • H2O | H – C – OH | H – C – OH | CH2 – OH 2 Свойства
Подлинность Реакции на ионы кальция А) [R – COO]2Ca + (NH4)2C2O4 ® CaC2O4↓ + 2 R – COONH4 Б) « Сухим путем» –
Реакции на глюконат-ион А)
3 [R – COO]2Ca + 2 FeCl3 ® CaCl2 + 2 [R – COO]3Fe2 Б)
Количественное определение Метод Метод основан на
Методика:
[ R – COO]2Ca + Н2Ind ↔ CaInd + 2 R – COOH CaInd + Na2H2Tr → Ca Na2Tr+ Н2Ind
fэкв .= M1/z = Применение
- - - -
Хранение Кислота аскорбиновая Acidum ascorbinicum Vitaminum C Ascorbic acid *
H | HO – CH | CH2 - OH γ-лактон-2,3-дегидро-L-гулоновой кислоты Свойства
+ NaOH → + Н2О
→
ендиольная форма кето-форма
Подлинность 1. 2. 3.
+ 2 AgNO3 → + 2 Ag↓ + 2 HNO3
4.
+ I2 → + HI
Экспресс-анализ 1.
+ 2 FeCl3 → + 2 FeCl2 + 2 HCl
2.
+ KMnO4 → + Mn2+
3.
+ O N OH→ + Cl синий
+ HO NH OH Cl Бесцветный
4. 5.
t0 + 2 HC – O → + Cu2O↓ + HC - OH \ | Cu HC -OH / | HC – O COOK | COOK 6.
7.
+ K2[HgI4] + 2 KOH → + Hg↓ + 4 KI + 2 H2O
(Реакции 5,6,7 – ) 8.
2 + 4 K3[Fe(CN)6] → 2 + 3 К4[Fe(CN)6] + H4[Fe(CN)6]
3 К4[Fe(CN)6] + 4 FeCl3 → Fe4[Fe(CN)6]3 + 12 КCl Количественное определение По ГФ Метод, способ Метод основан на
Методика:
3 + КIО3 → 3 + КI + 3 Н2О моль экв. KIO3 + 5 KI + 6 HCl → I2 + 6 KCl + 3 H2O fэкв = М1/z = Экспресс-анализ Метод, способ Метод основан на
Методика:
(NB! При титровании растворов аскорбиновой кислоты для инъекций следует учитывать восстановительную способность стабилизатора – гидросульфита натрия – поэтому перед началом титрования к такому раствору добавляют формалин, который будет связывать стабилизатор.) (NaHSO3 + HCOH → HO-CH2- O-SO2Na)
+ I2 → + HI моль экв. fэкв = М1/z = 2. Метод, вариант Способ
Метод основан на
Методика:
моль экв.
fэкв = М1/z = Применение
Хранение
.
Лекарственные средства, производные ароматических кислот Кислота бензойная. Acidum benzoicum
Свойства:
Подлинность 1.
Реакция выполняется в среде, т.к.
2.
Количественное определение Метод, вариант Способ Метод основан на Методика:
моль экв. fэкв. = M1/z = Применение
Хранение
Натрия бензоат Natrii benzoas Natrium benzoicum
С6Н5СООNa
Свойства
Подлинность Реакции на ионы натрия А) (ГФ XII) Na+ + K[Sв(OH)6] ® Na[Sв(OH)6]↓ + K+ Б) «сухим путем» – В) (ГФ XI) Zn(UO2)3(CH3COO)8 + Na+ + CH3COOH + 9 H2O ® ® NaZn[(UO2)3(CH3COO)9]9H2O↓ + H+
Г) МКС)
Реакции на бензоат-ион А)
Б)
Количественное определение Метод, вариант Способ Метод основан на Методика:
моль экв. fэкв. = M1/z =
Применение
Хранение
Кислота салициловая Acidum salicylicum
Свойства
Подлинность 1. На фенольный гидроксил –
2.
3.
CO2 + Ca(OH)2 → CaCO3 ↓ + H2O 4. 5.
Количественное определение: Метод, вариант Способ Метод основан на Методика:
- СООН - COONa + NaOH → + Н2О \ \ ОН ОН моль экв. fэкв. = M1/z =
Применение
Хранение
Натрия салицилат Natrii salicylas Natrium salicylicum
Свойства
Подлинность Реакции на ионы натрия А) (ГФ XII) Na+ + K[Sв(OH)6] ® Na[Sв(OH)6]↓ + K+ Б) «сухим путем» – В) (ГФ XI) Zn(UO2)3(CH3COO)8 + Na+ + CH3COOH + 9 H2O ® ® NaZn[(UO2)3(CH3COO)9]9H2O↓ + H+ Г) МКС)
На салицилат-ион А) На фенольный гидроксил –
Б)
+ HNO3 → ↓ + NaNO3 \ \ ОН ОН
Количественное определение Метод, вариант способ Метод основан на Методика:
моль экв. fэкв. = M1/z = Применение
Хранение
Кислота ацетилсалициловая Acidum acetylsalicylicum Aspirinum
Свойства
Подлинность 1.
Наличие салициловой кислоты подтверждается
Наличие уксусной кислоты подтверждается
2.
Образующуюся салициловую кислоту определяют
3. Количественное определение Метод, вариант Способ Метод основан на Методика:
моль экв. fэкв. = M1/z = Применение
Хранение Сводная таблица по ароматическим кислотам, фенолокислотам и их производным
Эфедрина гидрохлорид Ephedrini hydrohcloridum Ephedrine Hydrochloride *
CH – CH – NH • HCl | | | OH CH3 CH3 l - эритро-2-метиламино-1-фенилпропанола-1 гидрохлорид Свойства
Подлинность 1. 2. 3. 4. R3N • HCl + AgNO3 → AgCl ↓ + R3N • HNO3 5.
2 CH – CH – NH • HCl + CuSO4 + NaOH → Na2SO4 + 2 H2O + | | | OH CH3 CH3
+ CH – CH – NH Cu | | | O- CH3 CH3 2 6.
K3[Fe(CN)6] CH – CH – NH → C = O↑ + CH3 – CH2 – NH | | | | | OH CH3 CH3 H CH3
Количественное определение По ГФ Метод, вариант Метод основан на Методика:
CH3 – C = O
CH – CH – NH • HCl + HClO4 + O → | | | / OH CH3 CH3 CH3 – C = O Моль экв.
+ → CH – CH – NH2 ClO4- + CH3 – C = O + CH3 – C = O | | | | | OH CH3 CH3 Cl OH
fэкв. = M1/z = Экспресс-анализ 1. Метод, вариант Метод основан на Методика:
R3N • HCl + NaOH → NaCl + R3N + H2O моль экв. fэкв. = M1/z = Метод Метод основан на Методика:
R3N • HCl + AgNO3 → AgCl↓ + R3N •HNO3 моль экв. fэкв. = M1/z = Применение Хранение Список
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-17; просмотров: 247; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.15.219.217 (0.723 с.) |
 СООК СООК
СООК СООК O O
O O
 // Н –С –О t0 // Н –С –ОН
// Н –С –О t0 // Н –С –ОН

 H – C – H +2 Сu + NaОН Cu2О↓ + H – C – ONa + 2
H – C – H +2 Сu + NaОН Cu2О↓ + H – C – ONa + 2
 O
O

 HOOC – – CH2 – – COOH к.H2SO4
HOOC – – CH2 – – COOH к.H2SO4
 NH2 N=CH2
NH2 N=CH2
 N
N O
O O H
O H O \\ /
O \\ /
 О СООК
О СООК О СООК
О СООК О t0
О t0 О О
О О О О
О О \ / \ + /
\ / \ + / C6H5 CH3
C6H5 CH3 C6H5 CH3 CH3 – C C6H5 CH3 O O
C6H5 CH3 CH3 – C C6H5 CH3 O O O O-
O O-
 ОН ОН ОNa ОН
ОН ОН ОNa ОН ОН ОН [O] О О
ОН ОН [O] О О ОН ОН О О
ОН ОН О О ОН ОН О О
ОН ОН О О ОН ОН Cl О О
ОН ОН Cl О О Cl
Cl ОН ОН COONa О О COONa
ОН ОН COONa О О COONa





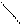
 + 2 [Ag(NH3)2]OH → + 2 Ag↓ + 4 NH3↑ + 2 H2O
+ 2 [Ag(NH3)2]OH → + 2 Ag↓ + 4 NH3↑ + 2 H2O ОН ОН О О
ОН ОН О О


 + NaOH → + Н2О
+ NaOH → + Н2О С6Н5- СООН
С6Н5- СООН

 Натриевая соль бензойной кислоты.
Натриевая соль бензойной кислоты.





 Натриевая соль салициловой кислоты
Натриевая соль салициловой кислоты - СООNa - COOН
- СООNa - COOН
 Салициловый эфир уксусной кислоты
Салициловый эфир уксусной кислоты








 to, NaOH,
to, NaOH,



