
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Характеристика чувствительности. ⇐ ПредыдущаяСтр 4 из 4
Важно знать предел чувствительности – предел обнаружения вещества в граммах. С помощью вышеперечисленных методов анализа можно обнаружить количество вещества: - при фотометрии 1·10-6 г - при флюрометрии 1·10-10г - при полярографии 1·10-8 г - при эмиссионном спектральном анализе 1·10-10г. Спектр. Спектр – (от лат. spectrum – представление) – совокупность различных значений, которые может принимать данная физическая величина. Спектр может быть непрерывным и дискретным. Спектры используют как для качественного (идентификация веществ), так и для количественного (определения содержания вещества) анализа.
Важнейшей характеристикой является количество поглощённой энергии, которая зависит от концентрации вещества. Интенсивность поглощения света веществом зависит от числа молекул в растворе.
Закон Бугера (1729), Ламберта (1760) и Бера (1852) гласит: Растворы одного и того же окрашенного вещества при одинаковой концентрации вещества и толщине слоя раствора поглощают равное количество световой энергии (светопоглощение таких растворов одинаковое).
I – интенсивность света I0 – интенсивность исходного источника ε – коэффициент поглощения l – толщина слоя раствора c – концентрация вещества
D – оптическая плотность раствора Спектральные приборы предназначены для качественного и количественного анализа веществ на основании измерения и исследования их спектров в оптическом диапазоне длин волн (10-3 – 103 мкм) (рис. 1).
Рис. 1. Схема электрофотокалориметра.
Для получения эмиссионных спектров используют установки: ИСП 28-30-51, ДСФ 8-452, спектрометр СФ-46, одноканальные спектральные приборы и многоканальные (рис. 2).
Рис. 2. После проявки получается снимок с изображением спектра разной интенсивности, т.к. исходное вещество состояло и различных элементов.
Лекция 5. Комплексометрия. Комплексометрия основана на реакциях образования комплексов. В самом общем смысле под комплексом (комплексным соединением) в химии понимают сложную частицу, состоящую из составных частей, способных к автономному существованию. Можно отметить основные признаки, позволяющие выделить комплексные соединения в особый класс химических соединений:
- способность отдельных составных частей к самостоятельному существованию; - сложность состава; - частичная диссоциация на составные части в растворе по гетеролитическому механизму; - наличие положительно заряженной центральной частицы – комплексообразователя (обычно это ион металла), связанной с лигандами; - наличие определенной устойчивой пространственной геометрии расположения лигандов вокруг комплексообразователя. Примеры: Комплекс Составные части Ni(NH3)62+ Ni2+, NH3 [Co(NH3)6]SO4 [Co(NH3)6]2+, SO42-, Co2+, NH3
Основой комплексного соединения является донорно-акцепторная связь. KAl(SO4)2 MgCa(CO3)2 MgCO3ּCaCO3 KCN – цианистый калий Fe(CN)3 – цианид железа 3KCN+Fe(CN)3 → K3[Fе(CN)6] – гексоцианоферрат калия
K – C ≡ N
C ≡ N
K+ K+ NC CN NC Fe+3 CN NC CN K+ K+
Лиганды («зубчатые структуры») могут быть бидентатными, монодентатными, полидентатнами. Дентатностью называется число донорных атомов лиганда, образующих координационные связи с центральным атомом. Известно много монодентатных неорганических и органических лигандов, однако их применению в комплексометрии препятствует то, что ступенчатые константы устойчивости соответствующих комплексов мало различаются между собой. Поэтому при увеличении количества добавленного лиганда концентрация ионов металла изменяется постепенно и кривая титрования не имеет скачка. Хелаты (хело-«клешня») – соединения, которые охватывают центральный ион. Важнейшая особенность хелатов – их повышенная устойчивость по сравнению с аналогично построенными нециклическими комплексами. Именно поэтому полидентатные лиганды и хелатные комплексы нашли широкое применение в аналитической химии. Скорость комплексообразования имеет большое значение в аналитической химии. Например, при прямом комплексонометрическом титровании реакция определяемого иона с титрантом должна протекать практически мгновенно, иначе индикация конечной точки титрования существенно затрудняется.
Устойчивость комплекса определяется как фундаментальными факторами (природой комплексообразователя и лигандов), так и внешними условиями (температурой, природой растворителя, ионной силой, составом раствора). Трилон Б в комплексометрии используют для определения металлов в водных растворах. Прямым титрованием можно обнаружить: Ba,Ca,K,In,Mg,St,Zn,Cd. Методом обратного титрования: Al‚Bi‚Со,Cr‚Fe‚Mn‚Pt, Sc. Трилон Б используется для аналитических определений жесткости воды. Mg(HCO3)2 Ca(HCO3)2 Комплексометрия, как метод анализа, используется в абсолютном большинстве предприятий, где нужно анализировать состав шлака, сплавов, различных добавок.
|
|||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-07; просмотров: 197; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.8.42 (0.009 с.) |




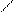 C ≡ N
C ≡ N Fe – C ≡ N
Fe – C ≡ N MgCO3↓ +CO2↑ +H2O
MgCO3↓ +CO2↑ +H2O


