
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Электрохимические процессы и системы ⇐ ПредыдущаяСтр 3 из 3
Уравнение Нернста:
где jMe — электродный потенциал металла; j°Me — стандартный электродный потенциал металла; R — универсальная газовая постоянная; T — абсолютная температура; n — число электронов, участвующих в реакции; Объединенный закон Фарадея:
где m — масса полученного в результате электролиза вещества, M — его молярная масса, I — сила тока, t — время, n — число электронов, участвующих в реакции, F — постоянная Фарадея. 9.1. Вычислите электродные потенциалы металлов, находящихся
9.2. Напишите уравнения электродных реакций на катоде и аноде и
9.3. Каковы катодные и анодные процессы (угольный анод)
9.4. Напишите уравнения электродных процессов на катоде и аноде, 9.4.1. Через водный раствор Cr(NO3)3 пропускали в течение 10 минут постоянный ток силой 15 А (анод хромовый, выход металла по току — 30%) 9.4.2. Через водный раствор AgNO3 пропускали в течение 15 минут постоянный ток силой 8 А (анод серебряный) 9.4.3. Через водный раствор CuSO4 пропускали в течение 40 минут постоянный ток силой 1,8 А (анод графитовый) 9.4.4. Через водный раствор FeSO4 пропускали в течение 1 часа постоянный ток силой 3 А (анод графитовый, выход металла по току — 50%) 9.4.5. Через расплав MgCl2 пропускали в течение 30 минут постоянный ток силой 10 А (электроды графитовые) 9.4.6. Через расплав NaOH пропускали в течение 25 минут постоянный ток силой 3 А (анод графитовый) 9.4.7. Через водный раствор NaOH пропускали в течение 2 часов постоянный ток силой 2 А (электроды стальные) 9.4.8. Через водный раствор CuSO4 пропускали в течение 5 минут постоянный ток силой 2 А (анод медный) 9.4.9. Через расплав AlCl3 пропускали в течение 1 часа постоянный ток силой 100 А (электроды графитовые) 9.4.10. Через водный раствор NiSO4 пропускали в течение 30 минут постоянный ток силой 2,5 А (анод никелевый, выход металла по току — 60%) 9.4.11. Через водный раствор AgNO3 пропускали в течение 10 минут постоянный ток силой 5 А (анод серебряный) 9.4.12. Через водный раствор Na2SO4 пропускали в течение 20 минут постоянный ток силой 6 А (электроды стальные) 9.4.13. Через водный раствор CdSO4 пропускали в течение 20 минут постоянный ток силой 2,5 А (анод кадмиевый, выход металла по току — 45%) 9.4.14. Через расплав CaCl2 пропускали в течение 30 минут постоянный ток силой 10 А (электроды графитовые) 9.4.15. Через расплав MgCl2 пропускали в течение 30 минут постоянный ток силой 3 А (анод графитовый) 9.4.16. Через водный раствор KNO3 пропускали в течение 25 минут постоянный ток силой 3,5 А (анод графитовый) 9.4.17. Через водный раствор CaI2 пропускали в течение часа постоянный ток силой 0,5 А (электроды графитовые)
9.4.18. Через расплав LiCl пропускали в течение 30 минут постоянный ток силой 2 А (электроды графитовые) 9.4.19. Через водный раствор SnCl2 пропускали в течение 50 минут постоянный ток силой 1,8 А (анод оловянный, выход металла по току — 80%) 9.4.20. Через водный раствор LiOH пропускали в течение 45 минут постоянный ток силой 0,8 А (электроды стальные) 9.5. Напишите уравнения, отражающие анодный и катодный процессы при электрохимической коррозии в указанных ниже системах: 9.5.1. Оцинкованное железо в щелочной среде при нарушении целостности покрытия 9.5.2. Сплав хром-никель в кислой среде 9.5.3. Хромированное железо в морской воде при нарушении целостности покрытия 9.5.4. Луженое железо в воде при нарушении целостности покрытия 9.5.5. Луженая медь в растворе соляной кислоты при нарушении целостности покрытия 9.5.6. Луженое железо в растворе соляной кислоты при нарушении целостности покрытия 9.5.7. Сплав марганец-никель в кислой среде 9.5.8. Никелированное железо в морской воде при нарушении целостности покрытия 9.5.9. Кадмированное железо в кислой среде при нарушении целостности покрытия 9.5.10. Латунь (сплав меди с цинком) в кислой среде 9.5.11. Углеродистая сталь в кислой среде 9.5.12. Железо, контактирующее с магнием в щелочной среде 9.5.13. Интерметаллический сплав Mg2Sn в кислой среде; 9.5.14. Алюминиевое изделие с медными заклепками во влажной атмосфере; 9.5.15. Стальной корпус корабля с магниевым протектором в морской воде; 9.5.16. Никелированное железо в растворе соляной кислоты при нарушении целостности покрытия 9.5.17. Оцинкованное железо в растворе соляной кислоты при нарушении целостности покрытия 9.5.18. Стальная нефтяная вышка с магниевым протектором в морской воде 9.5.19. Сталь, легированная хромом, в морской воде 9.5.20. Хромированное железо в кислой среде при нарушении целостности покрытия Примеры решения типовых задач 1.3.3
Для получения 142 г Na2HPO4 нужно взять 80 г NaOH; для получения 1 г Na2HPO4 нужно взять x г NaOH:
Для получения 142 г Na2HPO4 нужно взять 98 г H3PO4; для получения 1 г Na2HPO4 нужно взять y г H3PO4:
Ответ. Для получения 1 г гидрофосфата натрия нужно взять 0,56 г гидроксида натрия и 0,69 г фосфорной кислоты. 2.3.2
Ответ. K2MnO4. 3.3.5 При составлении уравнений ядерных реакций соблюдается равенство суммы зарядов и массовых чисел в левой и правой частях уравнения. При этом заряд электрона учитывается со знаком минус, протона и позитрона — со знаком плюс. Нейтрон и гамма-квант заряда не имеют. Кроме того, массы электронов, позитронов и гамма-квантов не учитываются. Сумма зарядов частиц в левой части уравнения: 92 + 0 = 92 (нейтрон заряда не имеет), значит, ядро нового элемента имеет заряд 92 – 56 = 36 (криптон). Сумма массовых чисел частиц в левой части уравнения: 235 + 1 = Ответ. 4.4.9 Найдем при помощи справочных данных изменения энтальпии и энтропии реакции при стандартных условиях:
D H (реакции) = 2×(–241,8) = –483,6 (кДж);
D S (реакции) = 2×188,7 – 2×130,5 – 205 = –88,6 (Дж/К); T = D H /D S = 483600 / 88,6 = 5460 (K). Ответ. 5460 К. 5.2.3 Используем правило Вант-Гоффа: Ответ. Скорость реакции увеличится в 243 раза. 5.4.5 2NO2 Равновесная концентрация [NO] = 0,024 M, значит, равновесная концентрация кислорода в два раза меньше: [O2] = 0,012 М.
Учитывая, что стехиометрические коэффициенты перед NO2 и NO одинаковы, [NO2]0 = 0,006 + 0,024 = 0,030 (моль/л). Ответ. Ke = 0,192 моль/л, [NO2]0 = 0,030 М. 6.2.5 Масса полученного раствора m = 70 + 50 = 120 (г). Масса растворенного вещества m 2 = 0,40×70 + 0,15×50 = 35,5 (г). Массовая доля растворенного вещества wm = Масса растворителя m 1 = 120 – 35,5 = 84,5 (г). Моляльная концентрация Ответ. wm = 29,6%; cm = 12,4 моль/кг. 6.3.5 n1 = 50/18 = 2,778 (моль); n2 = 4,5/176 = 0,026 (моль);
Ответ. D P / P 0 = 0,0093 7.4.9 Так как для сероводородной кислоты Ka 1 = 10–7, то используем приближенную запись закона разбавления Оствальда:
Ответ. a = 0,18%. 7.5.3 3Pb(NO3)2 + 2Na3PO4 = Pb3(PO4)2¯ +6NaNO3 3Pb2+ + 6NO3– + 6Na+ + 2PO43– = Pb3(PO4)2¯ + 6Na+ + 6NO3– 3Pb2+ + 2PO43– = Pb3(PO4)2¯ ПР = [Pb2+]3×[PO43–]2 При смешении равных объемов растворов концентрация каждого из них уменьшается в два раза. K’ = 0,000053×0,000052» 3×10–22 K’ > ПР, значит, выпадает осадок. Ответ. Выпадает осадок Pb3(PO4)2. А Запишем стандартные восстановительные потенциалы электрохимических систем, участвующих в реакции: Fe3+ + 2I– Ок-ль Fe3+ + Вост-ль I2+ 2 Поскольку j°ок > j°вос, то окислителем является ион Fe3+, а восстановителем — ион I–, т.е. реакция протекает слева направо. Ответ. В стандартных условиях указанная реакция протекает слева направо. 9.2.6 Найдем значения электродные потенциалов:
Т.к. jFe > jCd, то на аноде окисляется кадмий, на катоде восстанавливаются ионы железа. Е = –0,47 – (–0,52) = 0,05 (В). Ответ. Е = 0,05 В. 9.4.3 K(–): Mg2+ +2 A(+): 2Cl– = Cl2 + 2 Масса магния, выделившаяся на катоде:
Ответ. m = 2,27 г.
Примеры задач повышенной трудности 11.1 ( Всероссийская олимпиада среди технических вузов, 1999 г.) Негашеную известь получают в шахтных печах, загружая в них шихту, состоящую из смеси угля с известняком. В каком соотношении следует смешать эти вещества, чтобы процесс протекал без подвода тепла извне? При расчете необходимо учесть, что потери теплоты составляют 40%.
11.2 (Всероссийская олимпиада среди технических вузов, 1999 г.) При коррозии железа, покрытого кадмием, в кислой среде работает гальванический элемент: Fe | 0,1 М Fe2+, 1 М HCl | Cd Определить, как изменится ЭДС гальванического элемента вследствие поляризации электродов, если концентрация ионов Fe2+ возросла до 0,15 моль/л и перенапряжение водорода составляет 0,08 В (j°(Fe2+/Fe) = –0,44 В). Написать процессы, происходящие на аноде и на катоде, показать характер поляризационных кривых. 11.3 (олимпиада КГТУ, 1999 г.) Ученые обнаружили параллельную Вселенную, в которой некоторые физические законы отличаются от нашей Вселенной. Так, там выполняются принцип запрета Паули, правила Гунда и Клечковского, но электроны подчиняются следующим ограничениям на квантовые числа: n > 0; l = 0, 1, …, (n – 1); m = +1 или –1; s = +1/2 или –1/2. Какие порядковые номера имеют в параллельной Вселенной первые два «инертных газа»? 11.4 (олимпиада КГТУ, 1999 г.) Граната Ф1 состоит из оболочки массой 300 г и заряда тринитротолуола (C7H5N3O6) массой 80 г. Теплота взрыва ТНТ составляет 4190 кДж/кг, взрыв происходит без доступа воздуха. В кинетическую энергию осколков (средняя масса осколка 10 г) переходит 0,1% энергии взрыва. Запишите уравнения реакций взрыва и горения ТНТ. На какую максимальную высоту поднимется осколок, если он взлетает вертикально, а сопротивление воздуха пренебрежимо мало?
11.5 (Республиканская олимпиада школьников, 1998 г.) Д.И. Менделеевым была предложена формула для расчета теплового эффекта сгорания угольного и нефтяного топлива: Qp = 81×C + 246×H – 26(O – S) [ккал/кг], где Qp — удельная рабочая теплота сгорания теплота топлива, определенная при условии, что вода, образовавшаяся при сгорании топлива и влага, содержавшаяся в топливе, полностью сконденсированы, С — массовая доля углерода в топливе (выраженная в %), Н — массовая доля водорода, О — массовая доля кислорода, S — массовая доля серы. а. Используя формулу Менделеева, рассчитайте удельную рабочую теплоту сгорания эталонной смеси, соответствующей бензину с октановым числом 92 (плотность смеси, а также плотности ее компонентов равны 0,69 г/см3). б. Расчет по формуле Менделеева менее точен, чем расчет теплоты реакции по термохимическим уравнениям, однако в промышленности она используется до сих пор. Объясните, почему. 11.6 (Соросовская олимпиада школьников, 1999 г.) Соединение X, образованное элементами № 1 и 7, реагирует с соединением Y, образованным элементами № 7 и 8. 1. Напишите возможные уравнения реакций (не более 5). 2. Какая пара X–Y больше всего подходит для использования в качестве ракетного топлива? Обоснуйте Ваш ответ.
Литература 1. Дикерсон Р., Грей Г., Хейт Дж. Основные законы химии. В 2-х т. — 2. Зайцев О.С. Общая химия. Состояние веществ и химические реакции. — М.: Химия, 1990. — 352 с. 3. Общая химия // под ред. Е.М. Соколовской, Г.Д. Вовченко, Л.С. Гузея. — М.: Изд-во Моск. ун-та, 1980. — 726 с. 4. Коровин Н.В. Курс общей химии — М.: Высш. шк., 2003.-557 с.
5. Харин А.Н., Катаева Н.А., Харина Л.Т. Курс химии — М.: Высш. шк., 1983. — 511 с. 6. Лучинский Г.П. Курс химии — М.: Высш. шк., 1985. — 416 с. 7. Фролов В.В. Химия — М.: Высш. шк., 1986. — 540 с. 8. Курс химии / Под ред. Г.А.Дмитриева, Г.П. Лучинского, В.И. Семишина. — 2-е изд., испр. — Т. 1. — М.: Высш. шк., 1972. — 309 с. 9. Курс химии / Под ред. И.В. Кротова и К.А.Дулицкой — Т. 2. — М.: Высш. шк., 1971. — 208 с. 10. Глинка Н.Л. Общая химия. — Л.: Химия, 1986. — 703 с. 11. Глинка Н.Л. Задачи и упражнения по общей химии. — Л.: Химия, 1983. — 12. Справочник химика, Т. 1–6. — Л: Химия, 1963–1967 гг. 13. Химическая энциклопедия. Т. 1–5. – М.: Сов. энциклопедия, 1969–1971 гг. 14. Гороновский И.Т., Назаренко Ю.П., Некряч Е.Ф. Краткий справочник по химии — Киев: Наукова думка, 1974. — 992 с. 15. Лурье Ю.Ю. Справочник по аналитической химии — М.: Химия, 1971. — 456 с. 16. Гордон А., Форд Р. Спутник химика. — М.: Мир, 1976. — 544 с. 17. Рябин В.А. Термодинамические свойства веществ: Справочник — 18. Химия: Справочное руководство. // Пер. с нем. — Л: Химия, 1975. — 19. Мини-справочник по общей химии. — Казань: Экоцентр, 1997. — 54 с. 20. Практикум по общей химии // под ред. А.Н. Глебова — Казань: Экоцентр, 2003 — 88 с. 21. Курс лекций по общей химии // под ред. редакцией проф. А.Н. Глебова. – 3-е изд., перераб. и доп. – Казань: «Экоцентр», 2005. — 134 с.
ОГЛАВЛЕНИЕ
Сборник контрольных работ по курсу общей химии: Учебное пособие для студентов всех форм обучения/Под редакцией проф. А.Н. Глебова. – 3-е изд., перераб. и доп. – Казань: «Экоцентр», 2006. – 44 стр.
Издательство «Экоцентр» Лицензия Минпечати РТ № 0307 от 8.06.2000 Без объявл. – 2006 Отпечатано с готового оригинал-макета. Печать RISO. Бумага офсет 1. Формат 60*84 1/16. Объем 2,75 п.л. Тираж 500 экз. Заказ 4. Отпечатано на полиграфическом участке издательства «Экоцентр» г. Казань, ул. Четаева, 18.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-06; просмотров: 982; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.226.105 (0.112 с.) |
 ,
, ,
, , x = 80:142 = 0,56 (г).
, x = 80:142 = 0,56 (г). , y = 98:142 = 0,69(г).
, y = 98:142 = 0,69(г). .
.
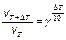 .
.  .
. 0,192 (моль/л).
0,192 (моль/л). = 29,6%.
= 29,6%. (моль/кг).
(моль/кг). .
. или 0,18%.
или 0,18%. = Fe2+ j°1 = 0,77 В;
= Fe2+ j°1 = 0,77 В; (В);
(В); (В).
(В). (г).
(г).


