
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Условия стандартного состояния веществСтр 1 из 4Следующая ⇒ ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
Изучает энергетические эффекты химических реакций, устанавливает возможность и пределы самопроизвольного (без затраты работы) их протекания. Основные понятия Объект изучения - система:
В зависимости от характера взаимодействия систем с окружающей средой
Гомогенная система:
Гетерогенная система:
Фаза:
Параметры системы:
Равновесное состояние системы:
Термодинамические свойства системы являются функциями состояния:
Термодинамический процесс
Химическая реакция
Процессы: изотермические - Т = const изобарически е – p = const изохорические- v= const адиабатические -нет обмена теплом с окружающей средой. Химические реакции наиболее часто протекают: 1)в изобарно-изотермических условиях (р =const, Т =const) (открытые системы); 2)в изохорно-изотермических условиях (V =const, Т =const) (закрытые сосуды). Первое начало термодинамики переход системы из состояния 1 в состояние 2:
Система - 1) производит работу (или над нею совершается работа) – W; 2) принимает участие в теплообмене с окружающей средой (выделяет или поглощает теплоту) - Q. По закону сохранения энергии: Q= DU + W, (1) «энергия» - 1864г. Клаузиус Q – количество сообщенной системе теплоты; D U = U2 – U1 – приращение внутренней энергии; W – суммарная работа, совершенная системой. Внутренняя энергия
U - функция состояния системы. Q – не функция состояния системы. Пусть - только PDV- работа, совершаемая системой против сил внешнего давления Для бесконечно малых элементарных процессов уравнение принимает вид: d Q = dU + PdV (2) Уравнения (1и 2)- первый закон термодинамики. А) изохорный процесс – V = const, dV = 0. работа расширения системы dW = PdV = 0. первый закон термодинамики: d QV = dU и QV = U2 – U1 = DU при данных условиях - QV - функция состояния, т.е. не зависит от пути процесса. Б) изобарный процесс - P= const PdV = d(PV) dQp = dU + d(PV) = d(U + PV) = dH Qp = H2 – H1 = D H H = U + PV - энтальпия – функция состояния «энтальпия» - 1909г. Оннес
Для идеальных газов: p ∆ V = ∆ν RT, ∆ν – разница между числом молей газообразных продуктов и исходных веществ. связь между Qp и Qv: Qp = Qv + ∆ν RT Термохимические процессы. Термохимия - часть термодинамики, изучающая тепловые эффекты процессов. Термохимические уравнения - химические уравнения реакций, в которых указаны агрегатные состояния веществ и тепловые эффекты. Химические реакции - изобарические условия Qp = H2 – H1 = D r H - энтальпия реакции
Если вещества находятся в стандартном состоянии
– стандартная энтальпия реакции- Δ rНо
Задача Рассчитать ∆ rH 0298 и ∆ rH 01000 реакции С(к) + СО2(г) = 2СО(г), считая постоянными теплоемкости реагентов в данном температурном интервале. Решение. ∆ rН 0 Т = ∆ rН 0298 + ∆ rС 0 р (Т - 298) По табличным данным: Вещество: Δ fН 0298,кДж/моль С0р 298,Дж/моль.К С(графит) 0 8,54 СО2 (г) -393,5 37,41 СО (г) -110,5 29,14
Δ rН 0298 = 2Δ fН 0298 СОг - Δ fН 0298 Ск - Δ fН 0298 СО2г = = 2(-110,5) – 0 – (-393,5) = 172,5 кДж. Δ rН 0298 >0 - реакция эндотермическая.
Изменение теплоемкости системы: ∆ rС 0 р = 2 С 0 р 298СОг– С 0 р 298Ск– С 0 р 298СО2г= = 2 . (29,14)–8,54–37,41 =12,33 Дж/К.
∆ rН 01000 = 172,5 + 12,33.10-3.(1000 - 298) = 181,16 кДж.
При изменении температуры на 702К увеличение теплового эффекта составляет 5%. Задача. Рассчитать изменение внутренней энергии системы при изохорно-изотермическом протекании реакции С(к) + СО2(г) = 2СО(г) при 298К. Решение. Qp = Qv + ∆ν RT, QV = DU, Qp = D H, ∆ν = 2 - 1=1 ∆ rU 0298 = ∆ rH 0298 –∆ν RT = 175,2 – 1.8,31 . 298 . 10-3 = 172,7 кДж. Задача. Определить ∆ rH 0298 реакции (1) С(к) + СО2(г) = 2СО(г), если известно: (2) 2С(к) + О2(г) = 2СО(г), ∆ rH 0298 = -221 кДж (3) 2СО(г) + О2(г) = 2СО2(г), ∆ rH 0298 = -566,1 кДж. Решение. К термохимическим уравнениям можно применять любые алгебраические действия. ур.1 = ½(2С(к)+ О2(г)) - ½(2СО(г) + О2(г)) =½×2СО(г) - ½×2СО2(г) ∆ rH 01 = ½ (∆ rH 02 - ∆ rH 03) = ½[-221 – (-566,1)] = 172,5 кДж.
Энергия превращение
Состояние системы можно охарактеризовать микросостояниями составляющих ее частиц, т.е. их мгновенными координатами и скоростями различных видов движения в различных направлениях. Термодинамическая вероятность W:
Чем больше число микросостояний, тем более вероятна реализация состояния. S = k lnW S -энтропия:
k –постоянная Больцмана k = R/N =1.38×10-23 Дж/К 3-ий закон термодинамики (1911г. М. Планк):
W = 1, S = 0 При плавлении – S1- увеличивается При испарении – S 2 –увеличивается S 2 > S1 Акрист ® Ааморф DS > 0
S 0298(O2) = 205 Дж/(моль·К) состава молекул S 0298(O3) = 238,8 Дж/(моль·К) S вещества растет с ростом температуры и скачкообразно увеличивается в точках фазовых переходов
Тпл Ткип Т S – функция состояния системы 2–ой закон термодинамики:
D S (процессов) > 0 – переход из более упорядоченного состояния в менее упорядоченное - самопроизвольное протекание процесса вероятно (расширение газов, плавление, растворение). D S (процессов) < 0 – самопроизвольно маловероятно (сжатие газов, конденсация) Стандартная энтропия – S 0 (Дж/моль×К)- Задача. Рассчитать ∆ rS0Т реакции: С(к) + СО2(г) = 2СО(г) при 298К и при 1000К, считая Сp(i) =const в рассматриваемом температурном интервале. Решение. Вещество S 0298,Дж/(моль.K) С0р 298,Дж/(моль.К) С(графит) 5,74 8,54 СО2 (г) 213,68 37,41 СО (г) 197,54 29,14 Δ rS 0298 =2 S 0298,СОг - S 0298,Ск - S 0298,СО2г = 2(197,54)–5,74–213,68=175,66 Дж/K.
∆ rС 0 р = 2 С 0 р 298СОг– С 0 р 298Ск– С 0 р 298СО2г= = 2 . (29,14)–8,54–37,41 =12,33 Дж/К. ∆ rS0 1000 = ∆ r S 0298 + ∆ rС 0 р ln 175,66+12,33ln(1000/298)=175,66+14,93=190,59 Дж/К. Увеличение энтропии, обусловленное ростом суммарной теплоемкости системы, при изменении температуры на 702К составляет около 8,5%.
С(графит) 298 - 2300 СО2 (г) 298 - 2500 СО (г) 298 – 2500 Как следует из полученных данных, искомой областью температур, в которых возможно самопроизвольное протекание данной реакции при стандартных состояниях, является интервал 982÷2300 К. Пример 10. Рассчитайте стандартную энергию Гиббса химической реакции (1) С(к) + СО2(г) = 2СО(г) при 298 К, если известны значения энергии Гиббса следующих реакций: (2) С(к) + О2(г) = СО2(г) ∆ rG0298 = -394,37 кДж (3) Fe(к) + CО2(г) = FeO(к) + CO(г) ∆ rG0298 = 12,92 кДж (4) 2Fe(к) + O2(г)= 2FeO(к) ∆ rG0298 = -488,6 кДж Решение. Согласно закону Гесса, энергия Гиббса реакции не зависит от числа промежуточных стадий и веществ, в результате которых получена эта реакция. Для того, чтобы получить уравнение реакции (1), нужно сложить уравнение реакции (2) и удвоенное уравнение реакции (3) и вычесть уравнение реакции (4). Для определения энергии Гиббса реакции (1) те же действия нужно проделать со значениями ∆rG0298 соответствующих реакций. Тогда ∆ rG0 1 =∆ rG0 2 + 2∆ rG0 3 -∆ rG0 4 =-394,37 + 2(12,92) –(-488,6)=120,1кДж, что совпадает со значением рассчитанным в примере 7. ХИМИЧЕСКОЕ РАВНОВЕСИЕ
ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
Изучает энергетические эффекты химических реакций, устанавливает возможность и пределы самопроизвольного (без затраты работы) их протекания. Основные понятия Объект изучения - система:
В зависимости от характера взаимодействия систем с окружающей средой
Гомогенная система:
Гетерогенная система:
Фаза:
Параметры системы:
Равновесное состояние системы:
Термодинамические свойства системы являются функциями состояния:
Термодинамический процесс
Химическая реакция
Процессы: изотермические - Т = const изобарически е – p = const изохорические- v= const адиабатические -нет обмена теплом с окружающей средой. Химические реакции наиболее часто протекают: 1)в изобарно-изотермических условиях (р =const, Т =const) (открытые системы); 2)в изохорно-изотермических условиях (V =const, Т =const) (закрытые сосуды). Первое начало термодинамики переход системы из состояния 1 в состояние 2:
Система - 1) производит работу (или над нею совершается работа) – W; 2) принимает участие в теплообмене с окружающей средой (выделяет или поглощает теплоту) - Q. По закону сохранения энергии: Q= DU + W, (1) «энергия» - 1864г. Клаузиус Q – количество сообщенной системе теплоты; D U = U2 – U1 – приращение внутренней энергии; W – суммарная работа, совершенная системой. Внутренняя энергия
U - функция состояния системы. Q – не функция состояния системы. Пусть - только PDV- работа, совершаемая системой против сил внешнего давления Для бесконечно малых элементарных процессов уравнение принимает вид: d Q = dU + PdV (2) Уравнения (1и 2)- первый закон термодинамики. А) изохорный процесс – V = const, dV = 0. работа расширения системы dW = PdV = 0. первый закон термодинамики: d QV = dU и QV = U2 – U1 = DU при данных условиях - QV - функция состояния, т.е. не зависит от пути процесса. Б) изобарный процесс - P= const PdV = d(PV) dQp = dU + d(PV) = d(U + PV) = dH Qp = H2 – H1 = D H H = U + PV - энтальпия – функция состояния «энтальпия» - 1909г. Оннес
Для идеальных газов: p ∆ V = ∆ν RT, ∆ν – разница между числом молей газообразных продуктов и исходных веществ. связь между Qp и Qv: Qp = Qv + ∆ν RT Термохимические процессы. Термохимия - часть термодинамики, изучающая тепловые эффекты процессов. Термохимические уравнения - химические уравнения реакций, в которых указаны агрегатные состояния веществ и тепловые эффекты. Химические реакции - изобарические условия Qp = H2 – H1 = D r H - энтальпия реакции
Если вещества находятся в стандартном состоянии
– стандартная энтальпия реакции- Δ rНо
Условия стандартного состояния веществ
В термохимических уравнениях допустимы дробные стехиометрические коэффициенты: Н2(г) + 1/2О2(г) = Н2О(ж); Δ rН о298 = -285,84 кДж
Если Δ rН <0 - экзотермическая реакция Если Δ rН >0 - эндотермическая реакция.
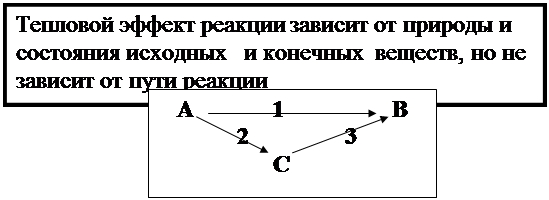
Тепловой эффект реакции зависит от температуры Þ указывают температуру Dr Н т или Dr Н от, например Dr Н 298 или Dr Н о298. Закон Гесса ( 1841 г. русский уч.Г.И.Гесс)
Dr Н т (1) = Dr Н т (2) + Dr Н т(3) Например: СН4 + 2О2 = СО2 + 2Н2О (г), Dr Н °298 = – 802,34 кДж. Эту же реакцию можно провести через 2 стадии: 1. СН4 + 3/2О2 = СО + 2Н2О (г), Dr Н °1 = – 519,33 кДж, 2.СО + 1/2О2 = СО2, Dr Н °2 = – 283,01 кДж, Dr Н °=Dr Н °1+Dr Н °2=(–519,33)+(–283,01)== –802,34кДж. Энтальпия (теплота) образования вещества D fН 298
D fН (простых веществ, устойчивых при 298 К и давлении 101 кПа) = 0. (О2-газ, Br2-жидкость, Р-белый, Snбелое, Sромб.) Если вещества в стандартном состоянии - D fНo 298 – стандартная энтальпия образования вещества (табличные данные)
H2(г)+2O2(г)+S(к)=H2SO4(ж); Dr Н °298 = Δ fН 0298H2SO4= -811,3 кДж/моль
Следствие из закона Гесса:
Δ rН 0 = ∑ν i Δ fНi 0 продуктов - ∑ν j Δ fНj 0исх веществ
Зависимость Δ rН 0 от температуры - уравнение Кирхгофа: Т 1. ∆ rH0T = ∆ rH 0298 + ∫ ∆ rС0pdT 298 ∆ rСp о = Δ a +Δ bT +Δ c I T -2+Δ cT 2 - изменение стандартной теплоемкости системы в ходе реакции. Влияние температуры на Δ rН:
∆ rСp <0 ∆ rСp >0
∆ rСp =0
Т
2. Если пренебречь зависимостью Ср от Т (Ср =соnst): ∆ rН 0 Т = ∆ rН 0298 + ∆ rС 0 р (Т - 298) ∆ rСp о = ∑ν iСрi 0 прод - ∑ν jСрj 0исх веществ 3. Если считать ∆ rС 0 р = 0: ∆ rH0T = ∆ rH 0298
Задача Рассчитать ∆ rH 0298 и ∆ rH 01000 реакции С(к) + СО2(г) = 2СО(г), считая постоянными теплоемкости реагентов в данном температурном интервале. Решение. ∆ rН 0 Т = ∆ rН 0298 + ∆ rС 0 р (Т - 298) По табличным данным: Вещество: Δ fН 0298,кДж/моль С0р 298,Дж/моль.К С(графит) 0 8,54 СО2 (г) -393,5 37,41 СО (г) -110,5 29,14
Δ rН 0298 = 2Δ fН 0298 СОг - Δ fН 0298 Ск - Δ fН 0298 СО2г = = 2(-110,5) – 0 – (-393,5) = 172,5 кДж. Δ rН 0298 >0 - реакция эндотермическая.
Изменение теплоемкости системы: ∆ rС 0 р = 2 С 0 р 298СОг– С 0 р 298Ск– С 0 р 298СО2г= = 2 . (29,14)–8,54–37,41 =12,33 Дж/К.
∆ rН 01000 = 172,5 + 12,33.10-3.(1000 - 298) = 181,16 кДж.
При изменении температуры на 702К увеличение теплового эффекта составляет 5%. Задача. Рассчитать изменение внутренней энергии системы при изохорно-изотермическом протекании реакции С(к) + СО2(г) = 2СО(г) при 298К. Решение. Qp = Qv + ∆ν RT, QV = DU, Qp = D H, ∆ν = 2 - 1=1 ∆ rU 0298 = ∆ rH 0298 –∆ν RT = 175,2 – 1.8,31 . 298 . 10-3 = 172,7 кДж. Задача. Определить ∆ rH 0298 реакции (1) С(к) + СО2(г) = 2СО(г), если известно: (2) 2С(к) + О2(г) = 2СО(г), ∆ rH 0298 = -221 кДж (3) 2СО(г) + О2(г) = 2СО2(г), ∆ rH 0298 = -566,1 кДж. Решение. К термохимическим уравнениям можно применять любые алгебраические действия. ур.1 = ½(2С(к)+ О2(г)) - ½(2СО(г) + О2(г)) =½×2СО(г) - ½×2СО2(г) ∆ rH 01 = ½ (∆ rH 02 - ∆ rH 03) = ½[-221 – (-566,1)] = 172,5 кДж.
Энергия превращение
Состояние системы можно охарактеризовать микросостояниями составляющих ее частиц, т.е. их мгновенными координатами и скоростями различных видов движения в различных направлениях. Термодинамическая вероятность W:
Чем больше число микросостояний, тем более вероятна реализация состояния. S = k lnW S -энтропия:
k –постоянная Больцмана k = R/N =1.38×10-23 Дж/К 3-ий закон термодинамики (1911г. М. Планк):
W = 1, S = 0 При плавлении – S1- увеличивается При испарении – S 2 –увеличивается S 2 > S1 Акрист ® Ааморф DS > 0
S 0298(O2) = 205 Дж/(моль·К) состава молекул S 0298(O3) = 238,8 Дж/(моль·К) S вещества растет с ростом температуры и скачкообразно увеличивается в точках фазовых переходов
Тпл Ткип Т S – функция состояния системы 2–ой закон термодинамики:
D S (процессов) > 0 – переход из более упорядоченного состояния в менее упорядоченное - самопроизвольное протекание процесса вероятно (расширение газов, плавление, растворение). D S (процессов) < 0 – самопроизвольно маловероятно (сжатие газов, конденсация) Стандартная энтропия – S 0 (Дж/моль×К)-
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 166; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.142.98.108 (0.004 с.) |





 ½ур.2 – ½ур.3
½ур.2 – ½ур.3
 Энтропия.
Энтропия. Каковы движущие силы и критерии протекания самопроизвольных химических процессов?
Каковы движущие силы и критерии протекания самопроизвольных химических процессов? S 0298(O) = 161 Дж/(моль·К) за счет усложнения
S 0298(O) = 161 Дж/(моль·К) за счет усложнения S
S =
=
 Растворенное
Растворенное
 ∆ rН
∆ rН


